Introdução
A diabetes mellitus tipo 2 (DMT2) é uma patologia crónica e progressiva, cuja história natural assenta na interação entre fatores ambientais e genéticos predisponentes.
A fisiopatologia subjacente é complexa e engloba três mecanismos principais: o estado de insulinorresistência no tecido muscular, no tecido hepático e a falência da célula beta pancreática. Numa fase inicial, enquanto ocorre uma secreção eficiente de insulina, apesar da insulinorresistência no fígado e músculo, não existe hiperglicemia. Porém, ao longo da evolução da doença, há progressiva disfunção das células beta, conduzindo à elevação dos níveis de glicose séricos quer em jejum, quer pós-prandiais, levando ao desenvolvimento de DMT2.1 Associa-se a múltiplas complicações, macro e microvasculares, com elevado impacto na qualidade de vida dos doentes.
Em termos epidemiológicos, estima-se que 6,28% da população mundial tenha DMT2, o que corresponde a cerca de 462 milhões de doentes.2 A elevada prevalência desta patologia, a sua morbimortalidade e consequente impacto socioeconómico, tornam-na num dos principais desafios em saúde do século XXI.3
Neste sentido, ao longo das últimas décadas, tem-se assistido a um esforço continuado por parte da comunidade científica internacional para o desenvolvimento de novas opções farmacológicas eficazes no controlo glicémico da DMT2, sem efeitos secundários indesejáveis que condicionem a sua utilização.
Os inibidores do co-transportador de sódio-glicose 2 (iSGLT2) são uma nova classe de antidiabéticos orais, cujo mecanismo de ação assenta na diminuição da reabsorção de glicose ao nível do túbulo contornado proximal, com consequente aumento da excreção de glicose na urina e diminuição da glicémia.4 Os efeitos benéficos compreendem, além do controlo glicémico, a redução da pressão arterial, do peso, da albuminúria e de eventos cardiovasculares, sobretudo no contexto de insuficiência cardíaca.5,6) Não obstante, a glicosúria induzida por estes fármacos pode levar ao aparecimento de alguns efeitos adversos que, pela sua frequência, merecem uma investigação adicional.
Existe evidência que relaciona a toma de iSGLT2 com o aumento da frequência de infeções genitais.7-9 A associação com a ocorrência de infeções do trato urinário (ITU) também tem sido alvo de ampla discussão, havendo inclusive relatos de casos de doentes com urosépsis e necessidade de internamento.10 Porém, a evidência sobre a relação entre a terapêutica com iSGLT2 e o aumento da frequência destes eventos não aparenta ser congruente.7,11,12
Neste contexto, o objetivo do presente artigo passa por rever e analisar a evidência atual sobre a possível associação entre a utilização de iSGLT2 em doentes com DMT2 e a ocorrência de ITU.
Métodos
Realizou-se uma pesquisa bibliográfica de normas de orientação clínica (NOC) publicadas na The National Institute for Health and Care Excellence (NICE), meta-análises (MA), revisões sistemáticas (RS) e ensaios clínicos controlados e aleatorizados (ECCA) na The Cochrane Library (CENTRAL) e PubMed. A pesquisa incluiu apenas estudos em humanos e publicados na última década, nas línguas portuguesa, espanhola e inglesa. Utilizaram-se os termos MeSH: ‘Urinary Tract Infection’; ‘Sodium-Glucose Transporter 2 Inhibitors’ e ‘Diabetes Mellitus, Type 2’.
Os critérios utilizados para a inclusão de estudos nesta revisão foram definidos segundo o modelo PICO (população, intervenção, comparação, outcome). Foi definida como população alvo indivíduos adultos (≥18 anos), de ambos os sexos, com o diagnóstico de DMT2 e em que a intervenção terapêutica consistiu na administração de um iSGLT2, podendo ser qualquer um dos fármacos atualmente em comercialização ou em investigação, em comparação com ausência de qualquer intervenção ou utilização de placebo. O outcome estudado foi a ocorrência de ITU, considerando que o diagnóstico foi realizado com base em sinais e sintomas sugestivos das mesmas, de acordo com o Medical Dictionary for Regulatory Activities (MedDRA).
Procedeu-se a uma primeira seleção dos resultados, tendo em consideração o seu título. Realizou-se uma segunda seleção tendo em conta o respetivo abstract, para posterior leitura integral.
Excluíram-se os artigos aos quais não foi possível ter acesso, duplicados, escritos noutras línguas que não as anteriormente enunciadas, cuja definição de ITU era omissa ou cujo diagnóstico era baseado unicamente em resultados analíticos. Foram ainda excluídos estudos que envolviam a utilização de inibidores SGLT1/SGLT2 combinados.
A robustez metodológica dos ECCA incluídos foi avaliada utilizando a escala de Jadad. Aplicou-se a escala Strenght of Recommendation Taxonomy (SORT), da American Academy of Family Physicians, para atribuição de níveis de evidência (NE).13 A inclusão e a classificação dos artigos, segundo a taxonomia SORT, realizou-se pelos três autores de forma independente, tendo sido determinada através de discussão e concordância entre os mesmos.
Resultados
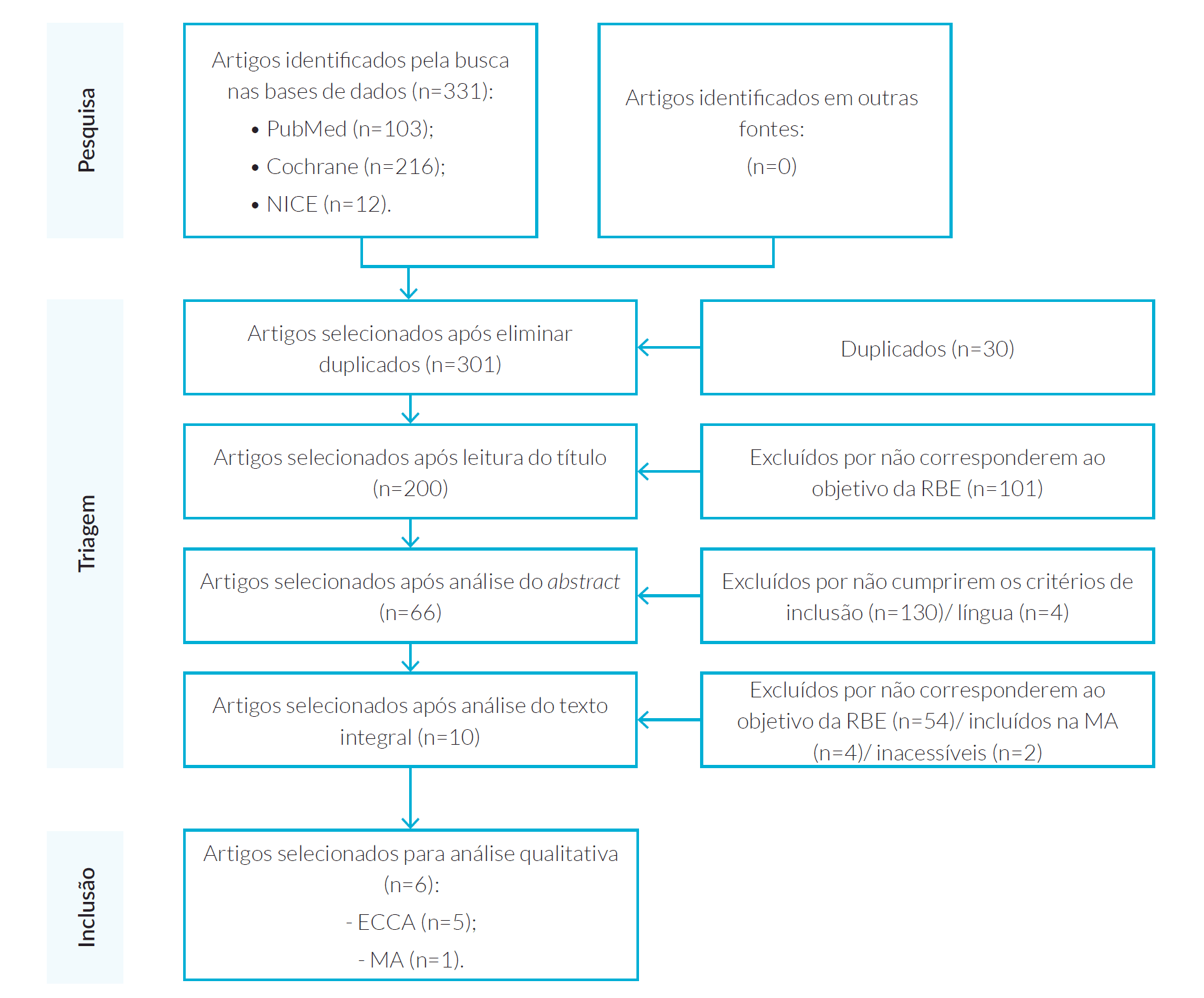
A pesquisa inicial identificou um total de 331 resultados (103 artigos na PubMed, 216 na CENTRAL e 12 na NICE), dos quais se obtiveram 301, após a remoção dos duplicados. Destes, foram excluídos 101 pelo título, por não cumprirem o objetivo desta revisão. Após a leitura do abstract, foram excluídos 4 resultados pela língua e 130 por não se enquadrarem no objetivo desta revisão. A partir da leitura integral foram excluídos 2 por inacessibilidade, 54 por incumprimento dos critérios de inclusão e 4 por terem sido incluídos na MA. Após a avaliação dos três revisores, foram incluídos 6 resultados, dos quais 5 ECCA (Tabela 1) e 1 MA (Tabela 2), conforme representado na Fig. 1.
Tabela 1: ECCA incluídos na revisão e as suas características.
| Referência | Metodologia | Intervenção | Outcome | Comentários | NE |
|---|---|---|---|---|---|
| Ensaios Clínicos Controlados e Aleatorizados (ECCA) | |||||
| Strojek, et al (2011) | ≥18 anos Glimepiride 4 mg/dia HbA1c≥7% e ≤10% n=597 Seguimento 24 semanas | Placebo( n=146) DAPA 2,5 mg (n=154) DAPA 5 mg (n=145) DAPA 10 mg (n=151) | Placebo (6,2%) DAPA 2,5 mg (3,9%) DAPA 5 mg (6,9%) DAPA 10 mg (5,3%) | 2 | |
| Kaku, et al (2013) | 18-79 anos HbA1c≥7% e ≤10% IMC ≤ 40 kg/ m2 TFG >60 mL/min/1,73 m2 n=279 Seguimento 12 semanas | Placebo (n=54) DAPA 1 mg (n=59) DAPA 2,5 mg (n=56) DAPA 5 mg (n=58) DAPA 10 mg (n=52) | Placebo (1,9%) DAPA 1 mg (1,7%) DAPA 2,5 mg (0,0%) DAPA 5 mg (1,7%) DAPA 10 mg (3,8%) | 2 | |
| Wilding, et al (2013) | 18-80 anos Insulinoterapia (≥30 unid./dia) HbA1c≥7,5% e ≤10,5% n=808 Seguimento 104 semanas | Placebo (n=197) DAPA 2,5 mg (n=202) DAPA 5 mg (n=212) DAPA 10 mg (n=196) | Placebo (3,6%) DAPA 2,5 mg (5,9%) DAPA 5/10 mg (9,4%) DAPA 10 mg (8,7%) | 48 semanas: DAPA 5 mg →10 mg | 2 |
| Kovacs, et al (2015) | ≥18 anos Pioglitazona (n=122) Pioglitazona+Metformina (n=376) HbA1c≥7% e ≤10% IMC ≤45 kg/m2 TFG≥30 mL/min/1,73 m2 n=498 Seguimento 76 semanas | Placebo (n=165) EMPA 10 mg (n=165) EMPA 25 mg (n=168) | Placebo (20,6%) EMPA 10 mg (17,6%) EMPA 25 mg (19,6%) | 2 | |
| Halvorsen, et al(2019) | ≥18 anos HbA1c≥7% e ≤10% IMC ≤45 kg/m2 TFG≥50 mL/ min/1,73 m2 n=286 Seguimento 96 semanas | Placebo (n=141) BEXA 20 mg (n=145) | Placebo (20,6%) BEXA 20 mg (14,5%) | 2 | |
BEXA - bexagliflozina; DAPA - dapagliflozina; EMPA - empagliflozina; HbA1C - hemoglobina glicada; IMC - índice de mas- mero; TFG - taxa de filtração glomerular.
Tabela 2: MA incluída na revisão e as suas características.
| Referência | Metodologia | Intervenção | Outcome | Comentários | NE |
|---|---|---|---|---|---|
| Meta-Análise (MA) | |||||
| Wang,et al(2021) | ≥18 anos Insulinoterapia ou metformina ou dieta n (total) = 19585 n (DAPA) = 6164 n (CANA) = 6731 n (EMPA) = 4121 n (ERTU) = 1355 n (IPRA) = 1214 | 35 ECCA: - 13 ECCA DAPA - 9 ECCA CANA - 7 ECCA EMPA - 4 ECCA ERTU - 4 ECCA IPRA | DAPA RR de 0,79 (IC95%: 0,62 a 1,00; p 0,05) CANA RR de 0,87 (IC95%: 0,68 a 1,12; p 0,29) EMPA RR de 0,89 (IC95%: 0,69 a 1,15; p 0,38) ERTU RR de 1,16 (IC95%: 0,68 a 1,97; p 0,89) IPRA RR de 0,96 (IC95%: 0,53 a 1,73; p 0,89) | ITU como outcome primário considerado como critério de elegibilidade. Após análise, verificou-se que nem todos os ECCA incluídos cumprem esse critério. | 2 |
BEXA - bexagliflozina; DAPA - dapagliflozina; EMPA - empagliflozina; ERTU - ertugliflozina; IPRA - ipragliflozina; IC - intervalo de confiança; n - número; p - p value; RR - risco relativo.
Ensaios clínicos controlados e aleatorizados
Em 2011, Strojek e colaboradores14 analisaram a eficácia e segurança da dapagliflozina em doentes medicados com glimepirida e com um controlo glicémico inadequado. O estudo decorreu durante 24 semanas, teve a participação de 597 doentes sob glimepirida 4 mg/dia, que foram aleatorizados em quatro grupos: placebo, dapagliflozina 2,5, 5 ou 10 mg. A hemoglobina glicada (HbA1c) média de base dos diferentes grupos era de 8,1%. Verificaram-se frequências de ITU semelhantes entre os diferentes grupos de dapagliflozina (2,6%, 2,8% e 2,6% nas dosagens de 2,5, 5 e 10 mg, respetivamente) e no grupo placebo (3,4%). Um doente sob dapagliflozina 10 mg descontinuou a toma do fármaco por ITU.
Noutro estudo relativo à dapagliflozina, Kaku e restantes investigadores15 realizaram um ECCA que integrou 279 doentes, com o objetivo de avaliar a eficácia e segurança da dapagliflozina em monoterapia, em doentes com controlo glicémico inadequado. Os doentes foram alocados a cinco grupos terapêuticos: dapagliflozina 1, 2,5, 5, 10 mg e placebo. A HbA1c média de base era de 8,1%. Ao fim de 12 semanas, verificou-se uma frequência semelhante de ITU entre os diferentes grupos: dapagliflozina 1 mg (1,7%), 5 mg (1,7%), 10 mg (3,8%) e placebo (1,9%). Não se verificaram suspensões do fármaco por ITU.
Ainda relativamente à dapagliflozina, Wilding e colaboradores,16 em 2013, definiram como objetivo a avaliação da eficácia e segurança do uso da mesma no tratamento de doentes diabéticos não controlados com ≥30 UI de insulina, com ou sem associação a antidiabéticos orais (até um máximo de dois). Os 808 doentes foram aleatorizados de modo a serem tratados com dapagliflozina 2,5, 5 e 10 mg ou placebo. Ao fim de 48 semanas de seguimento, o grupo sob dapagliflozina 5 mg passou a receber a dosagem de 10 mg (grupo dapagliflozina 5/10 mg). No início do estudo, os doentes apresentavam uma HbA1c média de 8,5%. Ao fim de 104 semanas, a frequência de ITU foi superior nos grupos tratados com dapagliflozina 2,5 mg (8,4%), dapagliflozina 5/10 mg (13,2%) e dapagliflozina 10 mg (13,8%), em comparação com placebo (5,6%). Três doentes suspenderam a toma de dapagliflozina por episódios de ITU.
Noutro ECCA, o estudo realizado por Kovacs e colaboradores17 teve como objetivo investigar a eficácia e segurança da empagliflozina em doentes sob pioglitazona e que estivessem, ou não, medicados com metformina. O estudo decorreu durante 76 semanas e teve a participação de 498 doentes. Estes foram aleatoriamente alocados a grupos terapêuticos com empagliflozina 10 mg, empagliflozina 25 mg ou placebo, verificando-se uma HbA1c média de 8,1%, no início do estudo. Constatou-se uma frequência de ITU de 22,4%, 22,0% e 26,7%, respetivamente. Não se verificaram suspensões do fármaco por ITU.
Por último, em 2019, Halvorsen e colaboradores18 realizaram um ECCA com o objetivo explorar a eficácia e segurança da bexagliflozina em monoterapia, com a participação de 286 indivíduos. Comparou-se a toma única de bexagliflozina 20 mg com a de placebo. No início do estudo, a HbA1c média entre os dois grupos era de 8,2%. Ao fim de 96 semanas, dos indivíduos que reportaram episódios sugestivos de ITU, 29 (20,6%) encontravam-se no grupo placebo e 21 (14,5%) no grupo bexagliflozina. Não existe menção à suspensão do fármaco por este efeito adverso.
No que diz respeito à robustez metodológica, todos ECCA incluídos foram avaliados com pontuação 5, segundo a escala de Jadad (Tabela 3).
Tabela 3: Robustez metodológica dos ECCA incluídos, segundo a escala de Jadad.
| Stroje, et al (2011) | Kaku, et al (2013) | Wilding, et al (2013) | Kovac, et al (2015) | Halvorsen, et al (2019) | |
|---|---|---|---|---|---|
| É randomizado/aleatorizado? | 1 | 1 | 1 | 1 | 1 |
| É duplamente cego? | 1 | 1 | 1 | 1 | 1 |
| Há descrição dos abandonos (perdas ou exclusões)? | 1 | 1 | 1 | 1 | 1 |
| É descrito o método de randomização? É adequado? | 1 | 1 | 1 | 1 | 1 |
| É descrito o método de ocultação? É adequado? | 1 | 1 | 1 | 1 | 1 |
| Total | 5 | 5 | 5 | 5 | 5 |
Meta-análise
A meta-análise de Wang e colaboradores19 teve como objetivo investigar o risco de ITU e infeções genitais associadas ao uso dos iSGLT2 e dos inibidores da dipeptidil-peptidase-4. Incluiu 55 ECCA e um total de 29 574 participantes, dos quais 35 ECCA e 19 585 participantes correspondiam à intervenção com iSGLT2. Concluiu-se que, em comparação direta com placebo, apenas a dapagliflozina aparentava estar associada a um maior risco de ITU (RR 0,79; IC 95%: 0,62 a 1,00; p = 0,05). No entanto, após comparação mista com os outros fármacos, esta associação não se mostrou tão evidente (RR 1,84; IC 95%: 0,48-7,04).
Não foram descritas nesta MA complicações decorrentes dos episódios de ITU.
Discussão
Após a análise dos ECCA (Tabela 1), constata-se uma discrepância quanto à frequência de ITU associadas à toma de iSGLT2, no que respeita à classe e às diferentes dosagens da mesma molécula. Enquanto classe, três dos cinco ECCA apontam para uma maior frequência de ITU com a toma dos iSGLT2 em estudo. Porém, os restantes dois ECCA mostram uma frequência inferior com a toma dos mesmos, quando comparados com placebo. Quando analisadas as diferentes dosagens da mesma molécula, verifica-se que a dapagliflozina na dosagem de 10 mg, parece estar relacionada com o aumento da frequência de ITU. No que diz respeito à empagliflozina e bexagliflozina, os resultados apontam para uma menor frequência de ITU nas dosagens em estudo. No entanto, ambas se encontram apenas representadas por um ECCA.
Relativamente à meta-análise (Tabela 2) é de salientar que o aumento significativo de ITU associado à toma de dapagliflozina, surgiu apenas quando realizada comparação direta com placebo, não se verificando após comparação mista. A interpretação destes resultados deve, portanto, ser feita de forma cautelosa.
No que respeita ao controlo metabólico, a HbA1c base média é semelhante em todos os ECCA analisados (entre 8,1% e 8,5%). Dessa forma, o grau de controlo metabólico de base não constituirá, à partida, um fator de enviesamento. Na sua globalidade, os estudos apresentam uma descida da HbA1c proporcional à dose do iSGLT2 em estudo, mas esta relação não se identifica entre o incremento de dose e a frequência de ITU. A consideração do nível de controlo metabólico constitui uma limitação, na medida em que não é feita uma análise de subgrupos que tenha em conta a HbA1c final.
Os autores atribuíram um nível de evidência 2 a todos os ECCA analisados, segundo a escala SORT. Trata-se de ECCA randomizados e aleatorizados, com um follow-up adequado, contudo com uma amostra de pequena dimensão (entre 279 e 808 participantes), tendo em consideração o seu objeto de estudo. Para além disso, todos eles compreendem estudos de eficácia e segurança, não integrando o aumento da frequência de ITU como outcome primário. Tal facto tem implicações na análise estatística realizada, uma vez que a mesma não é adequada e condiciona uma diminuição da robustez da evidência apresentada limitando a validade das conclusões. Devem ser ainda apontadas como limitações a heterogeneidade de duração da maioria dos ECCA (entre 12-104 semanas) e a disparidade na posologia dos iSGLT2.
A MA foi avaliada com um nível de evidência 2, uma vez que apresenta boa qualidade e análise estatística adequada, com baixa heterogeneidade entre os diferentes estudos. Foi realizada comparação direta entre os diferentes iSGLT2 e placebo e, posteriormente, efetuada uma análise em rede de todas as moléculas em estudo. Porém, devem ser apontadas algumas limitações. Os autores apontam como um dos critérios de seleção dos ECCA a ocorrência de ITU como outcome primário, mas quando analisados individualmente, verificou-se que alguns dos artigos não cumprem este critério. Para além disso, não é feita uma sub-análise por cada dosagem dos diferentes fármacos em estudo.
Apesar de terem sido excluídos estudos como EMPA-REG, CANVAS, DECLARE-TIMI e VERTIS-CV por não cumprirem os critérios de inclusão, os autores consideram pertinente a sua discussão por se tratar de estudos de grande dimensão e de referência. Globalmente, os estudos apresentam resultados semelhantes no que diz respeito ao risco de ITU com o uso de iSGLT2 em comparação com o placebo, não se identificando uma associação entre o seu uso e frequência de ITU. No EMPA-REG, a ocorrência geral de ITU foi de 18,0% e 18,1% nos grupos empagliflozina e placebo, respetivamente.20 No CANVAS, a incidência de ITU com canagliflozina e placebo foi de 40 versus 37 eventos por cada 1000 pacientes-ano.21 No DECLARE-TIMI, foram relatadas ITU em 1,5% e 1,6% dos pacientes tratados com dapagliflozina ou placebo.22 O VERTIS-CV constitui a exceção, registando-se uma frequência de ITU de 10,2% no grupo placebo em contraposição com 12,2% no grupo ertugliflozina 5 mg (RD: 2,1; IC 95%: 0,4 a 3,7; p = 0,02) e de 12,0% na dosagem de 15 mg (RD: 1,8; IC 95%: 0,2 a 3,5; p = 0,03).23
Os autores destacam como ponto positivo deste estudo a aplicação da escala SORT, uma vez que esta valoriza os resultados orientados para o doente. De forma a dar cumprimento a esta premissa, e para uniformizar a seleção dos artigos, foi tida em conta a definição de ITU de acordo com a classificação MedDRA, através da descrição de sinais e sintomas, ao invés da obtenção do diagnóstico por exames complementares.
Apesar de existir evidência que a utilização de iSGLT2 se associa com a ocorrência de infeções genitais, o mesmo não se verifica, de forma tão robusta e consistente, com a ocorrência de ITU. Segundo alguns autores, uma justificação encontrada para esta discrepância, prende-se com o aumento da diurese e poliúria causada pelos iSGLT2. Ao gerar um aumento do fluxo urinário, ocorre uma redução da carga bacteriana nas vias urinárias, o que parece justificar a fraca associação com ocorrência de ITU.24
De acordo com a revisão efetuada, a evidência aponta para que os iSGLT2 não sejam responsáveis pelo aumento da frequência de ITU em doentes com DMT2. Porém, verifica-se uma escassez de ECCA cujo outcome primário seja a ocorrência de ITU. Adicionalmente, os ECCA analisados apresentam tempos de follow-up heterogéneos e tamanho amostral reduzido. Para além disso, apenas uma meta-análise cumpriu os critérios de inclusão definidos. Serão necessários estudos adicionais, metodologicamente robustos, que tenham como um dos seus outcomes principais o aumento da frequência das ITU.