INTRODUÇÃO
O vírus denominado SARS-CoV-2 foi observado inicialmente aquando do aparecimento de casos inexplicados de pneumonia na cidade de Wuhan (1) (2), em dezembro de 2019. Contudo, existe a possibilidade de o vírus se encontrar em circulação previamente a essa data (2).
Desde o aparecimento dos primeiros casos que este vírus apresentou um rápido crescimento e, em março de 2020, o surto de infeção pelo Coronavírus 2 foi declarado como uma situação de pandemia.
À data atual, e apesar de todas as medidas implementadas, como o uso de máscara, distanciamento social e o tracing, contabilizam-se mais de quatro milhões de mortes reportadas e, obviamente, um enorme impacto a nível económico e social (4) (5).
Dada a falência das medidas, a comunidade científica focou os seus esforços no desenvolvimento de uma vacina (6). Desde novembro de 2020 que dezenas se encontravam em desenvolvimento com o objetivo de gerar anticorpos, dirigidos à espícula.
A capacidade de gerar imunidade é um fator chave para controlar a pandemia. Atualmente, os estudos mostram que a imunidade é gerada através de infeção (6) por SARS-CoV-2 ou através da vacinação (7) (8). Esta confere um certo grau de proteção em caso de reinfeção e/ou redução do risco de situações clínicas severas (9) (10).
Os estudos atuais debruçam-se mais sobre a avaliação da resposta de fase aguda. Do conhecimento adquirido, sabe-se que o nível de anticorpos diminui entre a fase aguda e a fase de memória, sendo, de momento, impossível calcular a “semivida” em termos de imunidade devido aos dois grandes pilares na infeção por SARS-CoV-2 que atuam como ramos diferentes, nomeadamente a imunidade imediata, responsável pela produção de anticorpos pelas células plasmáticas, e uma resposta imunológica de memória onde células T helper possibilitam a produção de células plasmáticas long-lived que mantém a secreção de anticorpos (11) (12) (13) (14).
Como comprovado em estudos prévios, células B periféricas e células plasmáticas produtoras de anticorpos podem apresentar-se como populações reguladas independentemente e desempenham diferentes papéis na imunidade (15).
No que concerne ao COVID-19, a discussão sobre qual o aspeto da imunidade (humoral ou celular) se correlaciona com a proteção imunológica mantém-se em aberto (16). Contudo, o padrão que se começa a formar revela participação de ambas no contributo para o controlo da infeção por SARS-CoV-2, tal como acontece com outras vacinas, como é o exemplo do tétano (17) (18) (19) (20).
Ademais, níveis neutralizantes de anticorpos estão correlacionados com proteção imunitária em estudos com primatas (21) (22). Porém, o nível de anticorpos necessário para manter a imunidade e o tempo que essa durará permanece desconhecido (23).
O receio sobre estas questões foi potenciado pelo surgimento e crescimento exponencial de variantes de SARS-CoV-2 com alterações genéticas na proteína da espícula. Os estudos demonstram que a vacina Pfizer-BioNTech mantém uma boa reatividade cruzada contra a maioria destas, ainda que com níveis reduzidos de anticorpos neutralizantes (24) (25).
No que se refere à influência que as variáveis podem ter na resposta imunitária, as observações atuais sugerem que esta seja mais robusta em indivíduos com imunidade prévia, nomeadamente o atingimento de níveis de anticorpos após uma dose de vacina comparáveis aos dos indivíduos com duas doses sem essa mesma imunidade (25) (26) (27).
De igual forma, a ciência sugere um maior nível de anticorpos em indivíduos do sexo feminino em resposta à vacinação ou infeção (28) (29). Os mecanismos para esta diferença não estão bem esclarecidos, mas, quando em contacto com o SARS-CoV-2, este apresenta não só uma resposta imune mais vigorosa como também uma melhor capacidade de combater a infeção (3), o que pode justificar o maior número dos casos clínicos complicados em indivíduos do sexo masculino (31).
Quanto à associação da idade com a imunidade vacinal conferida pela vacina para COVID-19, observa-se um maior nível de anticorpos em indivíduos mais jovens, tal como acontece para outras vacinas (32). Por outro lado, o envelhecimento está relacionado com a imunosenescência, que pode levar a uma fraca resposta vacinal, em especial com diferenças qualitativas na diferenciação das células produzidas (33).
Contudo, tanto para o sexo como para a idade, vários estudos reportam uma influência mínima para jovens saudáveis (34) (35).
Este estudo retrospetivo longitudinal tem como objetivo avaliar o efeito imunogénico da vacina BNT16b2 em profissionais de saúde serologicamente negativos e a forma como este se compara com indivíduos com imunidade prévia. Pretende-se ainda avaliar o comportamento quantitativo dos anticorpos durante um período de seis meses bem como a influência da idade e do sexo nos seus níveis, contribuindo, assim, para ampliar a compreensão da relação entre a imunidade mensurável e a proteção clínica contra COVID-19 e a relevância da sua quantificação.
MÉTODO
Um estudo serológico foi conduzido em todos os profissionais de saúde do Hospital Senhora Oliveira Guimarães vacinados com a BNT16b2. O estudo inclui indivíduos entre os 19 e 70 anos, de ambos os sexos, de diferentes atividades profissionais, divididos em dois grupos: sem evidência de infeção prévia (seronegativos) ou com evidência de infeção prévia (seropositivos), seja por terem um teste RT-PCR positivo prévio à primeira inoculação ou por apresentarem níveis de anticorpos positivos.
Todos os profissionais foram vacinados de acordo com a campanha nacional de vacinação (DGS Norma 002/2021 e 021/2020) e deram o seu consentimento para a participação no estudo.
Tendo em conta a eficácia de 95% contra a primeira variante (HU-1 Wuhan) e o seu perfil de segurança, a BNT16b2 (35) foi escolhida como a vacina a ser administrada aos profissionais. Esta é uma vacina de RNA que codifica a proteína da espícula, responsável por despoletar a resposta imune contra o antigénio (36).
O processo de vacinação ocorreu a partir de 29 de dezembro de 2020 com um intervalo de 21 dias entre doses. Para efeito deste estudo, consideramos os profissionais vacinados até 11 de março de 2021, inclusive.
O desenho do estudo baseia-se no doseamento serológico até 48h antes da vacinação, um, três e seis meses após vacinação completa. Inicialmente, foi decidido que só os indivíduos seronegativos seriam vacinados; contudo, por razões logísticas do processo de vacinação, alguns indivíduos em quem, posteriormente, se observou seropositividade também foram vacinados.
O teste usado para os doseamentos no presente estudo foi desenhado pela Abbot (38) e baseia-se no princípio de que títulos de proteína anti-spike se correlacionam significativamente com neutralização do vírus, visto que é, potencialmente, o principal e único alvo dos anticorpos neutralizantes (39). Este teste é um imunoensaio de micropartículas que permite a determinação qualitativa e quantitativa de anticorpos IgG.
Os profissionais foram submetidos a testes RT-PCR, em caso de sintomas gripais, antes e após a vacinação, de acordo com a Direção Geral da Saúde (Norma 015/2020), assim como foram mantidas todas as medidas de controlo durante este período de tempo.
RESULTADOS
Identificamos 1387 participantes do estudo, dos quais 412 são pessoal médico, 544 enfermeiros/as; 256 assistentes operacionais, 17 assistentes técnicos, 158 desempenham outras funções (farmacêuticos, informáticos, docência, técnicos superiores, dirigentes e técnicos de diagnóstico e terapêutica).
Tirando o momento zero, em que todos colheram amostra sanguínea, o primeiro mês foi o que teve mais adesão com 1023 profissionais, enquanto no sexto mês se observou mais absentismo, com 434.
No total, 391 seguiram escrupulosamente o desenho do estudo, sendo a maioria pertencente à profissão de enfermagem. A amostra era predominantemente feminina com 313 mulheres e 78 homens; a idade média dos profissionais era 42,66 anos.
Destes, dividimos em duas coortes: os que tinham evidência de ter tido COVID-19 antes (seropositivos) e os que não tinham (seronegativos) (n=341).
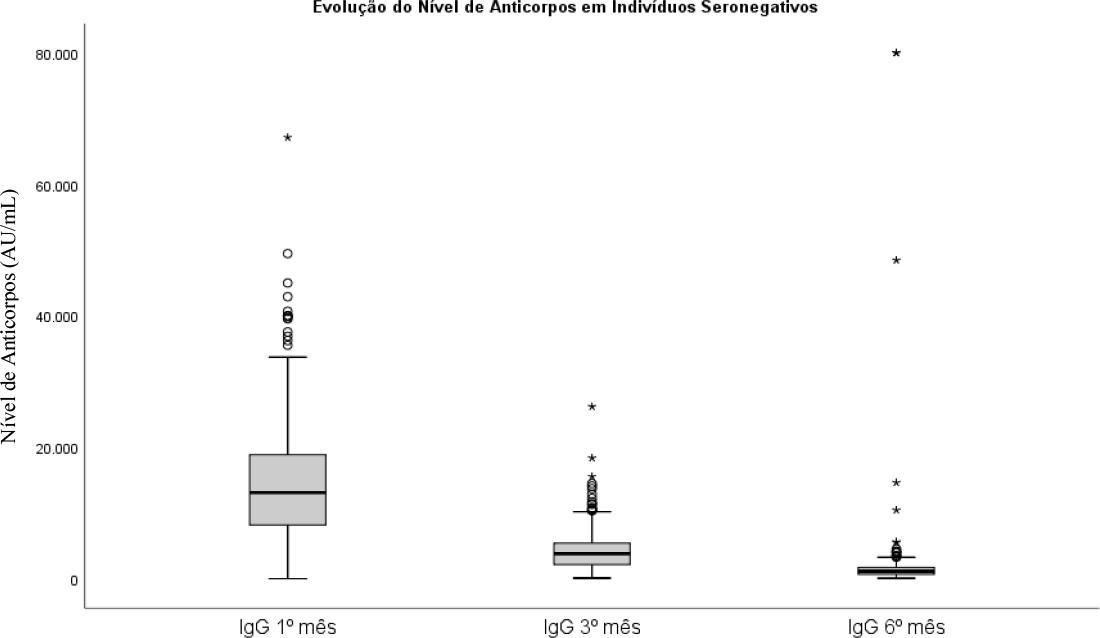
Destes últimos, o valor fornecido pelo teste Abbot utilizado era igual para todos os indivíduos (<6.8(AU/mL)). Assim, primariamente, procedeu-se a uma distribuição normal dos valores e posteriormente à análise do nível de anticorpos no primeiro, terceiro e sexto mês após vacinação completa, cujos resultados são apresentados na Tabela 1. Foi verificado o pressuposto da normalidade das distribuições através de uma análise virtual sobre o tipo de simetria, com recurso a histogramas de distribuições. De igual modo, testou-se a hipótese, através de teste t, que as médias entre as diferentes medições eram significativas. Efetivamente, rejeita-se a hipótese de igualdade (p<0.001), havendo diferenças significativas entre elas. O nível de anticorpos médios no primeiro mês era 14884 AU/mL (com um desvio padrão de 9495 AU/mL). No terceiro mês era 4296 AU/mL (com um desvio de 3052 AU/mL) e aos seis meses 1972 AU/mL (com um desvio 6636 AU/mL).
Tabela 1 Sumário das médias, desvios padrão, limite superior e inferior dos intervalos de confiança a 95% para o primeiro, terceiro e sexto mês em indivíduos sem infeção prévia.
| Nível de anticorpos | Média (AU/mL) | Desvio Padrão (AU/mL) | Limite Inferior (AU/mL) | Limite Superior (AU/mL) |
|---|---|---|---|---|
| 1.º mês | 14884 | 9495 | 39 | 67133 |
| 3.º mês | 4296 | 3052 | 124 | 26208 |
| 6.º mês | 1972 | 6636 | 109 | 80000 |
Pelos resultados obtidos, há evidência de um grande número de outliers em todos os momentos.
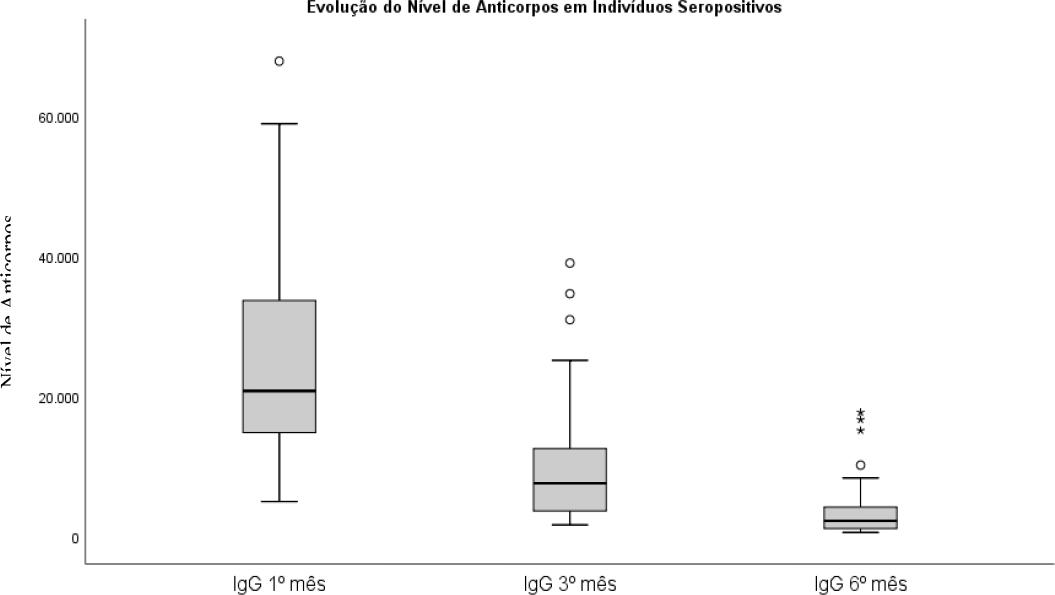
Igualmente, foram avaliados os mesmos parâmetros para os indivíduos com evidência de infeção prévia por COVID-19 (seropositivos). Os resultados são apresentados na Tabela 2. O nível de anticorpos médios no 1º mês era 25194 AU/mL (com um desvio padrão de 14599 AU/mL). No terceiro mês era 9899 AU/mL (com um desvio de 8417 AU/mL) e aos seis meses 3866AU/mL (com um desvio 3999 AU/mL).
Tabela 2 Sumário das médias, desvios padrão, limite superior e inferior dos intervalos de confiança a 95% para o primeiro, terceiro e sexto mês em indivíduos com infeção prévia.
| Nível de anticorpos | Média (AU/mL) | Desvio Padrão (AU/mL) | Limite Inferior (AU/mL) | Limite Superior (AU/mL) |
|---|---|---|---|---|
| 1.º mês | 25194 | 14599 | 5036 | 67866 |
| 3.º mês | 9899 | 8417 | 1717 | 39057 |
| 6.º mês | 3866 | 3999 | 640 | 17766 |
Observamos que, notavelmente, todos os profissionais, sejam seronegativos ou positivos, responderam completamente ao esquema vacinal com um incremento nos anticorpos IgG, podendo-se assumir que há diferenças estatísticas entre as médias das duas coortes, visível pela não sobreposição de intervalos de confiança.
O que encontramos é que participantes seropositivos tinham níveis médios de anticorpos superiores, em todos os doseamentos, comparativamente aos seronegativos, mas que seguiam uma evolução semelhante (Gráfico 1 e 2).
No que diz respeito à avaliação da serologia por sexo nos diferentes momentos: no primeiro e terceiro mês (Gráfico 3 e 4) rejeita-se a hipótese de igualdade (p<0.001), verificando-se diferença estatística entre si, sendo que os indivíduos do sexo feminino apresentam níveis superiores de anticorpos.
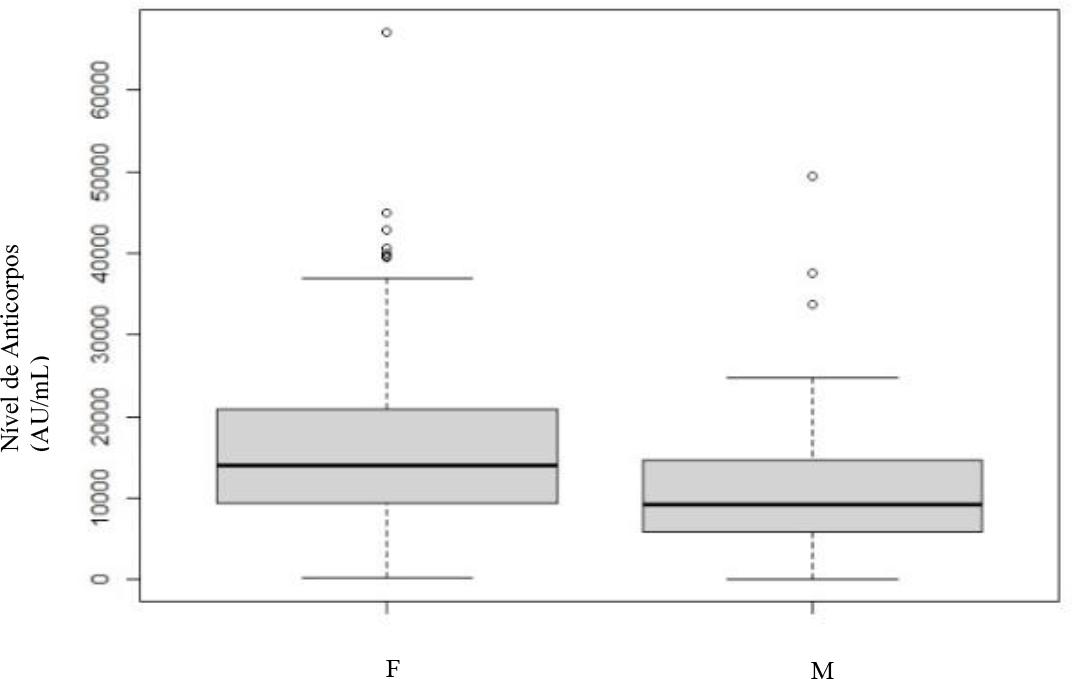
Gráfico 3 Doseamento dos níveis de anticorpos no 1º mês após vacinação completa - sexo masculino (M) e feminino (F).
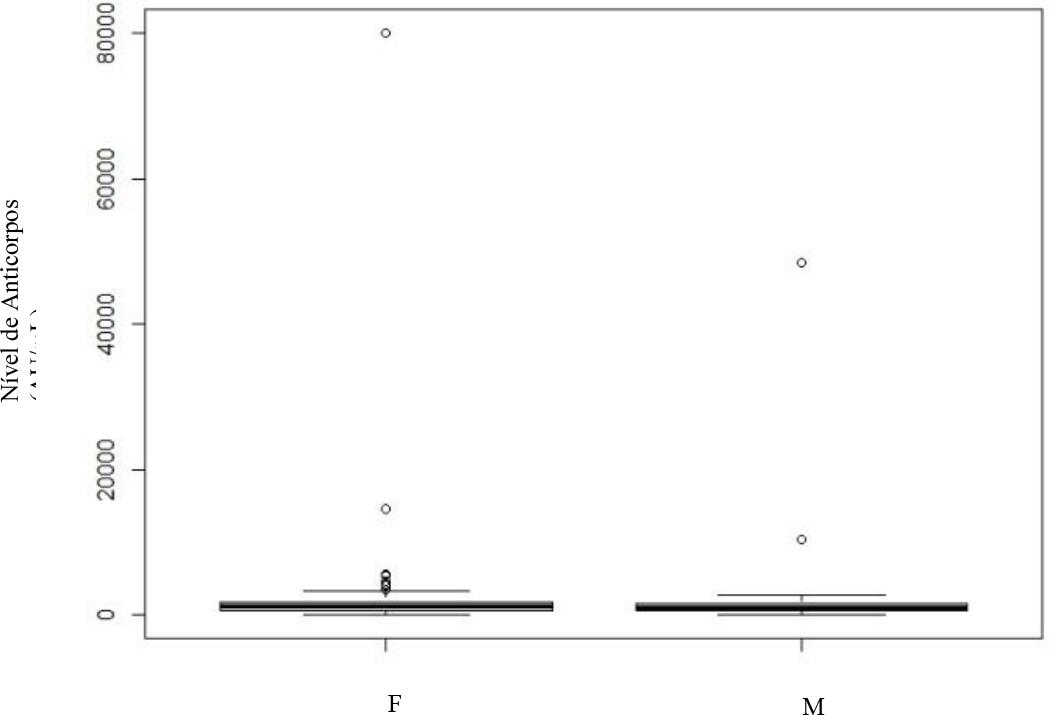
Gráfico 4 Doseamento dos níveis de anticorpos no 3º mês após vacinação completa - sexo masculino (M) e feminino (F).
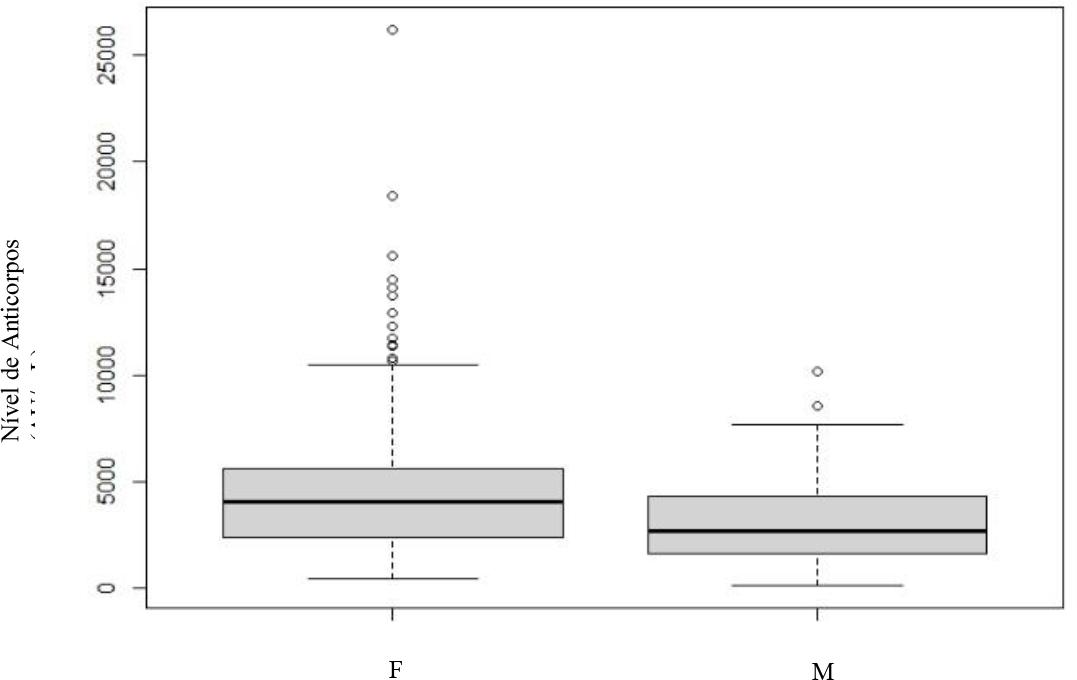
Gráfico 5 Doseamento dos níveis de anticorpos no 6º mês após vacinação completa - sexo masculino (M) e feminino (F).
Observa-se ainda a presença de vários outliers dispersos, especialmente nos indivíduos do sexo feminino. Já na avaliação do sexto mês (Gráfico 5) não há evidência estatística da existência de diferenças significativas entre os dois grupos (p>0.001).
Nos Gráficos 6, 7 e 8 são apresentados os resultados da ANOVA para as diferentes idades divididas por classes, para o primeiro, terceiro e sexto mês, com o intuito de perceber o efeito da idade nos níveis de anticorpos, sendo estas:
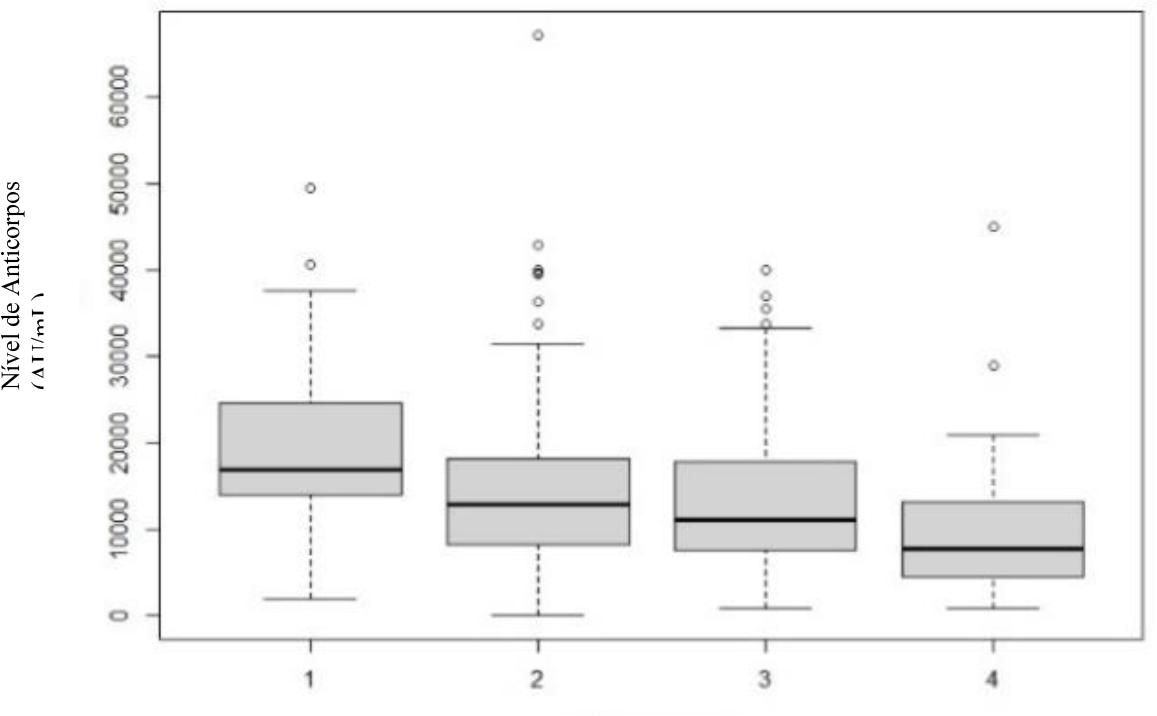
Gráfico 6 Níveis de anticorpos, por classe etária, no 1.º mês após vacinação completa. Classe 1: <30 anos; Classe 2: 31-45 anos; Classe 3: 46-60anos; Classe 4: >61 anos.
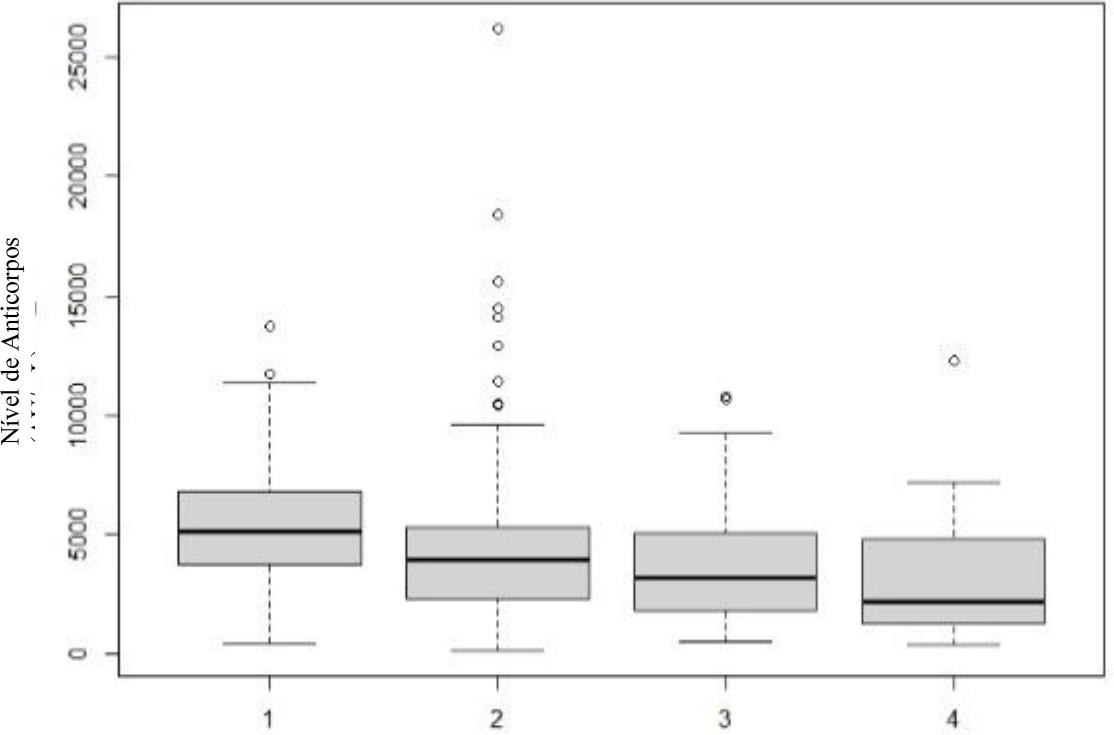
Gráfico 7 Níveis de anticorpos, por classe etária, no 3.º mês após vacinação completa. Classe 1: <30 anos; Classe 2: 31-45 anos; Classe 3: 46-60 anos; Classe 4: >61 anos.
Quando se avaliou a idade, verificou-se que há interação entre esta e o nível de anticorpos, mas que esta vai progressivamente decrescendo ao longo do tempo. Ou seja, no primeiro mês há evidência estatística que existe diferença entre classes, rejeitando-se a hipótese de igualdade (p=0,014). Ou seja, a idade tem influência no nível de anticorpos e há pelo menos uma classe afastada das outras, nomeadamente os indivíduos mais jovens e os mais velhos. Esta influência diminui no terceiro mês (p=0,017) e no sexto mês volta a ter influência (p= 0,014). Porém, no último doseamento, levanta-se a hipótese que a presença de outliers na classe 1 seja suficiente para causar esta diferença entre médias.
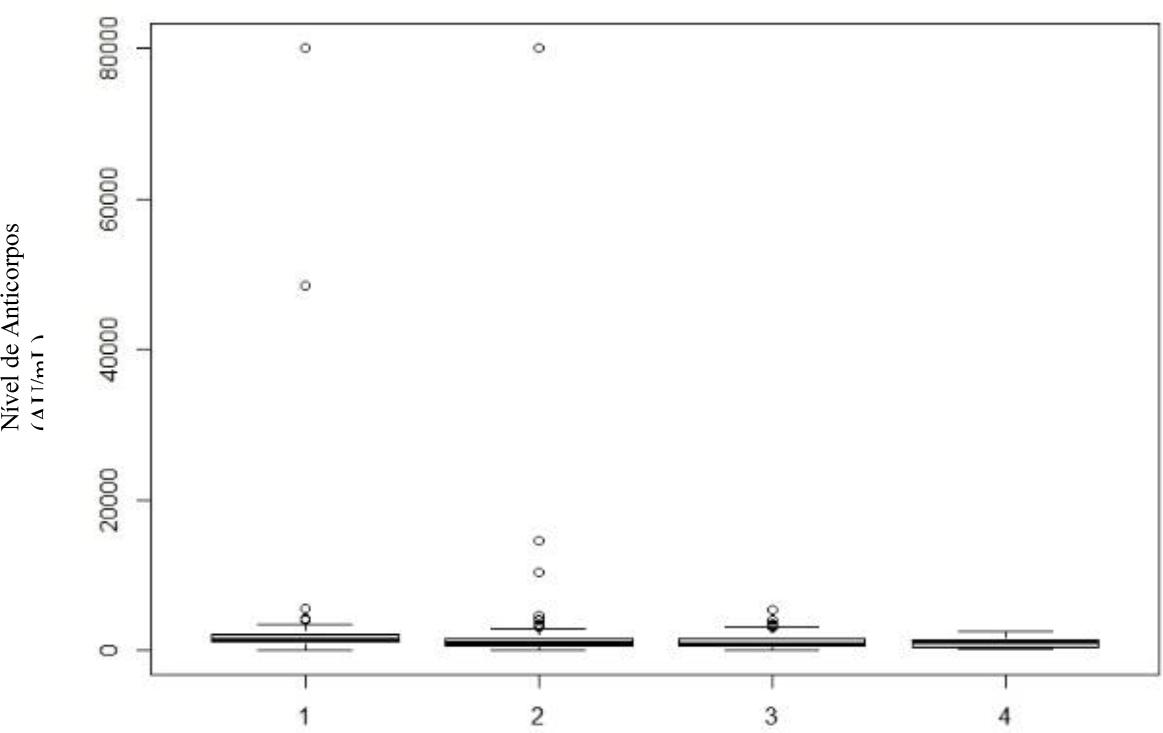
Gráfico 8 Níveis de anticorpos, por classe etária, no 6.º mês após vacinação completa. Classe 1: <30 anos; Classe 2: 31-45 anos; Classe 3: 46-60 anos; Classe 4: >61 anos.
Acrescenta-se ainda que, à data da realização deste artigo (setembro 2021), contabilizaram-se quinze casos após vacinação. Para o mesmo período previamente à vacinação, ou seja, a partir de julho até 29 de dezembro de 2020, totalizaram-se 231 casos.
DISCUSSÃO
A colheita com mais adesão foi a primeira, pela facilidade do processo devido à infraestrutura organizacional posta em prática no Hospital. Congruentemente, o sexto mês, pela necessidade de maior iniciativa pessoal e tempo despendido, foi o que teve menos participação.
A observação de uma resposta vacinal na ordem dos 100% nos indivíduos, sendo todos imunocompetentes, não é surpreendente. Esta, bem como o decréscimo da resposta humoral ao longo do tempo, apresenta-se em concordância com estudos prévios e como já descrito para outras vacinas comercializadas (12) (15) (36).
Nesta análise, demonstramos ainda, em concordância com estudos prévios (26) (40), que indivíduos previamente infetados têm uma resposta intensa a apenas uma dose da vacina, com níveis de anticorpos superiores aos profissionais seronegativos. Gaebler et al. justificam esta resposta rápida e eficaz demonstrando um aumento na capacidade de mutação somática e, consequentemente, na produção de anticorpos com maior poder neutralizante e potência por parte das células B de memória ao longo dos seis meses.
Dentro daquilo que são as respostas humorais observadas, constatamos uma larga amplitude dos intervalos de confiança e a existência de variadas discrepâncias que acentuam a importância da variabilidade individual no desenvolvimento da resposta imunitária.
Destas discrepâncias, salientamos a existência, no sexto mês após a vacinação, de um indivíduo que atinge níveis de anticorpos IgG na ordem dos 80 mil AU/mL. Assumimos que terá sido um caso de infeção assintomática pós-vacinação, mas evidencia, de forma clara, a capacidade de construção de resposta imune dos indivíduos vacinados.
Esta informação, aliada ao conhecimento do decréscimo marcado e generalizado dos níveis de anticorpos (41) (42) (44) ao longo do tempo, levanta a hipótese da necessidade de uma terceira dose de reforço para prolongar a duração da proteção.
No que concerne à análise da influência do sexo, constatamos uma resposta mais robusta em mulheres, porém esta diferença tornou-se irrelevante no sexto mês. Apesar do desconhecimento da etiologia, a resposta imune é, geralmente, mais marcada para o sexo feminino (43). Importa ainda referir que a prevalência, neste estudo, de indivíduos do sexo feminino poderá explicar as discrepâncias (outliers) observadas, em termos quantitativos, dentro desse mesmo grupo.
Do mesmo modo, e como sugerido por Wheeler et al. (2021), a idade apresenta uma fraca influência nos níveis de anticorpos, especialmente comparando faixas etárias de escalões mais jovens, como é o caso da nossa amostra. Tal como acontece para o sexo, esta influência é mais marcada no período imediato após a vacinação, mas vai esmorecendo com a evolução temporal.
Concluímos que, independentemente da resposta inicial, da serologia prévia, do sexo ou idade, é provável que todos os indivíduos vacinados atinjam um planalto aos seis meses e que as últimas duas variáveis enunciadas (sexo e idade) não influenciem marcadamente o nível de anticorpos. O significado imunitário deste planalto é ainda desconhecido.
No entanto, encontramos um risco substancialmente inferior de infeção por SARS-CoV-2 sintomática no período pós-vacinação (45) (46) em profissionais seropositivos comparativamente ao período prévio à vacinação, apesar dos dados do Instituto Ricardo Jorge reportarem que quase 100% dos casos pertenciam à variante Delta desde meados de junho de 2021 (47).
Este conhecimento corrobora a hipótese da capacidade adaptativa das nossas células de memória.
Contudo, uma limitação deste estudo é a impossibilidade de inferir a eficácia da vacina através da concentração de anticorpos. A testagem de indivíduos sintomáticos afigurou-se como o método mais custo-efetivo e bem recebido pelos profissionais de saúde; contudo, as infeções assintomáticas foram severamente subapuradas. À semelhança de outros estudos em larga escala (7), este método foi padronizado segundo as normas da DGS em vigor, contando com o conhecimento científico e espirito crítico de cada um para a testagem. Dessa forma, e apesar da natureza observacional dos dados apresentados não nos permitir comentar acerca da eficácia da vacina, a exuberância na diferença de números de casos positivos sintomáticos antes e após a vacinação corrobora os dados apresentados pelos fabricantes sobre a eficácia da vacina (42) (46) (48).
De igual modo, não podemos correlacionar os níveis de anticorpos com a resposta celular porque esta não foi mensurada neste artigo.
Outra limitação que se pode apontar a este estudo relaciona-se com o facto de não ser uma amostra representativa de toda a comunidade, uma vez que exclui a população não ativa e engloba um grupo restrito de pessoas cuja atividade profissional acarreta uma maior exposição a risco biológico. Apesar do significado imunológico dos anticorpos permanecer uma incógnita, a resposta vacinal na população em geral tem de ter em conta a existência de indivíduos de diferentes faixas etárias, com diferentes comorbilidades e entendimentos das medidas de segurança.
Obviamente, é necessário manter o acompanhamento desta e de outras coortes, incluindo marcadores de imunidade humoral e celular, para que se possa avaliar a magnitude e duração da proteção em caso de reinfeção, doença sintomática, hospitalizações ou morte e o efeito de proteção na transmissão.
CONCLUSÃO
Se, por um lado, os efeitos práticos da vacinação são extremamente animadores, neste momento é impossível inferir uma relação de causalidade entre os níveis de anticorpos doseados e a eficácia da vacina, especialmente em relação à população geral.
Não estando aprovado, e apesar da sua fácil utilização, acreditamos que a testagem da resposta humoral não é uma ferramenta fidedigna no seguimento pós-vacinação para seleção de indivíduos que precisem de associar uma nova dose precocemente. Assim, tal como indicado pela Direção Geral da Saúde (Norma 002/2021), a dose de reforço deve ser administrada seis meses após o esquema inicial, dispensando o doseamento de anticorpos para tal, visto que este é o período em que se atinge o plateau após seis meses de decréscimo do título de anticorpos, como constatado neste estudo.
Estamos convictos de que a questão imperativa a investigar prende-se com a proteção conferida pela vacinação para SARS-CoV-2, para que os limiares necessários à imunidade de grupo sejam conhecidos e, consequentemente, para possibilitar uma melhor gestão da pandemia.
Esta gestão é particularmente importante no âmbito da saúde ocupacional, uma vez que os profissionais de saúde se encontram particularmente expostos à infeção por COVID-19, com vastas consequências físicas e psicológicas. Assim, um maior entendimento das medidas de proteção e prevenção que podem ser postas em prática irá permitir mitigar estes riscos e exercer em plenitude o papel da saúde ocupacional, privilegiando o bem-estar dos colaboradores.