Introdução
A biópsia assistida por vácuo (BAV) de lesões mamárias desempenha um importante papel diagnóstico e/ou terapêutico, em especial nas lesões benignas e lesões B3, com indicações em contínua expansão.1,2,3Nos últimos anos, o avanço do conhecimento e o desenvolvimento da técnica tem permitido otimizar este precedimento.1
O dispositivo da BAV é essencialmente uma agulha de maior calibre do que a usada na microbiópsia (“core biopsy”), geralmente entre 7 e 11Gauge (G) em vez de 14G, adicionada a uma câmara de sucção e a lâmina de corte rotativo. Os aparelhos de BAV mais recentes permitem a obtenção de várias amostras através de um único acesso, sem necessidade de reinserção da agulha.1,3
A BAV pode ser efetuada em diferentes métodos imagiológicos usados no contexto do estudo da glândula mamária, incluindo a mamografia, ecografia, tomossíntese e ressonância magnética (RM).1,4A BAV guiada por estereotaxia é geralmente usada em casos de microcalcificações suspeitas,1 observadas no estudo mamográfico.
A principal vantagem dos dispositivos BAV reside na sua capacidade de extrair grandes amostras de tecido, em alguns casos com excisão completa da lesão, com consequente otimização da representatividade da amostra. Pode ser utilizada para re-avaliação em caso de microbiópsia não representativa da lesão imagiológica, ou na avaliação de eventual upgrade em lesões B3 e implica menor risco de discordância com o diagnóstico anátomo-patológico na peça operatória.1,2,3
Tem sido reconhecido um papel crescente da BAV na abordagem das lesões B3 (lesões com potencial maligno incerto) diagnosticadas em microbiópsia. As lesões B3 são um grupo heterogéneo de lesões com diferente risco de malignidade, que inclui a atipia epitelial plana de células colunares, lesões papilares, cicatriz radiária/lesão esclerosante complexa (LEC), neoplasia lobular clássica, tumor filóide e hiperplasia ductal atípica.1,2As recomendações atuais preconizam a BAV como método de avaliação preferencial (em vez da opção da excisão cirúrgica) para determinadas lesões B3 diagnosticadas em microbiópsia, incluindo a atipia epitelial plana, papiloma/lesões papilares sem atipia, LEC e a neoplasia lobular clássica.2
O carcinoma in situ, nomeadamente o carcinoma ductal in situ (CDIS) incorpora um espectro de lesões categorizadas com base em características mamográficas e em características anátomo-patológicas como a presença ou ausência de necrose e o grau nuclear.6 As microcalcificações constituem o achado mamográfico mais frequente nos casos de CDIS, embora a manifestação radiológica possa também ocorrer sob a forma de nódulo ou distorção arquitetural.5,6Imagiologicamente, a extensão do CDIS é avaliada com maior precisão através de RM.6 Vários fatores têm sido associados a subestimação histológica, nomeadamente presença de lesão palpável, dimensão da lesão, categoria BI-RADS, grau histológico e presença de necrose.7
A BAV aumenta a probabilidade de deteção de eventual componente invasivo (CI) num contexto de diagnóstico de CDIS, resultando em taxas de subestimação do componente invasivo em BAV muito inferiores às registadas com a microbiópsia.1,3,5
O presente estudo tem como objetivo a caracterização de lesões submetidas a BAV no IPOLFG num período de 15 meses, comparando o padrão imagiológico e o diagnóstico anátomo-patológico.
Pretendemos avaliar padrões imagiológicos, os respetivos diagnósticos anátomo-patológicos e a concordância entre o diagnóstico anátomo-patológico na BAV e na peça cirúrgica, em especial nos subgrupos dos papilomas e dos CDIS.
Material e Métodos
Procedemos à análise retrospetiva de todas as BAV guiadas por estereotaxia ou ecografia, realizadas num período compreendido entre janeiro de 2018 e março de 2019. Não foram incluídas as BAVs guiadas por ressonância magnética. Foram incluídos os casos em que tanto o estudo radiológico como o diagnóstico anátomo-patológico foram realizados no IPOLGF.
O estudo foi aprovado pela Comissão de Ética do IPOLFG (UIC/1348).
Avaliámos dados clínico-epidemiológicos (idade, sexo, história pessoal de carcinoma da mama e padrão mamário ACR/American College of Radiology), dados radiológicos (mamografia e ecografia), nomeadamente a forma de apresentação (microcalcificações, nódulo, distorção arquitetural ou assimetria de densidade), características das microcalcificações (morfologia e distribuição) e a categoria BI-RADS atribuída. Foi revisto o diagnóstico anátomo-patológico relativo à avaliação da amostra da BAV e da peça operatória (quando a cirurgia foi efetuada no IPOLFG).
Quando a forma de apresentação se traduz por microcalcificações, a prática instituída no Serviço de Radiologia no IPOLFG inclui a realização de radiografia dos fragmentos obtidos de forma a demonstrar a presença de microcalcificações e suportar uma amostragem representativa (não incluindo necessariamente a totalidade das microcalcificações). No final do procedimento é colocado um clip metálico de referenciação.
No subgrupo dos CDIS analisou-se a manifestação imagiológica, características das microcalcificações (morfologia e distribuição), extensão (maior eixo em mm, estimado em ressonância magnética pré-cirurgia se disponível, ou alternativamente em mamografia), bem como dados do diagnóstico anátomo-patológico, com destaque para o grau nuclear (baixo, intermédio ou alto) e necrose (presente/ausente).
Nos doentes com cirurgia efetuado no IPOLFG, após a correlação do diagnóstico anátomo-patológico na BAV e na peça cirúrgica, calculámos a percentagem de upgrade de lesões B3 e lesões benignas para malignidade, assim como a percentagem de upgrade de CDIS para carcinoma microinvasivo e carcinoma invasivo (CI).
Avaliámos também a percentagem de downgrade na amostra, incluindo casos em que a lesão identificada na peça cirúrgica já não evidenciava a lesão diagnosticada na BAV.
Em relação ao CDIS, procurámos aferir variáveis com possível relação significativa com a ocorrência de upgrade, nomeadamente o maior eixo estimado na Radiologia, o grau nuclear e a necrose. A apreciação da significância estatística dos resultados foi realizada com recurso ao “teste exato de Fisher”. Um resultado foi considerado estatisticamente significativo se p < 0,05.
Algumas lesões foram exemplificadas com iconografia dos Serviços de Radiologia e Anatomia Patológica da instituição.
Resultados
2.1 Resultados globais
Todas as amostras pertenciam a mama feminina. Como características clínicas, observámos uma média de idades de 57 anos e antecedentes pessoais de carcinoma da mama em 27 casos (12,2%) (Tabela 1).
A maioria dos procedimentos foi guiado por estereotaxia (124-56,1%) e os restantes guiados por ecografia (97-43,9%). Mais de 2/3 das examinadas apresentava um padrão mamário ACR (American College of Radiology) tipo b (157-71%). A maioria das biópsias foi dirigida a microcalcificações (n=133; 60,2%) e a nódulos (73-33,0 %), tendo ainda sido realizadas 10 biópsias a distorções arquiteturais (4,5%) e 5 a assimetrias de densidade (2,3%).
Em relação às categorias BI-RADS, a maioria das lesões (155-70,1%) foi classificada com índice de suspeição moderada para malignidade (BIRADS 4B), tendo sido documentada malignidade no exame anátomo-patológico em 41 casos-31%. Das restantes, 37 (16,7%) apresentavam baixa suspeição (BIRADS 4A) e 28 (12,7%) elevada suspeição (BIRADS 4C), com taxas de malignidade de 1,4% e 82,1%, respetivamente. Apenas uma lesão (com o diagnóstico anátomo-patológico de CI) foi categorizada como BIRADS 5, correspondendo a 0,5% da amostra.
Quanto à distribuição das calcificações, a grande maioria correspondia a um agrupamento (82,7%). Morfologicamente, mais de metade (74-55,6%) eram amorfas e 35-26,3% eram finas e pleomórficas.
Nos nódulos (73-33% do total da amostra), o tamanho médio avaliado imagiologicamente foi de 12 mm, sendo que, de todos os nódulos, 23 correspondiam a papilomas, 31 a outras lesões B3, 12 a fibroadenomas e 7 a CI.
Tabela 1: Características da população (n=221) analisada (clínico-epidemiológicas e radiológicas) e características das microcalcificações (n=133) detetadas (morfologia e distribuição de acordo com o léxico BI-RADS).
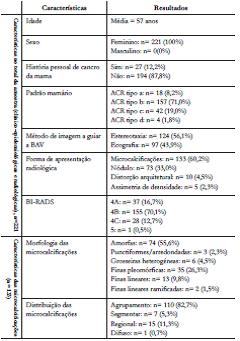
BAV: biópsia assistida por vácuo; ACR: American College of Radiology; Padrões mamários: tipo a (predominantemente adiposo), tipo b (densidades fibroglandulares dispersas), tipo c (heterogeneamente denso), tipo d (extremamente denso); BI-RADS: Breast Imaging-Reporting and Data System - BI-RADS 4: suspeito (4A:baixa suspeição para malignidade; 4B:moderada suspeição para malignidade; 4C: elevada suspeição para malignidade), BI-RADS 5: altamente suspeito de malignidade
O número de lesões malignas em diagnóstico anatomo-patológico foi de 73, incluindo 52 CDIS e 21 CI (Figuras 1 e 2). Identificaram-se 49 lesões B3, que incluíram papilomas (Figura 3), lesões esclerosantes complexas (LEC), hiperplasia ductal atípica (HDA) e carcinoma lobular in situ, sendo as restantes alterações benignas (99), que incluíram hiperplasia ductal usual, adenose esclerosante, ectasia ductal, quistos, hamartomas, fibroadenomas, hiperplasia fibroadenomatóide de lóbulos mamários e alterações do normal desenvolvimento e involução (“ANDI”)(Gráfico 1).
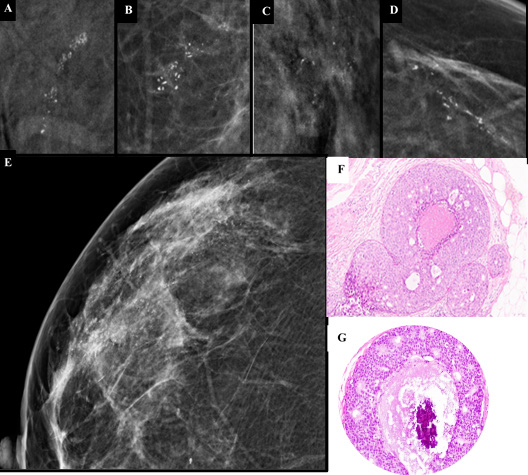
Gráfico 1: Resultados anatomopatológicos obtidos na análise das 221 biópsias assistidas por vácuo, com especificação das lesões B3 e lesões malignas detetadas. LEC: Lesão esclerosante complexa; HAD: Hiperplasia ductal atípica; CDIS: carcinoma ductalin situ; CI: carcinoma invasivo sem tipo especial

Figura 1: (A-G) - Exemplos de microcalcificações suspeitas submetidas a biópsia assistida por vácuo guiada por estereotaxia: A- microcalcificações pleomórficas com distribuição linear, B-agrupamento de microcalcificações pleomórficas, C-agrupamento de microcalficações amorfas, D-microcalcificações finas lineares, E- microcalcificações amorfas com distribuição linear. Após cirurgia, o diagnóstico anátomo-patológico final foi, em todos estes casos, compatível com carcinoma ductal in situ (exemplificado em F- coloração Hematoxilina-Eosina e em G - carcinoma ductal in situ com microcalcificações).
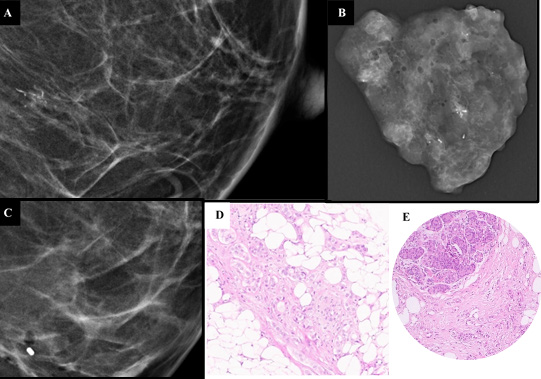
Figura 2: (A-D) - Mamografia (A - incidência crânio-caudal) mostra agrupamento de microcalcificações, algumas com morfologia fina linear, localizado na união dos quadrantes internos da mama esquerda, com maior eixo de 16 mm. Procedeu-se a biópsia assistida por vácuo guiada por estereotaxia, com realização de radiografia aos fragmentos (B) e colocação de clip (C). O diagnóstico anátomo-patológico (D, E) mostrou carcinoma invasivo sem tipo especial associado a extenso componente de carcinoma ductal in situ de alto grau com necrose e microcalcificações (Foto E mostrando os dois componentes - in situ e invasivo).
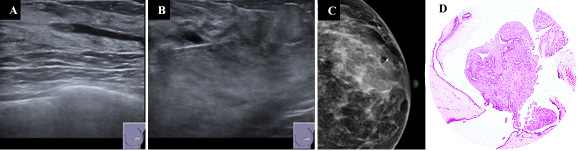
Figura 3: (A-D) - Ecografia mamária (A) mostra ducto ectasiado com nodularidade intraductal medindo 8 mm, na união dos quadrantes externos da mama direita, na região peri-areolar. Realizou-se biópia assistida por vácuo guiada por ecografia (B), com remoção da imagem da lesão e obtenção de quatro fragmentos, o maior com 15 mm. Colocou-se clip metálico de referenciação no local da biópsia, após o procedimento (C). O diagnóstico anátomo-patológico foi concordante com as características imagiológicas, revelando papiloma intraductal, sem tecido de neoplasia maligna (Foto - D).
A percentagem de carcinomas está globalmente de acordo com os intervalos expectáveis segundo a classificação BI-RADS, excetuando-se os resultados para a categoria 4A que foram ligeiramente inferiores.(Tabela 2)
Tabela 2: Comparação da percentagem de malignidade neste estudo com a probabilidade de malignidade segundo a classificação BI-RADS.
| Categoria/subcategoria BI-RADS | Malignidade na presente amostra | Probabilidade de cancro segundo ACR BI-RADS (5.ª edição) |
| 4A | 1,40 % | > 2% a ≤ 10% |
| 4B | 31 % | 10% a ≤ 50%. |
| 4C | 82,1 % | > 50% a < 95% |
| 5 | 100 % | ≥ 95% |
2.2 Correlação imagiológica e anátomo-patológica no subgrupo de CDIS
Considerados os casos em que o componente de CDIS na BAV era exclusivo (n=50), a manifestação radiológica do CDIS foi essencialmente na forma de microcalcificações (98%), maioritariamente agrupadas (82%), predominante finas e pleomórficas (43%).
Dos casos com microcalcificações finas e pleomórficas, cerca de 61% apresentavam necrose no diagnóstico anátomo-patológico e 39% correspondiam lesões de alto grau.
A morfologia classicamente associada a maior suspeição radiológica (microcalcificações finas lineares ou finas lineares ramificadas, correspondente a BIRADS 4C, n=9) associou--se a presença de necrose em 78% dos casos e a grau nuclear alto em 56% dos casos.
2.3 Concordância diagnóstica em BAV e peça cirúrgica
Do total de BAV incluídas neste estudo, 70 (31,3%) foram posteriormente submetidas a cirurgia no IPOLFG, correspondendo ao diagnóstico em BAV de lesão benigna (2-2,9%), lesão B3 (11-15,7%); CDIS (38-54,3%) e de CI (19-27,1%).
Quando o resultado na BAV foi de lesão benigna ou lesão B3, não se documentou upgrade para malignidade, traduzindo concordância de diagnóstico em todos os casos.
Nos casos diagnosticados com CDIS, foi demonstrada uma percentagem de upgrade de CDIS em 8 casos (21,1%): 4 casos para carcinoma microinvasivo - pTmi e 4 para carcinoma invasivo - 1 caso pT1a, 2 casos pT1b, 1 caso pT1c e pN1a (dimensão da metástase 3 mm). Em quatro CDIS (50%) a dimensão no diagnóstico anátomo-patológico foi ≥ 20 mm e 2 casos foram multifocais (Tabela 3).
Em todos estes casos o grau nuclear do CDIS foi intermédio ou alto. O grau nuclear (baixo versus intermédio/alto) e necrose (presente versus ausente) não mostraram associação significativa com a ocorrência de upgrade histológico (p=1,000).
O valor da mediana da dimensão do CDIS (maior eixo estimado imagiologicamente) foi de 16,5 mm no grupo que sofreu upgrade e de 16 mm no grupo sem upgrade histológico.
Considerando duas categorias (extensão do CDIS<20 mm versus extensão do CDIS≥20 mm) não se regista associação estaticamente significativa à ocorrência de upgrade (p=0.4485).
Dois CDIS não tinham lesão residual na peça operatória.
Observámos downgrade em 3-4,3%, por coexistência de CI e CDIS na amostra de BAV sem evidência de invasão na peça operatória.
Tabela 3: Upgrade nos CDIS
| Caso | BAV nº fragmentos | BAV nº fragmentos com tumor | Cirurgia dimensão in situ | Cirurgia dimensão invasivo | Cirurgia pT | Cirurgia pN |
| 1 | 13 | 50mm | 7mm | pT1b | pN0 | |
| 2 | 4 | 4 | 2 focos, o maior 20mm | 3 focos, o maior 3mm | pT1a | pN0 |
| 3 | 15 | 6 | 15mm | < 1mm | pTmi | x |
| 4 | 24 | 6 | 2 focos, o maior 3mm | < 1mm | pTmi | pN0 |
| 5 | 20 | 6 | 50mm | 12mm | pT1c | pN1a (3mm) |
| 6 | 9 | 3 | 1mm | <1mm | pTmi | pN0 |
| 7 | 17 | 7 | 2mm | 1mm | pTmi | pN0 |
| 8 | 9 | 9 | 50mm | 4 focos, o maior 7mm | pT1b | pN0 |
Discussão
A BAV tem um valor fundamental na abordagem diagnóstica e/ou terapêutica de lesões mamárias. O potencial terapêutico da BAV reduziu a necessidade de intervenção cirúrgica num grande número de casos, sendo o procedimento recomendado na avaliação de determinadas lesões B3 diagnosticadas em microbiópsia. Neste contexto, é importante referir que a excisão de papilomas foi completa na quase totalidade dos casos.
A percentagem de carcinomas está globalmente de acordo com os intervalos expectáveis segundo a classificação BI-RADS, excetuando-se os resultados para a categoria 4A que foram ligeiramente inferiores mas que se admitem em provável relação com a reduzida fração da amostra enquadrada neste categoria.
Tal como descrito na literatura6,15, a manifestação radiológica do CDIS foi essencialmente na forma de microcalcificações suspeitas, maioritariamente observadas como agrupamentos de microcalcificações finas e pleomórficas.
A concordância histológica entre o diagnóstico anátomo-patológico da BAV e da peça cirúrgica foi total nas lesões benigna e lesões B3, ilustrando o potencial terapêutico da BAV em contexto adequado.
O potencial terapêutico da BAV pode mesmo ser dirigido a lesões malignas de dimensão reduzida, com ficou comprovado pela ausência de CDIS residual em 2 dos casos.
A percentagem de upgrade de CDIS para CI na peça cirúrgica teve uma percentagem no intervalo de valores descritos na literatura.3,5,7,8,9,10,11,12,13,14,15Com efeito, em estudos que analisaram BAV guiadas por estereotaxia a percentagem de subestimação de CI reportada varia entre 10 e 29%.3,8,9,10,11,12Nas BAV sob controlo ecográfico, há maior variabilidade na percentagem de subestimação, tendo sido registados valores entre 16 e 41%.5,13,14
A análise de variáveis radiológicas (extensão do CDIS) e histológicas (grau histológico e necrose) em eventual relação com upgrade para CI não revelou resultados significativos, provavelmente em relação com o número limitado de CDIS na amostra. Em alguns estudos anteriores, fatores como a presença de necrose,7,15,18o grau nuclear7,16,17e a dimensão máxima da lesão7,16,18revelaram-se preditores de upgrade histológico. Contudo, existem outros estudos em que também não se documentaram associações estatisticamente significativas para algumas destas variáveis.15,16,18,19
A heterogeneidade de resultados nos vários estudos pode dever-se aos diferentes métodos utilizados e ao número de casos avaliados.7,17
Existem alguns modelos preditores de risco de subestimação, mas que ainda carecem de validação mais alargada.7,15,17A identificação dos casos em que há elevado risco de upgrade pode modelar o plano terapêutico, inclusivamente a avaliação do gânglio sentinela no mesmo tempo operatório. 5,12,15,17O campo da radiómica também já está a ser explorado e poderá ajudar a guiar o desenvolvimento e validação de modelos de risco no futuro.20,21
De salientar, no entanto, que dos casos de upgrade, metade correspondeu a carcinomas microinvasivos e apenas em 1 caso se detetou presença de metástase axilar, de dimensão reduzida e sem características que determinassem disseção axilar.
A ocorrência de situações de downgrade, representada pela coexistência de CI e CDIS na amostra de BAV sem evidência de focos de invasão tumoral na análise histológica da peça operatória pode ser explicada pela exiguidade do componente invasivo na totalidade da lesão. Nos casos de terapêutica neoadjuvante também pode ocorrer remissão completa do CI e persistência exclusiva do componente in situ.
Este estudo tem várias limitações, considerando-se a mais marcante a dimensão da amostra, sobretudo o reduzido número de casos em que foi possível confrontar o resultado da BAV com a histologia da peça cirúrgica. Outras das limitações é o seu caráter retrospetivo e a ausência de avaliação de período de follow-up, particularmente nos casos de lesões B3.
Conclusão
A BAV tem um papel fundamental na abordagem diagnóstica e terapêutica das lesões mamárias e determinou mudanças de paradigma, nomeadamente na avaliação de lesões benignas e lesões B3.
O correto diagnóstico radiológico permitiu identificar e orientar as lesões mais adequadas para avaliação por BAV e assim diminuir significativamente o número de cirurgias, com consequentes benefícios quer para as pacientes submetidas a um procedimento menos invasivo, quer para a programação das cirurgias necessárias, além dos benefícios económicos.1,3
Nos CDIS excisados por cirurgia no IPOLFG, verificámos upgrade em menos de 1/4 dos casos, em metade destes para carcinoma microinvasivo. Identificámos metástase axilar em gânglio sentinela apenas em um dos casos, de reduzida dimensão e sem determinar disseção axilar.















