Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Medicina Geral e Familiar
versão impressa ISSN 2182-5173
Rev Port Med Geral Fam vol.36 no.1 Lisboa fev. 2020
https://doi.org/10.32385/rpmgf.v36i1.12569
REVISÕES
Terá a melatonina uma ação fotoprotetora cutânea? Uma revisão baseada na evidência
Does melatonin have a skin photoprotective action? an evidence-based review
Carolina Boavida Ferreira,1
 https://orcid.org/0000-0002-6392-7466
https://orcid.org/0000-0002-6392-7466
João Boavida Ferreira2
1 Médica de Família. ACeS Lisboa Ocidental e Oeiras.
2 Médico Interno de Oncologia Médica. Instituto Português de Oncologia de Lisboa Francisco Gentil.
Endereço para correspondência | Dirección para correspondencia | Correspondence
RESUMO
Objetivos: Rever a evidência existente acerca do uso da melatonina como agente fotoprotetor cutâneo.
Métodos: Pesquisa nas bases de dados National Guideline Clearinghouse, NICE Guidelines Finder, The Cochrane Library e MEDLINE/PubMed, de normas de orientação clínica (NOC), revisões sistemáticas (RS), meta-análises (MA) e ensaios controlados aleatorizados (ECA), publicados entre janeiro de 1998 e janeiro de 2018, usando os termos MeSH skin erythema, skin aging, melatonin e stress. A pesquisa foi limitada a artigos escritos em inglês e português.
Resultados: Foram incluídos sete ECA de uma pesquisa inicial de 93 artigos. Não foram encontradas RS, MA ou NOC sobre o tema. Os artigos selecionados demonstraram eficácia do uso da melatonina na redução de eritema cutâneo pós-exposição e com efeito fotoprotetor, se usados antes da exposição solar ou radiação ultravioleta; se usados posteriormente, o seu efeito foi nulo.
Conclusões: A terapia com melatonina tem, a curto prazo, efeito fotoprotetor. Os estudos incluídos nesta revisão tinham amostras de pequenas dimensões e um curto período de follow-up. São necessários estudos com amostras de maiores dimensões e com maior período de follow-up para testar a eficácia e a segurança da melatonina como terapêutica a longo prazo.
Palavras-chave: Melatonina; Eritema cutâneo; Fotoproteção.
ABSTRACT
Objectives: To review whether there is evidence in favour of using melatonin as a skin photoprotective agent.
Methods: Search in the databases National Guideline Clearinghouse, NICE Guidelines Finder, The Cochrane Library and MEDLINE/PubMed, of Portuguese Health Ministry’s Direção-Geral da Saúde clinical guidelines (NOC), systematic reviews (RS), meta-analyses (MA) and randomized controlled trials (ECA), published between January 1998 and January 2018, using the MeSH terms ‘skin erythema’, ‘skin aging’, ‘melatonin’ and ‘stress’. The search was limited to articles written in English and Portuguese.
Results: Seven ECA from an initial survey of 93 articles were included. No RS, MA or NOC were found on the subject. The selected articles demonstrated the efficacy of the use of melatonin in the reduction of post-exposure cutaneous erythema, and with a photoprotective effect, if used before sun exposure or ultraviolet radiation; if used later, its effect was null.
Conclusions: Melatonin therapy has, in the short term, a photoprotective effect. Studies with larger samples and with a longer follow-up period are necessary to test for the effectiveness and safety of melatonin in the long-term.
Keywords: Melatonin; Skin erythema; Photoprotection.
Introdução
A melatonina é uma hormona produzida principalmente na glândula pineal (sendo produzida em menor quantidade na pele, trato gastrointestinal, retina, plaquetas, medula óssea, entre outros locais).1-5 A melatonina, ou N-acetil-5-metoxitriptamina, é um metoxiindol sintetizado a partir da serotonina, que deriva do triptofano.6 Embora o triptofano pareça ser a principal fonte de produção de melatonina,7 outros fatores nutricionais, como o folato8 ou a vitamina B6 (em crianças),9-10 podem ter relevância. Além disso, a produção de melatonina parece diminuir progressivamente com a idade e ser nula em idades mais avançadas.11 O sexo e a raça podem ter influência na produção desta hormona pela pele, estando relatada uma maior produção nos afro-americanos.12
A melatonina é responsável por inúmeras funções biológicas, destacando-se a regulação do ritmo circadiano e do ciclo do sono;13-15 possui também propriedades imunomoduladoras e antioxidantes,13,15 modula o eixo hipotálamo-hipófise-suprarrenal e é um antagonista das ações periféricas dos corticosteroides.13,16 Além da ação central na regulação do ritmo circadiano, a melatonina tem sido, nos últimos anos, amplamente estudada pelas suas propriedades antioxidantes. A sua importante ação como antioxidante pode provir desde os primórdios da vida, quando a exposição à radiação ultravioleta (UV) e os altos níveis de oxigénio foram grandes desafios para a sobrevivência.12 Considerando a produção de melatonina pelas mitocôndrias,17-19 pensa-se que um dos principais papéis desta hormona na evolução foi a de eliminação dos radicais livres de oxigénio.20 Assim, é intrigante que, em humanos, a melatonina pineal atue principalmente durante a noite, quando a exposição à radiação UV é mínima. Curiosamente, nos animais noturnos, esta hormona apresenta ações distintas.6
A melatonina é considerada um antioxidante mais potente do que a vitamina E, sendo esta última um antioxidante de referência.21 A melatonina atua nos radicais de oxigénio tóxicos, incluindo o radical hidroxilo; aumenta também as enzimas antioxidantes (superóxido dismutase, glutationa peroxidase, glutationa redutase) e inibe a NO sintase pró-oxidativa.6 Um estudo com recém-nascidos sépticos revelou que a administração de uma dose elevada de melatonina (20mg) levou a uma redução nos níveis de produtos de peroxidação lipídica (POL) sérica e marcadores inflamatórios, bem como a melhores desfechos clínicos.22 A melatonina, juntamente com o seu precursor N-acetilserotonina, também se liga à quinona redutase,23-24 que é conhecida por proteger as células do stress oxidativo.25-26
O efeito da melatonina na pele pode derivar da ação cutânea (direta) ou da ação sistémica. Contudo, as suas ações diretas na pele podem ser mais dependentes da melatonina produzida na pele do que da melatonina sérica.27-28 De facto, a pele enquanto órgão possui toda a maquinaria enzimática e molecular necessária para a produção, processamento e atuação em recetores da melatonina da pele, formando o seu próprio sistema melatoninérgico cutâneo, independente do sistema melatoninérgico pineal.28 Sabe-se, por exemplo, que a radiação UV estimula a produção celular cutânea de melatonina e de dois tipos de metabolitos da melatonina com ainda maior potencial antioxidante, a N1-acetil-N2-formil-5-metoxicinuramina (AFMK) e derivados hidroxilo.29-32 Os efeitos protetores gerados neste caso são recetor-independentes e necessitam de uma fonte in situ de melatonina. Ora, mesmo tendo em conta que a maior parte da melatonina em circulação tem origem na glândula pineal,28 mas que o uptake celular de melatonina é muito limitado (apenas 0,1% da melatonina externa entra nas células),29 é necessária uma produção intracelular suficiente para suprir as necessidades das células, o que aponta para uma importante função intrácrina do sistema melatoninérgico cutâneo.28 Alguns estudos mostraram que a melatonina e os seus precursores e metabolitos podem proteger/reverter os danos causados à pele pela radiação UV.29-46 É de notar, no entanto, que se verificou em ratos pinealectomizados uma redução da espessura da pele, com atrofia da epiderme, derme e folículos pilosos.47 Ainda na pele, a melatonina diminui a permeabilidade vascular cutânea48 e estimula a angiogénese e a cicatrização.49 Assim, parece haver funções distintas, na pele, para os sistemas melatoninérgicos cutâneo e pineal. Dois fatores parecem estar envolvidos nas propriedades antioxidantes e radioprotetoras da melatonina na pele: o fator relacionado ao eritrócito-2 nuclear (Nrf2)40,42 e a sirtuina-1;50-51 estes são importantes na regulação do envelhecimento da pele e do stress oxidativo dos folículos pilosos e cutâneos.52-53 Um estudo de 200828 propôs um eixo melatonina-mitocôndria que orienta o destino das células epidérmicas: entrar em diferenciação terminal e incorporar a barreira epidérmica ou morrer por apoptose, prevenindo a malignização. Esse eixo seria uma função do sistema melatoninérgico cutâneo, pelo qual a mitocêndria poderia ser capaz de ajustar a disponibilidade de espécies reativas de oxigénio durante o processo de regeneração da pele e cicatrização de feridas.54-55 De facto, um outro estudo propõe a melatonina como arma dum sistema bioquímico antigo de proteção da célula em relação a noxas exteriores e interiores, tendo em conta a origem filogenética da melatonina há 2,5 mil milhões de anos e a sua função primordial de defesa da pele, conservada ao longo da evolução.55
In vitro verificou-se um efeito fotoprotetor em culturas de células e de órgãos contra radiação UVB pela melatonina e por metabolitos e compostos da via da melatonina; verificou-se que conseguiram reverter o dano UVB-induzido em queratinócitos e melanócitos e que a proteção da melatonina se estende aos fibroblastos da derme.29-46 Esta evidência tem levado à proposta da melatonina como um agente antienvelhecimento e fotoprotetor da pele.12,56
In vivo parece haver um crescimento recente do interesse na melatonina como medicamento tópico. De facto, vários métodos de aplicação tópica têm sido apresentados, incluindo lipossomas, etossomas, niossomas ou nanoplataformas, entre outros.57 Um estudo experimentou um protetor solar contendo melatonina e óleo de sementes de abóbora em ratos submetidos a irradiação UV durante 28 dias. O protetor solar contendo melatonina e óleo de sementes de abóbora melhorou as lesões induzidas pela radiação UV, permitindo reduzir o pregueamento, espessamento e edema cutâneos, inibindo a diminuição da hidroxiprolina na pele e a lipoperoxidação e ainda inibindo a libertação de citocinas pró-inflamatórias e a sobre-expressão dos genes do NF-kB e da COX-2; no cômputo geral, houve uma inibição da fotodermatite induzida por radiação UV.58 Recentemente, um conglomerado de cinco ensaios clínicos avaliou o efeito antienvelhecimento cutâneo de um creme contendo melatonina, bakuquiol e ascorbiltetraisopalmitato em 103 participantes, reportando uma melhoria estatisticamente significativa (p<0,01) no número de rugas (11%), no aumento da firmeza da pele (8%) e na redução do eritema (70%).59
A melatonina também demonstrou ter uma potente atividade anticancerígena, direta e indiretamente.60-63 Alguns autores propuseram a poluição luminosa com a consequente desregulação do ritmo circadiano da circulação sanguínea da melatonina como um fator de risco para cancro, nomeadamente com a diminuição da produção de melatonina (por prolongamento do tempo de exposição à luz), provocando uma diminuição do efeito oncostático da melatonina.64 Em ratos com tumores precoces induzidos verificou-se que, no grupo pinealectomizado, o crescimento tumoral e o índice mitótico eram maiores.65 Em ratos pinealectomizados e com sarcomas de Yoshida, a administração de melatonina preveniu o crescimento tumoral e ainda aumentou a sobrevida global.65 O efeito do fotoperíodo na tumorigénese mamária, em particular, também é conhecido. A exposição constante à luz em animais mostrou um aumento da incidência de cancro da mama e uma diminuição do tempo de desenvolvimento de tumores mamários.66-67 Em doentes com cancro da mama verificou-se que a amplitude circadiana da melatonina (em comparação com doentes com doença mamária não maligna) estava reduzida em 50%68 e que os níveis urinários matinais de melatonina estão elevados em doentes com cancro da mama.69 Um dos tipos de cancro mais associados ao trabalho noturno por turnos tem sido o cancro da mama, embora outros também estejam associados.70
Testes em melanoma e outros cancros cutâneos também demonstraram o potencial oncostático da melatonina. A melatonina e os seus metabolitos inibem o crescimento de melanomas humanos em cultura.71-76 Também já houve benefício demonstrado da melatonina quando adicionada a quimioterapia ou quimioimunoterapia em doentes com melanoma metastático, em termos de eficácia ou de redução de efeitos adversos,77-78 embora a quimioterapia não seja atualmente primeira linha no tratamento do melanoma metastático. Em outros cancros cutâneos, benzoapireno-induzidos, nomeadamente sarcomas cutâneos,79 carcinomas pavimentocelulares80 e papilomas,81 em ratos, a melatonina parece ter um efeito atenuante no desenvolvimento tumoral.
A luz solar, e mais concretamente a radiação UV, é a causa de múltiplas doenças de pele, muitas delas evitáveis.82-83 Espécies reativas de oxigénio formadas após a exposição à radiação UV desempenham um papel fundamental nesse processo.82-83 Com a exposição aguda pode ocorrer edema, dor e eritema, mas é com a exposição crónica que aumenta substancialmente o risco de fotoenvelhecimento e de neoplasia cutânea. A incidência neoplásica, especialmente o cancro cutâneo não-melanoma, está a aumentar mundialmente.83-84 A prevenção pode ser conseguida através de fotoproteção eficaz da pele.83 Apesar de existirem inúmeros produtos disponíveis no mercado, a incidência crescente destas patologias mostra a necessidade de desenvolvimento de novos produtos, capazes de as prevenir.83 Paralelamente, existem à venda inúmeros produtos cosméticos com ação fotoprotetora, muitos dos quais sem evidência científica comprovadora de eficácia.
Apesar do interesse crescente e do aumento do número de ensaios clínicos sobre a aplicação tópica da melatonina na pele, não se conhece nenhuma revisão sobre os diferentes estudos. Entretanto, a melatonina tem sido já utilizada tanto em contexto de farmácia como de parafarmácia. Em Portugal, a Autoridade Nacional do Medicamento e Produtos de Saúde autoriza a indicação da melatonina em comprimidos para a insónia. Nos Estados Unidos da América, a Food and Drug Administration não autoriza nenhuma indicação, reconhecendo a melatonina como um suplemento alimentar.
A escala de classificação de Fitzpatrick, usada por dermatologistas, permite determinar o risco de desenvolver queimaduras solares. A classificação é baseada na aparência da pele e no grau de tolerância à exposição solar e está relacionada com a quantidade de pigmento de melanina na pele. Segundo este sistema existem seis variedades de pele, classificadas de I a VI, sendo os fotótipos mais claros (I a III) os de maior risco.82,85
O objetivo deste estudo consiste em rever a evidência existente acerca do uso da melatonina como agente fotoprotetor cutâneo.
Métodos
Foi realizada uma pesquisa nas bases de dados National Guideline Clearinghouse, NICE Guidelines Finder, The Cochrane Library e MEDLINE/PubMed, de normas de orientação clínica (NOC), revisões sistemáticas (RS), meta-análises (MA) e ensaios controlados aleatorizados (ECA), publicados entre janeiro de 1998 e janeiro de 2018 (20 anos), usando os termos MeSH skin erythema, skin aging, melatonin e stress.
Os critérios de inclusão dos artigos nesta revisão foram definidos segundo o modelo PICO:
População: humanos adultos
• Intervenção: melatonina oral ou tópica
• Comparação: grupo de controlo sem terapêutica com melatonina
• Outcomes: efeitos fotoprotetores cutâneos
Foram excluídos: estudos realizados em animais, estudos realizados em humanos não-adultos e estudos cujo objetivo do tratamento com melatonina não fosse prevenir o eritema ou tratar sinais de fotoenvelhecimento cutâneo. Foram excluídos ainda artigos de opinião, artigos de revisão clássica do tema, resumos de sítios na Internet e artigos discordantes do objetivo da revisão.
A seleção dos artigos para revisão foi feita em duplicado pelos autores e, em caso de discordância, foi discutida pelo par a inclusão/exclusão, com uma taxa de concordância final de 100%. Realizou-se a leitura integral dos artigos selecionados e a avaliação de qualidade e atribuição de nível de evidência dos estudos foi discutida pelos autores.
A escala SORT (Strength of Recommendation Taxonomy), da Academia Americana de Médicos de Família, foi utilizada para avaliação da qualidade e atribuição do nível de evidência de cada estudo.
Resultados
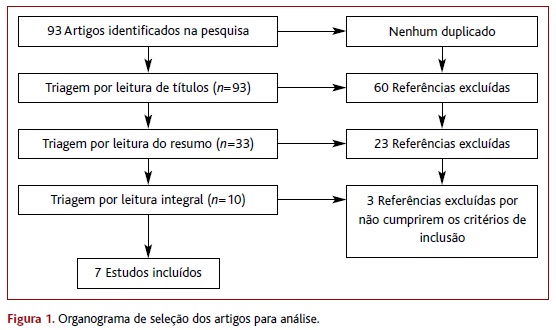
Foram encontrados 93 artigos, dos quais 60 foram excluídos com base no título, 23 no resumo e três após a leitura minuciosa, restando sete ECA (Figura 1).15,82-83,86-89 Não foram encontradas RS, MA ou NOC sobre o tema.
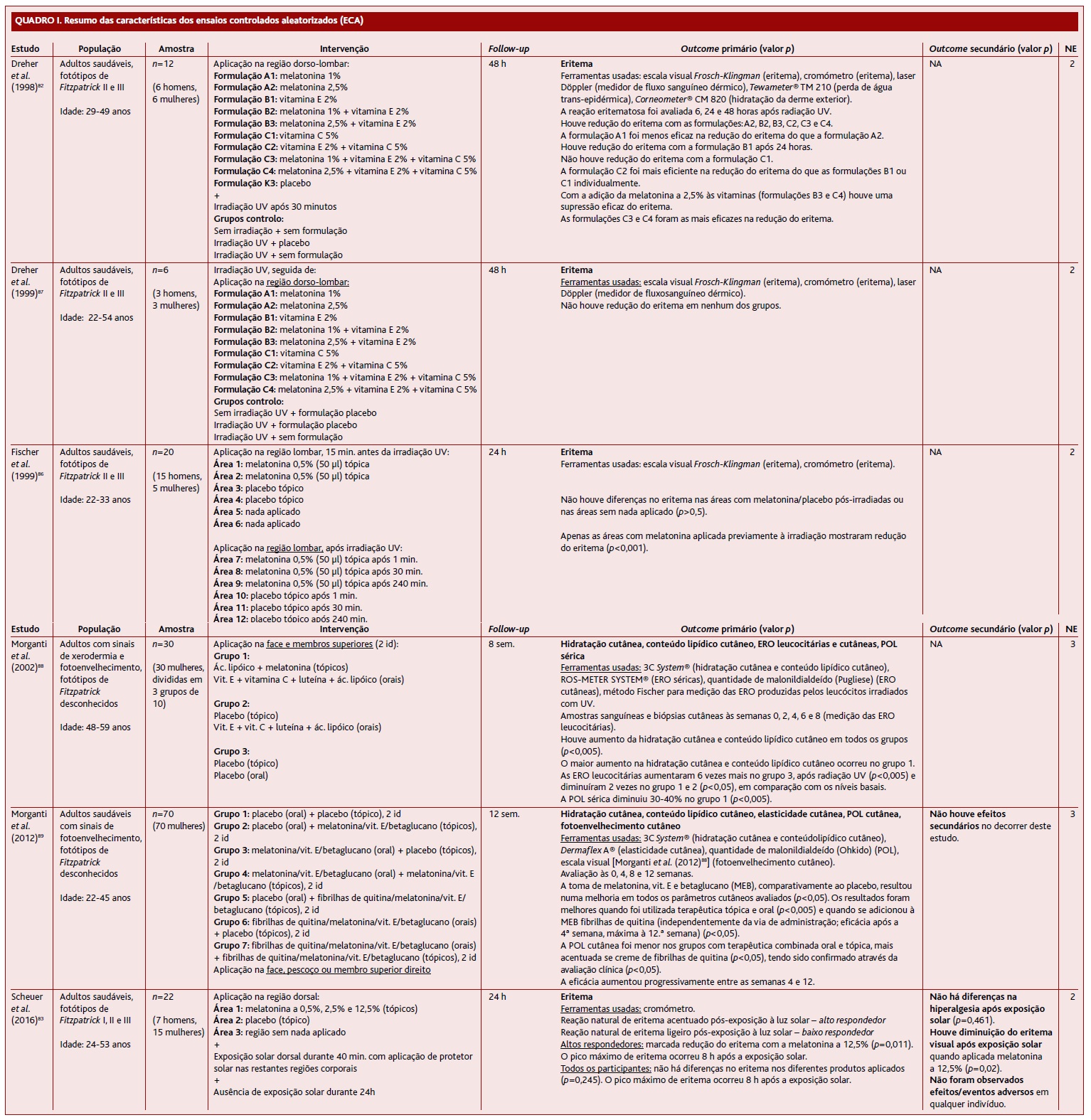
Dreher e colaboradores (1998)82 realizaram um estudo com 12 adultos saudáveis, fotótipos II e III de Fitzpatrick, com idades entre os 29 e 49 anos, seis homens e seis mulheres. A duração do estudo foi de 48 horas. A região dorso-lombar foi dividida em 10 áreas, cada uma com um creme tópico diferente aplicado: (A1) melatonina a 1%; (A2) melatonina a 2,5%; (B1) vitamina E a 2%; (B2) melatonina a 1% + vitamina E a 2%; (B3) melatonina a 2,5% + vitamina E a 2%; (C1) vitamina C a 5%; (C2) vitamina E a 2% + vitamina C a 5%; (C3) melatonina a 1% + vitamina E a 2% + vitamina C a 5%; (C4) melatonina a 2,5% + vitamina E a 2% + vitamina C a 5%; (K3) placebo. Estas áreas de pele foram então sujeitas a irradiação UV. Foram criados três grupos de controlo: sem creme + irradiação UV; creme placebo + irradiação UV; sem creme + sem irradiação UV. Os outcomes primários foram: redução do eritema com os grupos A2, B2, B3, C2, C3 e C4; a melatonina a 2,5% foi mais eficiente que a melatonina a 1% na prevenção do eritema; os cremes mais eficazes na redução do eritema foram os C3 e C4 (Quadro I).
(clique para ampliar ! click to enlarge)
Dreher e colaboradores (1999)87 realizaram um estudo com seis adultos saudáveis, fotótipos II e III de Fitzpatrick, com idades entre os 22 e 54 anos, sendo três homens e três mulheres. Os participantes foram submetidos a irradiação UV, seguida de aplicação tópica na região lombar (dividida em 12 áreas) de: melatonina a 1%; melatonina a 2,5%; vitamina E; melatonina a 1% + vitamina E; melatonina a 2,5% + vitamina E; vitamina C; vitamina E + vitamina C; melatonina a 1% + vitamina E + vitamina C; melatonina a 2,5% + vitamina E + vitamina C; área sem nada aplicado; creme placebo; creme placebo sem irradiação UV prévia. A duração do estudo foi de 48 horas. Não houve redução do eritema em nenhum dos campos (Quadro I).
Fischer e colaboradores (1999)86 realizaram um estudo com 20 adultos saudáveis, fotótipos II e III de Fitzpatrick, com idades entre os 22 e 33 anos, sendo 15 homens e cinco mulheres. A duração do estudo foi de 24 horas. A região lombar foi dividida em 12 áreas (seis à esquerda e seis à direita), sendo as primeiras seis áreas, à esquerda, com uma aplicação diferente em cada par: melatonina tópica a 0,5% (50 µl); creme placebo; nada aplicado. Os participantes foram posteriormente expostos à radiação UV. Nas áreas lombares à direita, após a irradiação UV, foi aplicada melatonina tópica versus placebo da seguinte maneira: a 0,5% (50 µl) após um minuto; melatonina tópica a 0,5% (50 µl) após 30 minutos; melatonina tópica a 0,5% (50 µl) após 240 minutos. Os outcomes primários foram: à direita, nenhuma diferença no eritema após irradiação UV entre as áreas com melatonina, placebo e nada aplicado; apenas as áreas com aplicação de melatonina pré-UV mostraram redução do eritema (p<0,001) (Quadro I).
Morganti e colaboradores (2002)88 realizaram um estudo com 30 mulheres com sinais de xerodermia e fotoenvelhecimento cutâneo, com idades entre os 48 e 59 anos (os fotótipos de Fitzpatrick são desconhecidos). Os participantes foram divididos em três grupos: 1) ácido lipóico + melatonina (tópicos) e vitamina E + vitamina C + luteína + ácido lipóico (orais); 2) placebo (tópico) e vitamina E + vitamina C + luteína + ácido lipóico (orais); 3) placebo (tópico) e placebo (oral). A duração do estudo foi de oito semanas. O gel foi aplicado na face e nos membros superiores. Foram colhidas amostras de sangue e biópsia da pele às 0, 2, 4, 6 e 8 semanas e medidas as espécies reativas de oxigénio. Os resultados mostraram um aumento na hidratação da pele e no conteúdo lipídico cutâneo em todos os grupos (p<0,005), sendo mais evidente no grupo que recebeu melatonina. Por outro lado, a produção de espécies reativas de oxigénio foi seis vezes superior nos leucócitos irradiados com radiação UV do grupo placebo (p<0,005) e duas vezes menor nos outros dois grupos (p<0,05) em comparação com os níveis basais. Além disso, a POL sérica diminuiu 30-40% no grupo que recebeu melatonina (p<0,005) (Quadro I).
Morganti e colaboradores (2012)89 realizaram um estudo com 70 mulheres saudáveis com sinais de fotoenvelhecimento cutâneo, com idade entre os 22 e 45 anos (não são conhecidos os fotótipos de Fitzpatrick). O estudo durou 12 semanas. Os participantes foram divididos em sete grupos: placebo (oral) e placebo (tópico); placebo (oral) e melatonina/vitamina E/β-glucano (tópicos); melatonina/vitamina E/β-glucano (orais) e placebo (tópico), melatonina/vitamina E/β-glucano (orais) e melatonina/vitamina E/β-glucano (tópicos); placebo (oral) e nanofibrilhas de quitina/melatonina/vitamina E/β-glucano (tópicos); nanofibrilhas de quitina/melatonina/vitamina E/β-glucano (orais) e placebo (tópicos); nanofibrilhas de quitina/melatonina/vitamina E/β-glucano (orais) e nanofibrilhas de quitina/melatonina/vitamina E/β-glucano (tópicos). O creme foi aplicado na face, pescoço ou membro superior direito, duas vezes/dia, 12 semanas. A avaliação do eritema foi feita nas semanas 0, 4, 8 e 12. Tomar melatonina + vitamina E + β-glucano resultou numa melhoria em todos os parâmetros cutâneos avaliados (p<0,05). Os melhores resultados foram obtidos com terapia tópica e oral simultânea (p<0,005) e com a adição de nanofibrilhas de quitina (p<0,05). Por outro lado, a POL cutânea foi menor nos grupos de terapia combinada oral + tópica, mas maior quando as nanofibrilhas de quitina foram adicionadas (p<0,05) (Quadro I).
Scheuer e colaboradores (2016)83 realizaram um estudo com 22 adultos saudáveis, Fitzpatrick fotótipos I, II e III, com idades entre os 24 e 53 anos, sendo sete homens e 15 mulheres. O estudo durou 24 horas. A região dorsal foi dividida em cinco áreas, cada uma com um creme tópico diferente aplicado: melatonina a 0,5%; melatonina a 2,5%; melatonina a 12,5%; placebo; nada aplicado. Os indivíduos foram posteriormente expostos à luz solar durante 40 minutos (o resto do corpo foi previamente protegido do sol) e mantidos afastados da exposição solar durante 24 horas. Os participantes foram divididos em dois grupos, de acordo com a reação natural à exposição à luz solar: eritema acentuado - resposta alta; eritema ligeiro - resposta baixa. Os altos respondedores mostraram uma redução acentuada do eritema com melatonina a 12,5% (p=0,011). A reação máxima do eritema nos altos respondedores ocorreu às oito horas após a exposição ao sol. No total da amostra não foi observada nenhuma mudança na reação do eritema entre os diferentes cremes tópicos (p=0,245) e a reação máxima do eritema também ocorreu às oito horas pós-exposição ao sol (Quadro I).
Sagan e colaboradores (2017)15 realizaram um estudo com 90 mulheres na pós-menopausa, com idade entre os 46 e 67 anos, sendo 44 não fumadoras e 46 ex-fumadoras (os fotótipos de Fitzpatrick são desconhecidos). Os dois grupos (não fumadoras e ex-fumadoras) foram subdivididos em quatro subgrupos: 1) sem tratamento; 2) melatonina (tópica); 3) ácido ascórbico + ácido lipóico + gluconato de zinco (tópicos); 4) melatonina (oral). A POL cutânea e sérica, bem como alterações biofísicas da pele, foram avaliadas às 0, 2 e 4 semanas (duração do estudo: quatro semanas). Os outcomes primários foram: POL sérica na semana 0 foi maior em mulheres pós-menopáusicas ex-fumadoras do que mulheres pós-menopáusicas não fumadoras; não houve mudança na POL sérica no grupo não fumador; a melatonina oral reverteu o processo de POL sérica no grupo de ex-fumadoras; não houve alteração da POL cutânea em nenhum dos dois grupos; a melatonina oral e tópica levou a um aumento do conteúdo lipídico cutâneo nas ex-fumadoras (p<0,05); a melatonina oral levou a um aumento na hidratação da pele no grupo ex-fumador (p<0,05); o tópico com ácido ascórbico + ácido lipóico + gluconato de zinco levou a um aumento na elasticidade da pele no grupo não fumador (p<0,05) (Quadro I).
Conclusões
Os ensaios clínicos selecionados mostram eficácia, a curto prazo, no uso da melatonina como agente fotoprotetor cutâneo, se usado antes da exposição solar ou radiação UV; se usado posteriormente, o seu efeito parece ser nulo. Quanto à posologia parece haver maior eficácia se a melatonina oral ou tópica for usada em maior dose, em comparação com a melatonina tópica de dose mais baixa. Os parâmetros cutâneos avaliados variaram de acordo com o estudo, salientando-se a humidade e conteúdo lipídico cutâneos, a elasticidade, o eritema, o fluxo sanguíneo e POL sérica e cutânea. Em nenhum dos estudos selecionados houve efeitos adversos graves. Todos os estudos apresentaram um curto período de follow-up e amostras de pequenas dimensões. Assim, não foi possível avaliar a eficácia, os benefícios ou os efeitos adversos a longo prazo. Em relação ao grau de recomendação, dado que os estudos variaram entre orientados para a doença e orientados para o doente, os níveis de evidência atribuídos (escala SORT) variaram entre 2 e 3 (Quadro I). Dada a grande heterogeneidade dos estudos não foi dada uma força de recomendação para o uso da melatonina como agente fotoprotetor. Os estudos de Sagan (2017),15 Morganti (2002)88 e Morganti,89 e seus colaboradores, parecem apontar para um benefício da melatonina contra o fotoenvelhecimento, nomeadamente em parâmetros de recuperação e de reparação da pele, embora também apresentem heterogeneidade, curto tempo de follow-up e a adição de outras substâncias à mistura da melatonina, o que pode confundir a análise. Assim, o potencial fotorreparador cutâneo da melatonina é promissor, mas são necessários mais estudos para se perceber objetivamente o efeito da melatonina na pele com lesões crónicas induzidas pela radiação solar. São igualmente necessários mais estudos, com maiores amostras e com maior período de follow-up para se avaliar a eficácia e segurança da melatonina a longo prazo como agente terapêutico fotoprotetor cutâneo.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Liu C, Fukuhara C, Wessel 3rd JH, Iuvone PM, Tosini G. Localization of Aa-nat mRNA in the rat retina by fluorescence in situ hybridization and laser capture microdissection. Cell Tissue Res. 2004;315(2):197-201. [ Links ]
2. Bubenik GA. Gastrointestinal melatonin: localization, function, and clinical relevance. Dig Dis Sci. 2002;47(10):2336-48. [ Links ]
3. Slominski A, Pisarchik A, Semak I, Sweatman T, Wortsman J, Sczesniewski A, et al. Serotoninergic and melatoninergic systems are fully expressed in human skin. FASEB J. 2002;16(8):896-8. [ Links ]
4. Champier J, Claustrat B, Besançon R, Eymin C, Killer C, Jouvet A, et al. Evidence for tryptophan hydroxylase and hydroxy-indol-O-methyl-transferase mRNAs in human blood platelets. Life Sci. 1997;60(24):2191-7. [ Links ]
5. Cardinali DP, Ladizesky MG, Boggio V, Cutrera RA, Mautalen C. Melatonin effects on bone: experimental facts and clinical perspectives. J Pineal Res. 2003;34(2):81-7. [ Links ]
6. Claustrat B, Leston J. Melatonin: physiological effects in humans. Neurochirurgie. 2015;61(2-3):77-84. [ Links ]
7. Zimmermann RC; McDougle CJ, Schumacher M, Olcese J, Mason JW, Heninger GR, et al. Effects of acute tryptophan depletion on nocturnal melatonin secretion in humans. J Clin Endocrinol Metab. 1993;76(5):1160-4. [ Links ]
8. Fournier I, Ploye F, Cottet-Emard JM, Brun J, Claustrat B. Folate deficiency alters melatonin secretion in rats. J Nutr. 2002;132(9):2781-4. [ Links ]
9. Muñoz-Hoyos A, Amorós-Rodríguez I, Molina-Carballo A, Uberos-Fernández J, Acuña-Castroviejo D. Pineal response after pyridoxine test in children. J Neural Transm. 1996;103(7):833-42. [ Links ]
10. Luboshitzky R, Ophir U, Nave R, Epstein R, Shen-Orr Z, Herer P. The effect of pyridoxine administration on melatonin secretion in normal men. Neuro Endocrinol Lett. 2002;23(3):213-7. [ Links ]
11. Iguichi H, Kato KI, Ibayashi H. Age-dependent reduction in serum melatonin concentrations in healthy human subjects. J Clin Endocrinol Metab. 1982;55(1):27-9. [ Links ]
12. Slominski AT, Hardeland R, Zmijewski MA, Slominski RM, Reiter RJ, Paus R. Melatonin: a cutaneous perspective on its production, metabolism, and functions. J Invest Dermatol. 2018;138(3):490-9. [ Links ]
13. Malhotra S, Sawhney G, Pandhi P. The therapeutic potential of melatonin: a review of the science. Medscape [Internet]; 2004. Available from: https://clinicaltrials.gov/ct2/show/NCT00963638
14. Wurtman R. Physiology and available preparations of melatonin. UpToDate [Internet]; 2019 Apr 30. Available from: https://www.uptodate.com/contents/physiology-and-available-preparations-of-melatonin [ Links ]
15. Sagan D, Stepniak J, Gesing A, Lewinski A, Karbownik-Lewinska M. Melatonin reverses the enhanced oxidative damage to membrane lipids and improves skin biophysical characteristics in former-smokers: a study in postmenopausal women. Ann Agric Environ Med. 2017;24(4):659-66. [ Links ]
16. Ekmekcioglu C. Melatonin receptors in humans: biological role and clinical relevance. Biomed Pharmacother. 2006;60(3):97-108. [ Links ]
17. Reiter RJ, Rosales-Corral S, Tan DX, Jou MJ, Galano A, Xu B. Melatonin as a mitochondria-targeted antioxidant: one of evolution’s best ideas. Cell Mol Life Sci. 2017;74(21):3863-81. [ Links ]
18. Suofu Y, Li W, Jean-Alphonse FG, Jia J, Khattar NK, Li J, et al. Dual role of mitochondria in producing melatonin and driving GPCR signaling to block cytochrome C release. Proc Natl Acad Sci U S A. 2017;114(38):e7997-e8006. [ Links ]
19. Tan DX, Manchester LC, Liu X, Rosales-Corral SA, Acuna-Castroviejo D, Reiter RJ. Mitochondria and chloroplasts as the original sites of melatonin synthesis: a hypothesis related to melatonin’s primary function and evolution in eukaryotes. J Pineal Res. 2013;54(2):127-38. [ Links ]
20. Hardeland R, Balzer I, Poeggeler B, Fuhrberg B, Uría H, Behrmann G, et al. On the primary functions of melatonin in evolution: mediation of photoperiodic signals in a unicell, photooxidation, and scavenging of free radicals. J Pineal Res. 1995;18(2):104-11. [ Links ]
21. Poeggeler B, Saarela S, Reiter RJ, Tan DX, Chen LD, Manchester LC, et al. Melatonin - A highly potent endogenous radical scavenger and electron donor: new aspects of the oxidation chemistry of this indole accessed in vitro. Ann N Y Acad Sci. 1994;738:419-20. [ Links ]
22. Gitto E, Karbownik M, Reiter RJ, Tan DX, Cuzzocrea S, Chiurazzi P, et al. Effects of melatonin treatment in septic newborns. Pediatr Res. 2001;50(6):756-60. [ Links ]
23. Jockers R, Maurice P, Boutin JA, Delagrange P. Melatonin receptors, heterodimerization, signal transduction and binding sites: what’s new? Br J Pharmacol. 2008;154(6):1182-95. [ Links ]
24. Nosjean O, Ferro M, Coge F, Beauverger P, Henlin JM, Lefoulon F, et al. Identification of the melatonin-binding site MT3 as the quinone reductase 2. J Biol Chem. 2000;275(40):31311-7. [ Links ]
25. Boutin JA. Quinone reductase 2 as a promising target of melatonin therapeutic actions. Expert Opin Ther Targets. 2016;20(3):303-17. [ Links ]
26. Hardeland R. Melatonin: signaling mechanisms of a pleiotropic agent. Biofactors. 2009;35(2):183-92. [ Links ]
27. Kim TK, Lin Z, Tidwell WJ, Li W, Slominski AT. Melatonin and its metabolites accumulate in the human epidermis in vivo and inhibit proliferation and tyrosinase activity in epidermal melanocytes in vitro. Mol Cell Endocrinol. 2015;404:1-8. [ Links ]
28. Slominski A, Tobin DJ, Zmijewski MA, Wortsman J, Paus R. Melatonin in the skin: synthesis, metabolism and functions. Trends Endocrinol Metab. 2008;19(1):17-24. [ Links ]
29. Fischer TW, Sweatman TW, Semak I, Sayre RM, Wortsman J, Slominski A. Constitutive and UV-induced metabolism of melatonin in keratinocytes and cell-free systems. FASEB J. 2006;20(9):1564-6. [ Links ]
30. Tan DX, Manchester LC, Terron MP, Flores LJ, Reiter RJ. One molecule, many derivatives: a never-ending interaction of melatonin with reactive oxygen and nitrogen species? J Pineal Res. 2007;42(1):28-42. [ Links ]
31. Tan DX, Manchester LC, Di Mascio P, Martinez GR, Prado FM, Reiter RJ. Novel rhythms of N1-acetyl-N2-formyl-5-methoxykynuramine and its precursor melatonin in water hyacinth: importance for phytoremediation. FASEB J. 2007;21(8):1724-9. [ Links ]
32. Pandi-Perumal SR, Srinivasan V, Maestroni GJ, Cardinali DP, Poeggeler B, Hardeland R. Melatonin: nature's most versatile biological signal? FEBS J. 2006;273(13):2813-38. [ Links ]
33. Fischer TW, Zbytek B, Sayre RM, Apostolov EO, Basnakian AG, Sweatman TW, et al. Melatonin increases survival of HaCaT keratinocytes by suppressing UV-induced apoptosis. J Pineal Res. 2006;40(1):18-26. [ Links ]
34. Fischer TW, Slominski A, Zmijewski MA, Reiter RJ, Paus R. Melatonin as a major skin protectant: from free radical scavenging to DNA damage repair. Exp Dermatol. 2008;17(9):713-30. [ Links ]
35. Fischer TW, Zmijewski MA, Wortsman J, Slominski A. Melatonin maintains mitochondrial membrane potential and attenuates activation of initiator (casp-9) and effector caspases (casp-3/casp-7) and PARP in UVR-exposed HaCaT keratinocytes. J Pineal Res. 2008;44(4):397-407. [ Links ]
36. Fischer TW, Kleszczynski K, Hardkop LH, Kruse N, Zillikens D. Melatonin enhances antioxidative enzyme gene expression (CAT, GPx, SOD), prevents their UVR-induced depletion, and protects against the formation of DNA damage (8-hydroxy-2’-deoxyguanosine) in ex vivo human skin. J Pineal Res. 2013;54(3):303-12. [ Links ]
37. Kleszczynski K, Hardkop LH, Fischer TW. Differential effects of melatonin as a broad range UV-damage preventive dermato-endocrine regulator. Dermatoendocrinol. 2011;3(1):27-31. [ Links ]
38. Kleszczynski K, Tukaj S, Kruse N, Zillikens D, Fischer TW. Melatonin prevents ultraviolet radiation-induced alterations in plasma membrane potential and intracellular pH in human keratinocytes. J Pineal Res. 2013;54(1):89-99. [ Links ]
39. Kleszczynski K, Zwicker S, Turaj S, Kasperkiewicz M, Zillikens D, Wolf R, et al. Melatonin compensates silencing of heat shock protein 70 and suppresses ultraviolet radiation-induced inflammation in human skin ex vivo and cultured keratinocytes. J Pineal Res. 2015;58(1):117-26. [ Links ]
40. Kleszczynski K, Zillikens D, Fischer TW. Melatonin enhances mitochondrial ATP synthesis, reduces reactive oxygen species formation, and mediates translocation of the nuclear erythroid 2-related factor 2 resulting in activation of phase-2 antioxidant enzymes (γ-GCS, HO-1, NQO1) in ultraviolet radiation-treated normal human epidermal keratinocytes (NHEK). J Pineal Res. 2016;61(2):187-97. [ Links ]
41. Janjetovic Z, Nahmias ZP, Hanna S, Jarrett SG, Kim TK, Reiter RJ, et al. Melatonin and its metabolites ameliorate ultraviolet B-induced damage in human epidermal keratinocytes. J Pineal Res. 2014;57(1):90-102. [ Links ]
42. Janjetovic Z, Jarrett SG, Lee EF, Duprey C, Reiter RJ, Slominski AT. Melatonin and its metabolites protect human melanocytes against UVB-induced damage: involvement of NRF2-mediated pathways. Sci Rep. 2017;7(1):1274. [ Links ]
43. Izykowska I, Cegielski M, GebarowskaE, Podhorska-Okolow M, Piotrowska A, Zabel M, et al. Effect of melatonin on human keratinocytes and fibroblasts subjected to UVA and UVB radiation in vitro. In Vivo. 2009;23(5):739-45. [ Links ]
44. Lee KS, Lee WS, Suh SI, Kim SP, Lee SR, Ryoo YW, et al. Melatonin reduces ultraviolet-B induced cell damages and polyamine levels in human skin fibroblasts in culture. Exp Mol Med. 2003;35(4):263-8. [ Links ]
45. Rezzani R, Rodella LF, Favero G, Damiani G, Paganelli C, Reiter RJ. Attenuation of ultraviolet A-induced alterations in NIH3T3 dermal fibroblasts by melatonin. Br J Dermatol. 2014;170(2):382-91. [ Links ]
46. Ryoo YW, Suh SI, Mun KC, Kim BC, Lee KS. The effects of the melatonin on ultraviolet-B irradiated cultured dermal fibroblasts. J Dermatol Sci. 2001;27(3):162-9. [ Links ]
47. Eşrefoğlu M, Seyhan M, Gül M, Parlakpinar H, Batçioğlu K, Uyumlu B. Potent therapeutic effect of melatonin on aging skin in pinealectomized rats. J Pineal Res. 2005;39(3):231-7.
48. Lotufo CM, Yamashita CE, Farsky SH, Markus RP. Melatonin effect on endothelial cells reduces vascular permeability increase induced by leukotriene B4. Eur J Pharmacol. 2006;534(1-3):258-63. [ Links ]
49. Soybir G, Topuzlu C, Odabaş O, Dolay K, Bilir A, Köksoy F. The effects of melatonin on angiogenesis and wound healing. Surg Today. 2003;33(12):896-901.
50. Lee JH, Moon JH, Nazim UM, Lee YJ, Seol JW, Eo SK, et al. Melatonin protects skin keratinocyte from hydrogen peroxide-mediated cell death via the SIRT1 pathway. Oncotarget. 2016;7(11):12075-88. [ Links ]
51. Ranieri D, Avitabile D, Shiota M, Yokomizo A, Naito S, Bizzarri M, et al. Nuclear redox imbalance affects circadian oscillation in HaCaT keratinocytes. Int J Biochem Cell Biol. 2015;65:113-24. [ Links ]
52. Haslam IS, Jadkauskaite L, Szabó IL, Staege S, Hesebeck-Brinckmann J, Jenkins G, et al. Oxidative damage control in a human (mini-) organ: Nrf2 activation protects against oxidative stress-induced hair growth inhibition. J Invest Dermatol. 2017;137(2):295-304. [ Links ]
53. Jadkauskaite L, Coulombe PA, Schäfer M, Dinkova-Kostova AT, Paus R, Haslam IS. Oxidative stress management in the hair follicle: could targeting NRF2 counter age-related hair disorders and beyond? Bioessays. 2017;39(8). [ Links ]
54. Vidali S, Chéret J, Giesen M, Haeger S, Alam M, Watson RE, et al. Thyroid hormones enhance mitochondrial function in human epidermis. J Invest Dermatol. 2016;136(10):2003-12. [ Links ]
55. Slominski AT, Zmijewski MA, Semak I, Kim TK, Janjentovic Z, Slominski RM, et al. Melatonin, mitochondria and the skin. Cell Mol Life Sci. 2017;74(21):3913-25. [ Links ]
56. Day D, Burgess CM, Kircik LH. Assessing the potential role for topical melatonin in an antiaging skin regimen. J Drugs Dermatol. 2018;17(9):966-9. [ Links ]
57. Milan AS, Campmany AC, Naveros BC. Antioxidant nanoplatforms for dermal delivery: melatonin. Curr Drug Metab. 2017;18(5):437-53. [ Links ]
58. Bora NS, Mazumder B, Mandal S, Bhutia YD, Das S, Karmakar S, et al. Protective effect of a topical sunscreen formulation fortified with melatonin against UV-induced photodermatitis: an immunomodulatory effect via NF-κB suppression. Immunopharmacol Immunotoxicol. 2019;41(1):130-9. [ Links ]
59. Goldberg DJ, Robinson DM, Granger C. Clinical evidence of the efficacy and safety of a new 3-in-1 anti-aging topical night serum-in-oil containing melatonin, bakuchiol, and ascorbyl tetraisopalmitate: 103 females treated from 28 to 84 days. J Cosmetic Dermatol. 2019;18(3):806-14. [ Links ]
60. Ma Z, Yang Y, Fan C, Han J, Wang D, Di S, et al. Melatonin as a potential anticarcinogen for non-small-cell lung cancer. Oncotarget. 2016;7(29):46768-84. [ Links ]
61. Reiter RJ, Rosales-Corral SA, Tan DX, Acuna-Castroviejo D, Qin L, Yang SF, et al. Melatonin, a full-service anti-cancer agent: inhibition of initiation, progression and metastasis. Int J Mol Sci. 2017;18(4). [ Links ]
62. Rondanelli M, Faliva MA, Perna S, Antoniello N. Update on the role of melatonin in the prevention of cancer tumorigenesis and in the management of cancer correlates, such as sleep-wake and mood disturbances: review and remarks. Aging Clin Exp Res. 2013;25(5):499-510. [ Links ]
63. Su SC, Hsieh MJ, Yang WE, Chung WH, Reiter RJ, Yang SF. Cancer metastasis: mechanisms of inhibition by melatonin. J Pineal Res. 2017;62(1):e12370. [ Links ]
64. Kerenyi NA, Pandula E, Feuer G. Why the incidence of cancer is increasing: the role of 'light pollution'. Med Hypotheses. 1990;33(2):75-8. [ Links ]
65. Lapin V, Frowein A. Effects of growing tumours on pineal melatonin levels in male rats. J Neural Transm. 1981;52(1-2):123-36. [ Links ]
66. Hamilton T. Influence of environmental light and melatonin upon mammary tumour induction. Br J Surg. 1969;56(10):764-6. [ Links ]
67. Kothari LS, Shah PN, Mhatre MC. Effect of continuous light on the incidence of 9,10-dimethyl-1,2-benzanthracene induced mammary tumors in female Holtzman rats. Cancer Lett. 1982;16(3):313-7. [ Links ]
68. Bartsch C, Bartsch H, Fluchter St H, Lippert TH. Depleted pineal melatonin production in primary breast and prostate cancer is connected with circadian disturbances: possible role of melatonin for synchronization of circadian rhythmicity. In: Touitou Y, Arendt J, Pevet P, editors. Melatonin and the pineal gland: from basic science to clinical application. New York: Elsevier; 1993. p. 311-6. [ Links ]
69. Bartsch C, Bartsch H, Jain AK, Laumas KR, Wetterberg L. Urinary melatonin levels in human breast cancer patients. J Neural Transm. 1981;52(4):281-94. [ Links ]
70. Brudnowska J, Pepłońska B. [Night shift work and cancer risk: a literature review]. Med Pr. 2011;62(3):323-38. Polish
71. Cabrera J, Negrín G, Estévez F, Loro J, Reiter RJ, Quintana J. Melatonin decreases cell proliferation and induces melanogenesis in human melanoma SK-MEL-1 cells. J Pineal Res. 2010;49(1):45-54. [ Links ]
72. Fischer TW, Zmijewski MA, Zbytek B, Sweatman TW, Slominski RM, Wortsman J, et al. Oncostatic effects of the indole melatonin and expression of its cytosolic and nuclear receptors in cultured human melanoma cell lines. Int J Oncol. 2006;29(3):665-72. [ Links ]
73. Roberts JE, Wiechmann AF, Hu DN. Melatonin receptors in human uveal melanocytes and melanoma cells. J Pineal Res. 2000;28(3):165-71. [ Links ]
74. Souza AV, Visconti MA, Castrucci AM. Melatonin biological activity and binding sites in human melanoma cells. J Pineal Res. 2003;34(4):242-8. [ Links ]
75. Yi C, Zhang Y, Yu Z, Xiao Y, Wang J, Qiu H, et al. Melatonin enhances the anti-tumor effect of fisetin by inhibiting COX-2/iNOS and NF-κB/p300 signaling pathways. PLoS One. 2014;9(7):e99943. [ Links ]
76. Ying SW, Niles LP, Crocker C. Human malignant melanoma cells express high-affinity receptors for melatonin: antiproliferative effects of melatonin and 6-chloromelatonin. Eur J Pharmacol. 1993;246(2):89-96. [ Links ]
77. Gonzalez R, Sanchez A, Ferguson JA, Balmer C, Daniel C, Cohn A, et al. Melatonin therapy of advanced human malignant melanoma. Melanoma Res. 1991;1(4):237-43. [ Links ]
78. Lissoni P, Fumagalli L, Paolorossi F, Rovelli F, Roselli MG, Maestroni GJ. Anticancer neuroimmunomodulation by pineal hormones other than melatonin: preliminary phase II study of the pineal indole 5-methoxytryptophol in association with low-dose IL-2 and melatonin. J Biol Regul Homeost Agents. 1997;11(3):119-22. [ Links ]
79. Vesnushkin GM, Plotnikova NA, Semenchenko AI, Anisimov VN. Dose-dependent inhibitory effect of melatonin on carcinogenesis induced by benzo[a]pyrene in mice. J Exp Clin Cancer Res. 2006;25(4):507-13.
80. Deriabina ON, Plotnikova NA, Anisimov VN. [Melatonin and metformin inhibit skin carcinogenesis induced by benz(a)pyrene in mice]. Vopr Onkol. 2010;56(5):583-7. [ Links ] Russian
81. Kumar CA, Das UN. Effect of melatonin on two stage skin carcinogenesis in Swiss mice. Med Sci Monit. 2000;6(3):471-5. [ Links ]
82. Dreher F, Gabard B, Schwindt DA, Maibach HI. Topical melatonin in combination with vitamins E and C protects skin from ultraviolet-induced erythema: a human study in vivo. Br J Dermatol. 1998;139(2):332-9. [ Links ]
83. Scheuer C, Pommergaard HC, Rosenberg J, Gögenur I. Dose dependent sun protective effect of topical melatonin: a randomized, placebo-controlled, double-blind study. J Dermatol Sci. 2016;84(2):178-15. [ Links ]
84. Lomas A, Leonardi-Bee J, Bath-Hextall F. A systematic review of worldwide incidence of nonmelanoma skin cancer. Br J Dermatol. 2012;166(5):1069-80. [ Links ]
85. McStay CM. What are the Fitzpatrick categories of skin types and how are they used to prevent sunburn? Medscape [Internet]; 2019. Available from: https://www.medscape.com/answers/773203-93765/what-are-the-fitzpatrick-categories-of-skin-types-and-how-are-they-used-to-prevent-sunburn [ Links ]
86. Fischer T, Bangha E, Elsner P, Kistler GS. Suppression of UV-induced erythema by topical treatment with melatonin: influence of the application time point. Biol Signals Recept. 1999;8(1-2):132-5. [ Links ]
87. Dreher F, Denig N, Gabard B, Schwindt DA, Maibach HI. Effect of topical antioxidants on UV-induced erythema formation when administered after exposure. Dermatology. 1999;198(1):52-5. [ Links ]
88. Morganti P, Bruno C, Guarneri F, Cardillo A, Del Ciotto P, Valenzano F. Role of topical and nutritional supplement to modify the oxidative stress. Int J Cosmet Sci. 2002;24(6):331-9. [ Links ]
89. Morganti P, Fabrizi G, Palombo P, Palombo M, Guarneri F, Cardillo A, et al. New chitin complexes and their anti-ageing activity from inside out. J Nutr Health Ageing. 2012;16(3):242-5. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Carolina Boavida Ferreira
E-mail: carolinagbf@gmail.com
Conflito de interesses
Os autores declaram não ter quaisquer conflitos de interesse.
Financiamento do estudo
Os autores declaram não ter recebido quaisquer subsídios para a realização do trabalho.
Recebido em 26-01-2019
Aceite para publicação em 30-07-2019