Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Medicina Geral e Familiar
versão impressa ISSN 2182-5173
Rev Port Med Geral Fam vol.35 no.2 Lisboa abr. 2019
https://doi.org/10.32385/rpmgf.v35i2.12030
REVISÕES
Medicina física e de reabilitação no tratamento da paralisia de Bell: qual a evidência?
Physical medicine and rehabilitation in the treatment of bell's palsy: what's the evidence?
Sofia Oliveira Vale,1 Sofia Marçalo,2 Cláudio Sousa Martins,3 Ana Catarina Machado4
1 Médica Especialista de Medicina Geral e Familiar na USF Nova Salus.
2 Médica Especialista de Medicina Geral e Familiar na USF S. Félix/Perosinho.
3 Médico Interno de Medicina Geral e Familiar na USF Arco do Prado.
4 Médica Interna de Medicina Geral e Familiar na USF Nova Salus.
Endereço para correspondência | Dirección para correspondencia | Correspondence
RESUMO
Objetivo: Rever a evidência científica da medicina física e de reabilitação (MFR) na recuperação da paralisia de Bell (PB), na fase aguda ou crónica, em qualquer grau de severidade.
Fontes de dados: National Guideline Clearinghouse, Guidelines Finder, Canadian Medical Association Infobase, Cochrane Library, DARE e PubMed.
Métodos de revisão: Pesquisa de normas de orientação clínica (NOC), meta-análises (MA), revisões sistemáticas (RS) e estudos originais, em inglês, espanhol e português, publicados desde 2006, utilizando os termos MeSH peripheral facial paralysis, Bell palsy e rehabilitation. Para atribuição do nível de evidência dos estudos e da força de recomendação foi aplicada a escala Strength of Recommendation Taxonomy (SORT), da American Family Physician.
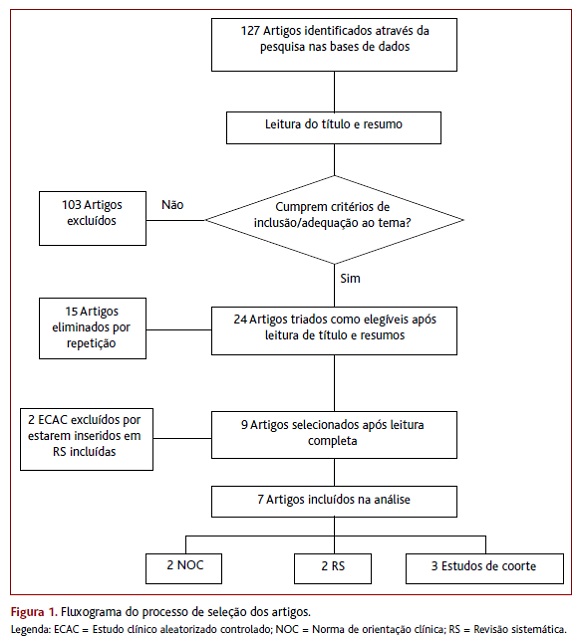
Resultados: Dos 127 artigos obtidos, sete preenchiam os critérios de inclusão: duas NOC, duas RS e três estudos originais. A Canadian Medical Association (2014) recomenda MFR na fase crónica, mas não na fase aguda, enquanto a National Guideline Clearinghouse (2013) não recomenda MFR, independentemente da fase. A RS de Ferreira e colaboradores (2015) revela maior recuperação motora com MFR do que com tratamento farmacológico isolado, sem discriminação da fase. A RS de Teixeira e colaboradores (2012) refere que há baixa evidência de que a MFR seja eficaz, tanto na fase aguda como na crónica. O estudo de coorte de Toffola e colaboradores (2012) conclui que doentes na fase aguda com axonotmese apresentam melhoria com MFR. O ensaio clínico aleatorizado e controlado (ECAC) de Monini e colaboradores (agosto de 2016) revela uma recuperação maior e mais rápida com MFR do que com tratamento farmacológico isolado na PB severa. O ECAC de Monini e colaboradores (dezembro de 2016) sugere a importância de combinar MFR com corticoterapia para um melhor resultado na recuperação da PB severa em todos os grupos etários.
Discussão: Os estudos têm pouca qualidade e são muito heterogéneos. Na fase aguda não permitem concluir se a recuperação dos doentes é espontânea ou se é devida/acelerada por MFR. Não há evidência consistente para a recomendação ou para a não recomendação de MFR na fase aguda ou crónica, pelo que não se pode atribuir uma força de recomendação. São necessários mais ECAC de boa qualidade.
Palavras-chave: Paralisia facial periférica; Paralisia de Bell; Reabilitação.
ABSTRACT
Objective: To review the scientific evidence of the impact of physical medicine and rehabilitation (PMR) in the recovery of acute and chronic Bell's Palsy recovery, in any degree of severity.
Data sources: National Guideline Clearinghouse, Guidelines Finder, Canadian Medical Association Infobase, Cochrane Library, DARE, and PubMed.
Methods: Search of clinical practice guidelines, meta-analyses, systematic reviews, and original studies, published in English, Spanish and Portuguese, published since 2006, using the MeSH terms peripheral facial paralysis', Bell's palsy', and rehabilitation'. The evidence level and the strength of recommendation of the studies were determined using the American Family Physician's Strength of Recommendation Taxonomy Scale.
Results: Among the 127 articles retrieved, seven met the inclusion criteria: two clinical guidelines, two systematic reviews, and three original studies. The Canadian Medical Association (2014) recommends the use of PMR in the chronic phase, but not on acute phase, whilst the National Guideline Clearinghouse (2013) does not recommend PMR, regardless of the phase. The systematic review by Ferreira et al. (2015) shows a greater motor recovery with PMR than with isolated pharmacological treatment, without phase discrimination. The systematic review by Teixeira et al. (2012) claims there is low-quality evidence showing that PMR is effective, both in the acute and chronic phases. The cohort study by Toffola et al. (2012) concludes that patients with axonotmesis in the acute phase show clinical improvement with PMR. The clinical randomised controlled trial by Monini et al. (2016 August) shows a greater and faster recovery with MFR than with pharmacological treatment alone in severe Bell's palsy. The clinical randomised controlled trial by Monini et al. (2016 December) suggests the importance of combining MFR with corticosteroid therapy for a better outcome in the recovery of severe BP in all age groups.
Discussion: The studies have low quality and are very heterogeneous. In the acute they do not allow to conclude whether patient recovery is spontaneous or due/accelerated by the use of PMR. There is no consistent evidence to recommend for or against PMR in the acute or chronic phases, therefore strength of recommendation cannot be attributed. More high-quality randomised controlled studies are needed.
Keywords: Peripheral facial paralysis; Bell's palsy; Rehabilitation.
Introdução
A paralisia facial periférica (PFP) resulta da lesão neuronal periférica do nervo facial (VII) que pode ocorrer a qualquer nível do seu trajeto, do núcleo protuberancial à junção neuromuscular.1 Constitui a lesão periférica dos nervos cranianos mais comum.2 A PFP pode ser primária (idiopática ou paralisia de Bell [PB]), correspondendo a 75% dos casos, ou secundária a múltiplas causas, entre as quais diabetes mellitus, infeções víricas, tumores e traumatismo crânioencefálico.1
A PB tem uma incidência anual de 11,5-40,2 casos por 100.000 habitantes, podendo afetar até um em cada 60 indivíduos ao longo da vida, com picos de incidência entre os 30-50 e os 60-70 anos.3-4 Não existe predomínio por sexo ou hemiface afetada.1 A etiologia da PB é desconhecida, sendo admitidas como possíveis hipóteses uma infeção viral latente reativada (vírus herpes simplex ou varicella zoster), um mecanismo vascular ou de autoimunidade.1,3-5
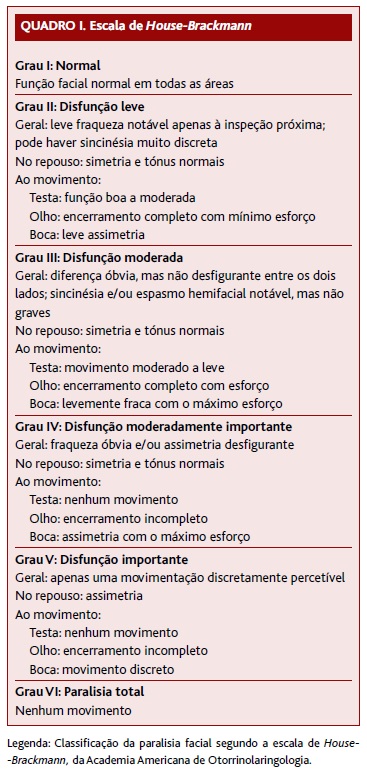
A PB pode apresentar-se com diferentes graus de severidade, desde perda parcial a completa dos movimentos da hemiface afetada.4 Para objetivar o grau de lesão do nervo facial existem vários instrumentos, como a escala de House-Brackmann (HB) (Quadro I), uma das escalas mais utilizadas, e também a eletromiografia, que produz informações prognósticas quando realizada até 14 dias após o evento.1-6
A PB ocorre de forma aguda e pode evoluir para a cronicidade, não existindo uma definição consensual acerca da duração temporal da fase aguda e crónica. Além disso, alguns estudos nem as discriminam.1-5,7 Relativamente à recuperação, Peitersen8 demonstrou que cerca de 70% dos doentes apresenta uma recuperação espontânea completa, sendo em 85% nas três semanas após o evento e os restantes após três a cinco meses. Dada a elevada taxa de recuperação espontânea torna-se difícil estabelecer uma associação entre o tratamento e a recuperação, especialmente na fase aguda.5
A terapêutica com corticosteroides (prednisolona) parece ser a mais efetiva no tratamento da PB, devendo ser iniciada nas primeiras 72 horas e é a única recomendada pelo Colégio Americano de Neurologia.4-5,7,9 A dose recomendada é de 60mg por dia durante cinco dias, seguida de 10mg por dia, numa duração total de tratamento de 10 dias.6 A utilização de corticosteroides na fase aguda da PB assenta no pressuposto da redução da inflamação e do edema do nervo facial.
Atualmente existem outras opções terapêuticas adjuvantes como os antivirais, a intervenção cirúrgica e a medicina física e de reabilitação (MFR). Contudo, a sua eficácia é controversa, quer no uso isolado quer em associação com a corticoterapia. Na MFR são vários os métodos e agentes físicos utilizados na terapia da PB, como a reeducação neuromuscular funcional (associada ou não ao biofeedback com eletromiografia de superfície ou ao biofeedback do espelho), a mímica facial/exercícios faciais, a eletroestimulação, a massagem externa e a termoterapia.1,4-5
Este trabalho tem como objetivo rever a evidência científica da MFR na recuperação da PB, na fase aguda ou crónica, em qualquer grau de severidade, definido por escalas validadas e/ou resultados de eletromiografia.
Métodos
Foi realizada uma pesquisa bibliográfica por dois autores da revisão, nas bases de dados National Guideline Clearinghouse, Guidelines Finder, Canadian Medical Association Infobase, Cochrane, DARE e PubMed. Foram pesquisadas normas de orientação clínica (NOC), meta-análises (MA), revisões sistemáticas (RS), ensaios clínicos aleatorizados e controlados (ECAC), ensaios clínicos não aleatorizados e estudos de coorte, utilizando os termos MeSH peripheral facial paralysis, Bell palsy e rehabilitation. Foram incluídos estudos em inglês, espanhol e português, publicados entre 1 de janeiro de 2006 e 31 de dezembro de 2017.
Os critérios utilizados para a inclusão dos artigos nesta revisão foram definidos segundo o modelo PICO: População - doentes de qualquer idade com PFP Primária/PB na fase aguda e/ou crónica e com qualquer grau de severidade; Intervenção - qualquer modalidade de tratamento de MFR; Comparação - tratamento farmacológico isolado ou nenhum tipo de tratamento; Outcome - melhoria clínica avaliada por escalas validadas e/ou eletromiografia.
Foram excluídos os ECAC que comparam diferentes tratamentos de MFR.
Para estratificar o nível de evidência (NE) dos estudos e estabelecer a força de recomendação (FR) foi aplicada a Strength of Recommendation Taxonomy (SORT), da American Academy of Family Physicians.10-11
Resultados
Dos 127 artigos obtidos da pesquisa, sete preencheram os critérios de inclusão: duas NOC, duas RS e três estudos originais (dois ECAC e um estudo de coorte). Foram eliminados 118 artigos após leitura do título e resumo, 15 dos quais por repetição e os restantes por não adequação ao tema ou por presença de critérios de exclusão. Dois ECAC foram excluídos após leitura completa dos artigos, uma vez que estavam inseridos em RS já incluídas. A Figura 1 representa o fluxograma da seleção dos estudos.
Normas de orientação clínica
A Canadian Medical Association3 (2014) não recomenda os exercícios de MFR na fase aguda, qualquer que seja o grau de severidade da PB, baseando-se em três ECAC. Relativamente à eletroestimulação, na fase aguda é recomendada a sua não utilização, uma orientação baseada em quatro estudos (ECAC ou quasi-aleatorizados). Na fase crónica, esta NOC recomenda os exercícios de MFR nos pacientes com défice persistente, com base num estudo não aleatorizado (o grupo submetido a MFR teve uma melhoria significativa da função facial medida pela escala HB, com um RR [risco relativo] de 0,6 e um IC [intervalo de confiança] 95% [0,1-1,1]) (Quadro II). As conclusões desta NOC baseiam-se em estudos de fraca qualidade, com risco de viés e resultados imprecisos e heterogéneos. Além disso, não define a duração da fase aguda e crónica (FR B).
A National Guideline Clearinghouse7 (2013) não recomenda MFR, independentemente da fase (Quadro II). Baseia-se em casos de séries com baixo nível de confiança na sua evidência por falhas significativas nos estudos incluídos, com balanço duvidoso entre benefícios e riscos, não discriminando também fase aguda de fase crónica (FR B).
Revisões sistemáticas
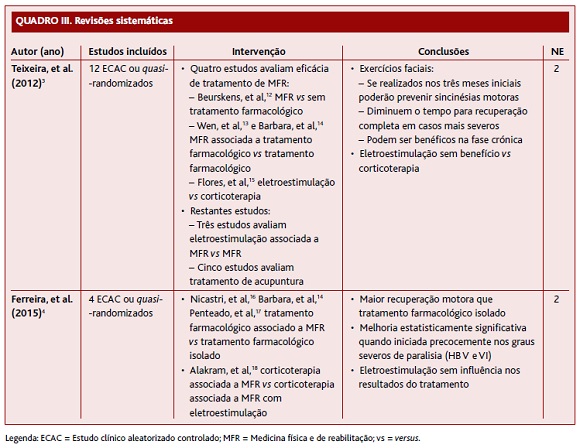
A RS de Teixeira e colaboradores,4 publicada em 2012 (Quadro III), inclui 12 ECAC ou quasi-aleatorizados, num total de 873 participantes. Os autores da presente revisão optaram apenas por incluir os únicos quatro estudos (364 participantes) que avaliaram a eficácia do tratamento de MFR (exercícios faciais ou eletroestimulação) face a um grupo controlo sem MFR.12-15 Esta RS teve como objetivo primário analisar a recuperação incompleta seis meses após o evento. Teve como, objetivos secundários, analisar a presença de sincinésias motoras, contraturas, hipersincinésias, espasmos faciais ou síndroma de Bogorad, seis meses após o evento; analisar a recuperação incompleta após um ano; e analisar os efeitos adversos associados à intervenção. A maioria dos resultados não demonstrou diferença estatisticamente significativa entre os tratamentos. Apesar de não ter significado estatístico, a MFR quando aplicada durante duas semanas promoveu uma recuperação mais rápida nos casos mais severos (no grupo experimental recuperaram cinco dos nove doentes, comparando com o grupo controlo em que apenas três dos onze doentes recuperaram, com um RR=2,4 e com IC95% [0,66-6,29]).12 Relativamente às sincinésias motoras, numa pequena amostra (grupo experimental=4 [4,7%] versus grupo controlo=12 [20%]) verificou-se uma redução após 12 semanas de exercícios faciais (RR=0,24, IC95% [0,08-0,69]).13 Quanto à fase crónica (mais de nove meses após o evento), verificou-se que ao fim de um ano de MFR todos os participantes passaram de uma pontuação de IV na escala HB para uma pontuação de III (RR=2,40, IC95% [8,76-32,04]).14 No que respeita à electroestimulação, não se verificou um benefício significativo quando comparada com a corticoterapia (recuperação completa seis meses após: grupo experimental=10 [12,98%] versus grupo controlo=11 [15,27%], com RR=0,62, IC95% [0,34-1,15]).15 Não houve registo de efeitos adversos da MFR em nenhum dos estudos incluídos. Esta RS inclui estudos de baixa ou moderada qualidade, com populações heterogéneas e dados incompletos. Três estudos avaliam a eficácia de MFR na fase aguda, mas definem de forma diferente a duração desta fase, com um máximo de 12 sema-nas.12-13,15 Apenas um estudo incluído avalia a eficácia de MFR na fase crónica (definida por uma duração superior a nove meses), tratando-se, no entanto, de um estudo de fraca qualidade.14 Tendo em conta as limitações apontadas nestes estudos atribui-se um NE 2.
A RS de Ferreira e colaboradores,5 publicada em 2015 (Quadro III), inclui quatro estudos ECAC ou quasi-aleatorizados, num total de 143 participantes com idades entre os 16 e 87 anos. Três estudos comparam a eficácia da MFR associada a tratamento farmacológico com o tratamento farmacológico isolado; o outro estudo inclui também eletroestimulação associada à MFR.12,16-18 Esta RS teve como objetivo primário medir a recuperação muscular facial (parcial ou completa), definida pela escala HB nos graus I ou II; e, como objetivo secundário, medir os efeitos adversos da intervenção. Esta RS demonstrou maior recuperação motora com MFR associada a tratamento farmacológico do que com tratamento farmacológico isolado. Um dos estudos, considerado de boa qualidade, em que a MFR foi iniciada até 10 dias após o evento de PB, demonstrou que o grupo experimental (MFR e corticoterapia) teve uma melhoria significativa na recuperação funcional (p=0,044), quando comparado com o grupo controlo (corticoterapia isolada), nos graus severos de paralisia (HB V e VI) após seis meses (Quadro III).16 A eletroestimulação associada a corticoterapia mostrou uma recuperação da função motora (grupo experimental=37% e grupo controlo=30%), embora não estatisticamente significativa (p=0,36), permitindo concluir que a eletroestimulação não tem influência nos resultados do tratamento padrão da PB.18 Nenhum estudo incluído reportou efeitos adversos. Esta RS inclui poucos estudos e a maioria deles tem evidência de baixa qualidade, excetuando um, considerado de boa qualidade (com base na escala PEDro). Além disso, os estudos instituem tratamentos de MFR em fases temporais diferentes, que variam entre os quinze dias e um ano. Desta forma, não é possível concluir se o tratamento combinado (MFR e corticoterapia) é ou não benéfico na recuperação motora dos doentes com PB, pelo que se atribuiu um NE 2.
Estudos originais
Estudo coorte
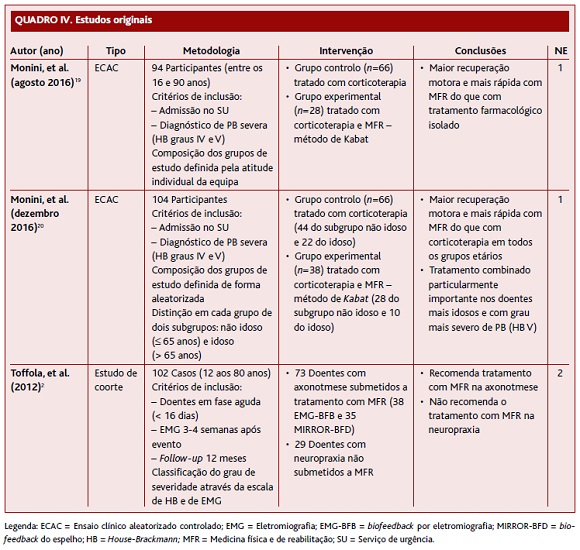
O estudo de coorte de Toffola e colaboradores,2 de 2012 (Quadro IV), incluiu 102 participantes (entre os 12 e 80 anos) na fase aguda da PB (menos de 16 dias após o evento), submetidos a eletromiografia 3-4 semanas após o evento (permitindo distinguir neuropraxia de axonotmese) e com follow-up aos 12 meses. Este estudo utilizou a escala de HB (no início e 12 meses depois) e a eletromiografia (cerca de um mês após o evento) para classificação do grau de severidade. Dos participantes incluídos, 29 doentes tinham neuropraxia (bloqueio fisiológico transitório na contusão nervosa e com continuidade anatómica mantida) e não foram submetidos a qualquer tratamento de MFR. A axonotmese (rutura dos axónios, com manutenção da integridade da bainha) estava presente em 73 doentes, que foram submetidos a tratamento com MFR (38 doentes com biofeedback por eletromiografia e 35 doentes com biofeedback do espelho).
Houve uma melhoria clínica no final dos 12 meses em todos os participantes do estudo, mas sem significado estatístico (p=0,596). Todos os doentes com neuropraxia apresentaram recuperação espontânea completa, incluindo os 37,9% que tinham paralisia total (HB VI). Quanto aos doentes com axonotmese, em 53,5% dos casos com paralisia total, apenas 34% tiveram recuperação completa, avaliada pela escala HB. Uma das limitações deste estudo é o facto de ter sido realizado apenas em pacientes na fase aguda de PB. Atribuiu-se um NE 2.
ECAC
O ECAC de Monini e colaboradores,19 de agosto de 2016 (Quadro IV), incluiu 94 participantes (entre os 16 e 90 anos) admitidos no serviço de urgência com diagnóstico de PB severa (HB graus IV e V). Os participantes foram divididos em dois grupos com base na atitude terapêutica: grupo controlo (n=66) tratado com corticoterapia e grupo experimental (n=28) tratado com corticoterapia e MFR - método de Kabat (facilitação neuromuscular propriocetiva da resposta voluntária do músculo lesado).
Ao comparar o grupo experimental com o grupo controlo, independentemente do grau inicial de PB, foram encontradas diferenças significativas (p=0,010) naquilo que respeita à melhoria clínica. O significado estatístico relativamente às duas modalidades de tratamento (grupo experimental versus controlo) foi ainda maior quando analisados individualmente os graus IV (p=0,000) e V (p=0,009) da escala de HB.
No que respeita às especificidades da recuperação, os participantes do grupo experimental apresentaram uma probabilidade de melhoria, em três ou mais graus na escala de HB, cerca de 20 vezes superior, à apresentada pelos participantes do grupo controlo (Odds-Ratio [OR]=17,73, IC95% [5,72-54,98], p<0,001). Quando analisados individualmente, os participantes do grupo experimental com HB IV apresentaram uma probabilidade de melhoria, em três graus na escala de HB, 65 vezes superior à do grupo controlo; enquanto todos os participantes do grupo experimental com HB V tiveram melhoria em três graus na escala de HB, quando comparados com o grupo controlo. Em suma, a maioria dos pacientes com PB grave (HB V) do grupo controlo alcançou o resultado máximo de HB III, enquanto os casos semelhantes do grupo experimental (submetidos ao método de Kabat) conseguiram obter uma função facial normal (HB I).
Em relação à velocidade média de recuperação, no grupo experimental foi metade da registada no grupo controlo (RR=2,19, IC95% [1,37-3,51], p=0,001). Os pacientes do grupo experimental com HB IV tiveram tempos de recuperação sete vezes mais curtos, em relação aos pacientes do grupo controlo com graus semelhantes de PB (RR=7,92, IC95% [3,68-17,04], p<0,001). Já os pacientes do grupo experimental com HB V apresentaram um tempo de recuperação cerca de 50% inferior aos pacientes do grupo controlo com o mesmo grau de PB (RR=1,80, IC95% [0,65-5,01], p=0,26) (64,6 dias versus 117,1 dias).
A incidência de sincinésias após o tratamento foi de 7,1% no grupo experimental e de 12,1% no grupo controlo, sem diferença estatisticamente significativa (p=0,479).
Este estudo apresenta várias limitações. Primeiro, os grupos de estudo foram escolhidos com base na avaliação da equipa do serviço de urgência, que definiu aleatoriamente quais os doentes a serem sujeitos a terapêutica no domicílio com corticoterapia e quais os doentes a referenciar para a consulta para realização de MFR (método de Kabat). Segundo, incluiu apenas pacientes com PB severa (HB IV e V). Por último, não foi discriminada a fase da PB em que os doentes se encontravam, pois apesar de terem sido incluídos doentes que se deslocaram ao serviço de urgência (possivelmente em fase aguda), não está descrito quando é que estes iniciaram os sintomas. Atribuiu-se um NE 1.
Outro ECAC, também de Monini e colaboradores,20 de dezembro de 2016 (Quadro IV), incluiu 104 participantes admitidos no serviço de urgência de um hospital terciário, com o diagnóstico de PB severa (HB graus IV e V). Os participantes foram divididos em dois grupos com base na atitude terapêutica: grupo controlo (n=66) tratado com corticoterapia e grupo experimental (n=38) tratado com corticoterapia e MFR - método de Kabat. Em ambos os grupos foram distinguidos dois subgrupos: um subgrupo com idade igual ou inferior a 65 anos de idade (subgrupo não idoso) [grupo controlo (n=44) versus grupo experimental (n=28)] e um subgrupo com idade superior a 65 anos de idade (subgrupo idoso) [grupo controlo (n=22) versus grupo experimental (n=10)].
A análise de covariância da recuperação temporal, independentemente da idade, mostrou que o tempo de recuperação foi significativamente menor no grupo experimental (p=0,004). Neste grupo, considerando os participantes com PB de HB V, quase 90% do subgrupo não idoso apresentou uma recuperação completa, enquanto esse resultado foi de apenas cerca de 50% no subgrupo idoso. Em relação aos participantes com HB IV não se verificou qualquer diferença de recuperação entre os dois subgrupos de idade, uma vez que a recuperação completa foi alcançada na totalidade dos participantes.
No que respeita ao tempo médio para a recuperação clínica no subgrupo não idoso, no grupo controlo a duração foi de 103,2 dias (mínimo=34 dias; máximo=310 dias) enquanto no subgrupo experimental a duração foi de 54,9 dias (mínimo=12 dias; máximo=142 dias). No subgrupo idoso a recuperação clínica no grupo controlo foi de 145,1 dias (mínimo=38 dias; máximo=365 dias) e no grupo experimental foi de 85 dias (mínimo=34 dias; máximo=194 dias).
Verificou-se uma relação significativa entre a idade e o nível de recuperação, a favor do subgrupo não idoso em ambos os grupos [grupo controlo (p=0,010); grupo experimental (p=0,000)]. Os participantes do grupo experimental mostraram, em média e para qualquer idade, uma recuperação funcional mais rápida (70 dias versus 124 dias) quando comparados com os participantes do grupo controlo.
Este estudo apresenta como limitações o facto de ter sido realizado apenas em pacientes com PB severa (HB IV e V) e por não discriminar em que fase da PB os doentes se encontravam. Atribuiu-se um NE 1.
Conclusão
A Canadian Medical Association3 não recomenda os exercícios de MFR na fase aguda, recomendando-os na fase crónica, mas apenas em doentes com fraqueza persistente. A National Guideline Clearinghouse7 não recomenda MFR, independentemente da fase da doença.
A RS de Teixeira e colaboradores4 conclui que não existe evidência de elevada qualidade a favor de um benefício ou dano significativo de qualquer forma de MFR na PB. Existe evidência de baixa qualidade de que os exercícios de MFR melhoram a função facial, especialmente nos doentes com PB moderada ou na fase crónica, e de que reduzem o tempo total de recuperação e as sequelas na fase aguda.
A RS de Ferreira e colaboradores5 sugere que a MFR, associada a corticoterapia, parece ter um efeito positivo no grau e tempo de recuperação quando comparada com a corticoterapia isolada. Contudo, existe evidência de baixa qualidade dos ECAC, o que torna insuficiente para decidir a favor ou contra o tratamento combinado na recuperação da PB.
O estudo de coorte de Toffola e colaboradores2 conclui que o tratamento de MFR não é necessário nos doentes com neuropraxia, pois não existem sinais de desenervação, pelo que esses doentes recuperam espontaneamente. Nos doentes com axonotmese verifica-se uma melhoria sintomática, mas sem significado estatístico.
O ECAC de Monini e colaboradores,19 de agosto de 2016, conclui que quando a MFR é associada à corticoterapia nos casos de PB severa, os doentes apresentam uma maior probabilidade de recuperação mais rápida e completa do que aqueles submetidos apenas a tratamento com corticosteróides, com significado estatístico.
Outro ECAC, também de Monini e colaboradores,20 de dezembro de 2016, sugere a importância de combinar a MFR com o tratamento médico convencional para um melhor resultado na recuperação da PB severa em todos os grupos etários. Este tratamento combinado é particularmente importante nos doentes mais idosos e com grau mais severo de PB (HB V) que apresentam menor probabilidade de recuperação no mesmo tempo e grau que os doentes mais jovens.
Após a análise dos artigos conclui-se que os dados encontrados são limitados pelo tipo e validade dos estudos, os quais têm pouca qualidade e são muito heterogéneos. Dada a inconsistência dos resultados dos estudos quanto à utilização da MFR, tanto na fase aguda como crónica da PB, torna-se difícil concluir acerca dos seus benefícios. Na fase aguda são precisos mais ECAC para se poder determinar se a recuperação dos doentes é espontânea ou se é devida/acelerada por MFR. São ainda necessários mais ECAC de boa qualidade, em que o grupo controlo não inclua qualquer tipo de modalidade de MFR e em que as fases aguda e crónica da PB estejam bem definidas.
Não existe evidência para a recomendação ou para a não recomendação de MFR na fase aguda ou crónica, pelo que não se pode atribuir uma força de recomendação.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Matos C. Paralisia facial periférica: o papel da medicina física e de reabilitação [Peripheral facial paralysis: the role of physical medicine and rehabilitation]. Acta Med Port. 2011;24(Suppl 4):907-14. Portuguese
2. Dalla Toffola E, Tinelli C, Lozza A, Bejor M, Pavese C, Degli Agosti I, et al. Choosing the best rehabilitation treatment for Bell's palsy. Eur J Phys Rehabil Med. 2012;48(4):635-42. [ Links ]
3. de Almeida JR, Guyatt GH, Sud S, Dorion J, Hill MD, Kolber MR, et al. Management of Bell palsy: clinical practice guideline. CMAJ. 2014;186(12):917-22. [ Links ]
4. Teixeira LJ, Valbuza JS, Prado GF. Physical therapy for Bell's palsy (idiopathic facial paralysis). Cochrane Database Syst Rev. 2011;(12):CD006283. [ Links ]
5. Ferreira M, Marques EE, Duarte JA, Santos PC. Physical therapy with drug treatment in Bell palsy: a focused review. Am J Phys Med Rehabil. 2015;94(4):331-40. [ Links ]
6. Murthy JM, Saxena AB. Bell's palsy: treatment guidelines. Ann Indian Acad Neurol. 2011;14(Suppl 1):S70-2. [ Links ]
7. Baugh RF, Basura GJ, Ishii LE, Schwartz SR, Drumheller CM, Burkholder R, et al. Clinical practice guideline: Bell's palsy. Otolaryngol Head Neck Surg. 2013;149(Suppl 3):S1-27. [ Links ]
8. Peitersen E. Bell´s palsy: the spontaneous course of 2,500 peripheral facial nerve palsies of different etiologies. Acta Otolaryngol. 2002;549 Suppl:4-30. [ Links ]
9. Gronseth GS, Paduga R. Evidence-based guideline update: steroids and antivirals for Bell palsy: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2012;79(22):2209-13. [ Links ]
10. Braga R, Melo M. Como fazer uma revisão baseada na evidência [How to write an evidence based review]. Rev Port Clin Geral. 2009;25(6):660-6. Portuguese
11. Ebell MH, Siwek J, Weiss BD, Woolf SH, Susman J, Ewigman B, et al. Strength of recommendation taxonomy (SORT): a patient-centered approach to grading evidence in the medical literature. Am Fam Physician. 2004;69(3):548-56. [ Links ]
12. Barbara M, Antonini G, Vestri A, Volpini L, Monini S. Role of Kabat physical rehabilitation in Bell's palsy: a randomized trial. Acta Otolaryngol. 2010;130(1):167-72. [ Links ]
13. Wen CM, Zhang BC. Effect of rehabilitation training at different degree in the treatment of idiopathic facial palsy: a randomized controlled comparison. Chin J Clin Rehabil. 2004;8(13):2446-7. [ Links ] Chinese
14. Beurskens CH, Heymans PG. Positive effects of mime therapy on sequelae of facial paralysis: stiffness, lip mobility, and social and physical aspects of facial disability. Otol Neurotol. 2003;24(4):677-81. [ Links ]
15. Flores-Flores P, Medina-Zazueta R, Haro-García L. Tratamiento de la parálisis facial periférica idiopática: terapia física versus prednisona [Idiopathic peripheral facial paralysis treatment physic therapy versus prednisone]. Rev Med IMSS. 1998;36(3):217-21. Spanish
16. Nicastri M, Mancini P, De Seta D, Bertoli G, Prosperini L, Toni D, et al. Efficacy of early physical therapy in severe Bell's palsy: a randomized controlled trial. Neurorehabil Neural Repair. 2013;27(6):542-51. [ Links ]
17. Penteado TC, Testa JR, Antunes ML, Chevalier AM. Évaluation de la technique Chevalier pour la prévention des séquelles dans la paralysie faciale périphérique [Evaluation of the Chevalier method for the prevention of sequelae after peripheral facial nerve palsy]. Kinesither Rev. 2009;9(90):40-7. French
18. Alakram P, Puckree T. Effects of electrical stimulation on House-Brackmann scores in early Bell's palsy. Physiother Theory Pract. 2010;26(3):160-6. [ Links ]
19. Monini S, Iacolucci CM, Di Traglia M, Lazzarino AI, Barbara M. Role of Kabat rehabilitation in facial nerve palsy: a randomised study on severe cases of Bell's palsy. Acta Otorhinolaryngol Ital. 2016;36(4):282-8. [ Links ]
20. Monini S, Buffoni A, Romeo M, Di Traglia M, Filippi C, Atturo F, et al. Kabat rehabilitation for Bell's palsy in the elderly. Acta Otolaryngol. 2017;137(6):646-50. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Sofia Oliveira Vale
E-mail: sofia.oliveira.vale@gmail.com
Conflito de interesses
Os autores declaram não ter quaisquer conflitos de interesse.
Financiamento
Os autores declaram não ter recebido subsídios ou bolsas para a elaboração do artigo.
Recebido em 22-02-2017
Aceite para publicação em 07-02-2019