Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Medicina Geral e Familiar
versão impressa ISSN 2182-5173
Rev Port Med Geral Fam vol.34 no.5 Lisboa out. 2018
https://doi.org/10.32385/rpmgf.v34i5.12094
REVISÕES
Aporte de iodo e função tiroideia na gravidez
Iodine intake and thyroid function in pregnancy
Jaime Luís da Rocha Oliveira,1 Davide Maurício Costa Carvalho,2-3 Sandra Patrícia Mota Belo2-3
1. Médico Interno do Ano Comum. Centro Hospitalar de São João.
2. i3S - Instituto de Investigação e Inovação em Saúde, Universidade do Porto.
3. Serviço de Endocrinologia, Diabetes e Metabolismo. Centro Hospitalar de São João.
Endereço para correspondência | Dirección para correspondencia | Correspondence
RESUMO
Objetivo: Rever a evidência científica sobre o aporte de iodo e a função tiroideia na gravidez.
Fontes de dados: Bases de dados MEDLINE, Scopus, Google Scholar e SciELO, bem como documentos oficiais da Organização Mundial da Saúde, da American Thyroid Association, do Iodine Global Network e da Direção-Geral da Saúde.
Métodos de revisão: Revisão de artigos científicos sobre a espécie humana, escritos em língua inglesa ou portuguesa, e publicados entre 01/01/1990 e 30/09/2016. Estes artigos foram pesquisados através de uma query constituída por termos MeSH: Iodine, Thyroid Gland e Pregnancy.
Resultados: Foram analisados exaustivamente 107 artigos e incluíram-se, nesta revisão, dados referentes a 70 artigos, selecionados com base na sua relevância científica. Devido ao aumento das necessidades durante a gravidez e amamentação, o défice de iodo é mais prevalente nestas etapas da vida. Mesmo que ligeiro/moderado, o défice materno de iodo pode afetar o neurodesenvolvimento fetal. Neste contexto, as alterações tiroideias, fisiológicas, durante a gravidez podem tornar-se patológicas, verificando-se diminuição das hormonas livres, aumento da TSH e aumento da tiroglobulina e do volume tiroideu maternos e fetais. Por outro lado, a suplementação iodada durante a gravidez parece ser segura e vários estudos sugerem que se associa a um melhor neurodesenvolvimento fetal, à prevenção do aumento da tiroglobulina e do volume tiroideu. Parece ainda melhorar a TSH, porém, com efeito nulo nas concentrações de hormonas tiroideias totais e livres.
Conclusões: O aporte inadequado de iodo é deletério para a função tiroideia materna e neurodesenvolvimento fetal, podendo a suplementação durante a gravidez prevenir a deterioração funcional da tiroide. Contudo, existem poucos ensaios clínicos aleatorizados e a evidência disponível nem sempre é concordante, pelo que é necessária mais investigação sobre este tema.
Palavras-chave: Iodo; Glândula tiroide; Função tiroideia; Gravidez.
ABSTRACT
Aim: To review the published evidence relating iodine intake and thyroid function in pregnancy.
Data source: MEDLINE, Scopus, Google Scholar and Scielo databases, as well as official documents from World Health Organization, American Thyroid Association, Iodine Global Network and Direção-Geral da Saúde.
Review methods: Review of scientific articles focusing in humans species, written in English or Portuguese, and published between 01/01/1990 and 30/09/2016. These articles were searched through a query consisting of the MeSH terms Iodine, Thyroid Gland and Pregnancy.
Results: 107 articles were exhaustively analyzed, and data from 70 of them was included in this review, which were selected based on their scientific relevance. Due to the increased need of iodine during pregnancy and breastfeeding, its deficiency is more common during these periods. Even though mild/moderate, maternal iodine deficiency can affect the fetal neurodevelopment. In face of maternal iodine deficiency, physiological changes of the thyroid during pregnancy can become pathological, with a decrease of free hormones levels, an increase of TSH and an increase of the maternal and fetal thyroglobulin levels and thyroid volume. On the other hand, iodine supplementation during pregnancy appears to be safe, and several studies suggest that it is associated with improved fetal neurodevelopment and the prevention of the increase of both thyroglobulin levels and thyroid volume. Additionally, it appears to improve TSH, despite having no effect on the concentration of total and free thyroid hormones.
Conclusions: Inadequate iodine intake is deleterious to maternal thyroid function and fetal neurodevelopment. Supplementation during pregnancy seems to prevent the functional deterioration of the thyroid. However, there are few randomized clinical trials and the evidence available is not always consistent, therefore more research on this topic is needed.
Keywords: Iodine; Thyroid Gland; Thyroid Function; Pregnancy.
Introdução
O iodo é um micronutriente essencial que, não sendo produzido pelo organismo, deve ser obtido através de fontes exógenas, sobretudo a partir da alimentação.1-2
Este nutriente é o elemento-chave para a biossíntese de hormonas tiroideias, sendo por isso indispensável para um crescimento e um desenvolvimento normais.3-9 A produção das hormonas tiroideias requer um aporte adequado de iodo, já que este representa, respetivamente, 59 e 65% dos pesos moleculares das hormonas T3 e T4.8-11 Por outro lado, o iodo parece exercer ação antioxidante tecidular, diminuindo as lesões causadas pelos radicais livres de oxigénio.12
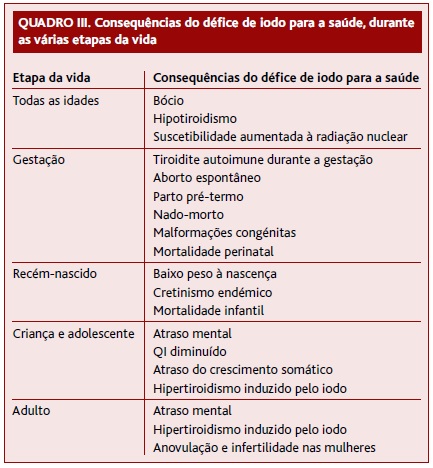
As necessidades deste micronutriente variam ao longo da vida, sendo superiores durante a gravidez e a amamentação.13-16 Assim, o défice de iodo e os seus efeitos nefastos são mais frequentes e exuberantes nas grávidas e lactantes (abortos espontâneos, partos prematuros, nados-mortos, malformações congénitas, bócio e hipotiroidismo), bem como nos recém-nascidos (prejuízo do desenvolvimento do sistema nervoso central (SNC)).1,8,14,17
As hormonas tiroideias são essenciais para o desenvolvimento do SNC desde a vida intrauterina, sendo asseguradas pela grávida.4,6,14,18-19 Portanto, verificando-se défice de iodo alimentar desenvolve-se hipotiroxinemia materna, que pode causar lesões irreversíveis no cérebro fetal.3-4,7,14
O défice deste nutriente constitui um problema de saúde pública mundial e a iodização universal do sal tem sido a principal estratégia para o combater.11,14,20-21 Todavia, as grávidas e lactantes constituem um grupo particularmente vulnerável, pelo que a maioria dos estudos e das organizações internacionais recomendam a suplementação de iodo em mulheres na preconceção, gravidez e amamentação, exceto naquelas com patologia tiroideia conhecida.20,22-23
Infelizmente, existem poucos ensaios clínicos aleatorizados que tenham avaliado o impacto do aporte de iodo na função tiroideia durante a gravidez. Contudo, a evidência sugere cada vez mais benefícios, para a saúde e economia, decorrentes da suplementação recomendada pelas organizações internacionais.24
O presente artigo tem como principal objetivo rever a literatura sobre o aporte de iodo e suas consequências, com particular ênfase na função tiroideia durante a gravidez.
Face ao défice de iodo existente no nosso país, particularmente nas grávidas e lactantes,5,15,25-27 este artigo pretende ainda alertar para: a importância do aporte adequado; o panorama mundial e nacional do aporte de iodo; e possíveis estratégias para a sua prevenção e correção.
Métodos
Criou-se uma query constituída pelos termos MeSH Iodine, Thyroid Gland e Pregnancy, que foi utilizada na pesquisa de artigos científicos sobre a espécie humana, escritos nas línguas inglesa ou portuguesa, e publicados entre 01/01/1990 e 30/09/2016. A pesquisa bibliográfica decorreu até ao dia 01/10/2016 e centrou-se nas bases de dados MEDLINE, Scopus, Google Scholar e SciELO, bem como nos documentos oficiais da Organização Mundial da Saúde (OMS), da American Thyroid Association (ATA), do Iodine Global Network (IGN) e da Direção-Geral da Saúde (DGS).
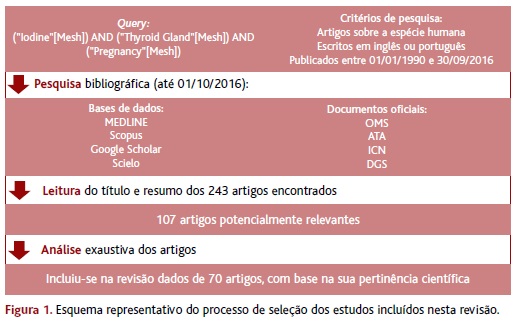
Após a leitura do título e resumo de todos os artigos encontrados (n=243), selecionaram-se os relacionados com o tema em estudo (n=107) e procedeu-se à sua análise exaustiva. Foram incluídos nesta revisão os dados referentes a 70 artigos, selecionados com base na sua pertinência científica.
O processo de seleção dos estudos incluídos nesta revisão está representado no esquema da Figura 1.
Resultados
1. Fontes de iodo
1.1 Na natureza
O iodo pode encontrar-se em vários estados de oxirredução: iodo elementar (I2), iodeto (I-) e iodato (IO-).12 Na natureza, a maioria deste nutriente encontra-se na água salgada dos mares e oceanos,3-4,8,28 enquanto os solos e reservatórios de água doce contêm apenas uma pequeníssima parte do iodo existente.4,28
O iodo presente na água sofre volatilização por ação da radiação ultravioleta ou ação mecânica das ondas, incorporando-se no ar atmosférico onde é transportado.4,28-29 A partir daí, a sua distribuição para os solos é determinada pelo fornecimento através da pluviosidade, bem como pela capacidade do solo em reter iodo: os solos argilosos e aluviais são os mais ricos e os de granito são os mais pobres neste oligoelemento.4,22
Ao nível do solo, o iodo sofre o efeito de lixiviação (por ação das chuvas, das inundações, da neve e da glaciação),7-8,14 sendo arrastado para o mar e enriquecendo a água, algas e peixes.14 Por este motivo, os solos distantes da região costeira e localizados a grandes altitudes apresentam menor teor deste nutriente.3-4,8,14,18
1.2 Na dieta
A principal via de aporte de iodo é a dieta.2,6,10 Porém, os níveis dietéticos deste nutriente variam amplamente entre as regiões e, inclusive, dentro da mesma região.29
O teor de iodo nos alimentos reflete o teor dos solos e mares onde crescem e, como tal, as fontes dietéticas mais ricas têm origem nos mares e oceanos, devido à bioacumulação.9,30 Por outro lado, as plantas e animais consumidos pelo Homem crescem frequentemente em solos com carência de iodo, tornando o défice num problema frequente.4,7-8,14,30
O sal iodado, as algas e animais marinhos são as fontes mais ricas em iodo na dieta.1,12,20 Por sua vez, os vegetais, cereais, carne e leite, apesar de apresentarem menor teor de iodo, também têm impacto no aporte deste nutriente devido à quantidade e à frequência com que são consumidos.1,20
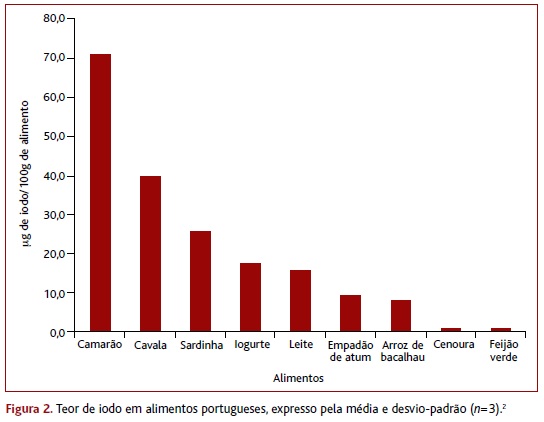
No nosso país, a quantidade de iodo não consta do rótulo na embalagem dos alimentos, dificultando a identificação das fontes alimentares deste nutriente.6 Além disso, na literatura são raros os dados da retenção de iodo nos alimentos quando estes são cozinhados.2 Assim sendo, em 2016, Delgado e colaboradores investigaram o teor de iodo em alimentos representativos da dieta portuguesa tal como estes são consumidos.2 Foram analisados seis grupos de alimentos: marisco, peixe, laticínios, refeições compostas, vegetais e frutas (por ordem decrescente de concentração em iodo - Figura 2).2
Segundo Delgado, o pescado é o grupo mais rico em iodo, variando entre 32μg/100g (peixe) e 114μg/100g (marisco/bivalves).2 Por sua vez, as refeições à base de pescado apresentaram em média 10μg de iodo/100g de alimento, provavelmente devido ao baixo teor de iodo dos ingredientes que compõem estas refeições, para além do peixe.2 Neste estudo, a concentração de iodo nas frutas e vegetais foi próxima do limite de quantificação, refletindo a escassez de iodo nos solos.2
Além da dieta, há outras fontes menos significativas para o aporte deste nutriente: suplementos alimentares, multivitamínicos pré-natais, fármacos (expectorantes, amiodarona) e o contacto com produtos de contraste radiográfico ou com iodeto de povidona.8,10,31
2. Recomendações quanto ao aporte de iodo
Embora a dose diária recomendada (DDR) de iodo seja da ordem dos microgramas, a deficiência deste nutriente tem consequências graves para a saúde, coletivamente designadas por iodine deficiency disorders (IDD).3,6,12
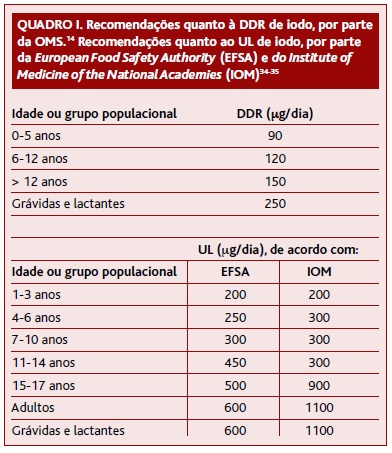
A DDR de iodo aumenta desde o nascimento até à adolescência, mantendo-se posteriormente constante, exceto durante a gravidez e amamentação (Quadro I).14 Nestes períodos há um aumento das necessidades de iodo, essencial para o desenvolvimento adequado do SNC da criança.32
Durante a gravidez, as necessidades de iodo aumentam em cerca de 50%,1 por aumento da T4 necessária para manter o metabolismo normal da mulher,13 transferência de T4 e de iodo para o feto13 e aumento da excreção renal, devido ao aumento da taxa de filtração glomerular.13 Na lactação, embora a taxa de produção de hormonas tiroideias maternas normalize, as necessidades de iodo continuam aumentadas, já que o leite materno é a única fonte de iodo para a criança.10,15-16
Por outro lado, há evidência de que o excesso de iodo também tem efeitos adversos para a saúde e, como tal, não é aconselhável que se exceda o nível máximo de ingestão tolerável (UL) de iodo (Quadro I).32-35
3. Metabolismo do iodo
Ao longo do trato gastrointestinal, o iodo é absorvido através do transportador membranar sodium-iodide symporter (NIS), que existe nos tecidos com capacidade de captar iodo.8,10,34 Posteriormente, este nutriente passa para a circulação sanguínea, sendo distribuído até aos tecidos onde será utilizado.10 Ao nível da tiroide, a produção hormonal só é possível após a captação de iodo através do NIS, a sua transferência para o coloide e posterior oxidação.10
O principal regulador da atividade do NIS é a thyroid stimulating hormone (TSH).10,36 De facto, a ligação da TSH aos seus recetores (TSH-R) nas células foliculares estimula a expressão do NIS e o incremento da sua semivida, aumentando a captação de iodo pelas células foliculares.10,12 Este mecanismo permite obter níveis intratiroideus de iodo 20-40 vezes superiores aos do plasma sanguíneo.10,12 Assim, 80% dos 15-20mg de iodo contidos no organismo de um adulto saudável encontram-se na glândula tiroideia.4,9,12
Em condições fisiológicas existe uma produção diária de 110nmol/L de T4, o que corresponde a 90% das hormonas tiroideias segregadas.10,36 Por sua vez, 10% das hormonas são segregadas sob a forma de T3 e é ainda libertada uma fração muito reduzida de rT3.10,36 Ao nível dos tecidos extratiroideus ocorre conversão da T4 em T3 e rT3, por intermédio de enzimas desiodinases tipo D1 e D2 e controlada pela TSH.1,10,36 Cerca de 80% da T3 em circulação resulta desses mecanismos de desiodação periférica.10,36
As hormonas segregadas pela tiroide circulam no plasma maioritariamente ligadas a proteínas, das quais se destaca a thyroxine-binding globulin (TBG),10,36 a qual apresenta maior afinidade de ligação e cuja quantidade sérica é influenciada por vários fatores.36 Por exemplo, a gravidez associa-se a um aumento dos níveis de TBG e, consequentemente, a um aumento da concentração total de T3 e de T4.10,13 Contudo, são as formas livres das hormonas tiroideias que exercem os efeitos metabólicos nos tecidos-alvo, através da ligação a recetores nucleares (TR).13
Depois de exercerem os seus efeitos, as hormonas tiroideias sofrem ação das desiodinases presentes nos tecidos e, em seguida, são metabolizadas pelo fígado, sendo excretadas nas fezes.4 O iodo resultante da desiodação pode ser reutilizado ou excretado na urina.1,4,8-9
3.1. Impacto do iodo no desenvolvimento neurocognitivo
A carência de iodo durante a gravidez é considerada a principal causa prevenível de atraso mental congénito no mundo.3-4,9,12,14 De facto, o espectro de lesões neurológicas associadas ao défice de iodo varia desde o cretinismo (que pode afetar 5-15% da população em contextos de défice grave) até à incapacidade em atingir o quociente de inteligência (QI) potencial, que pode ser até 13,5 pontos inferior (quando o iodo é ligeira ou moderadamente insuficiente).1,8-9,15,24
O cretinismo é uma forma grave de hipotiroidismo, de natureza congénita, que se associa lesões permanentes do SNC com atraso mental, surdo-mutismo, estrabismo, diplegia espástica, parestesias dos membros inferiores, alteração da marcha, atraso pubertário, atraso da maturação óssea e de crescimento, baixa estatura e infertilidade.3,6-7,14,29
Vários estudos demonstram o impacto do défice ligeiro/moderado de iodo durante a gravidez, assim como os benefícios provenientes da suplementação:1,4,14,17-18,37-39
Galan documentou uma diminuição do desenvolvimento psicointelectual em crianças com três anos de idade, filhas de mães cuja mediana da concentração urinária de iodo (mUIC) era < 100μg/L às 12 semanas de gestação.37
Num estudo observacional, publicado em 2013 no Reino Unido, avaliou-se a performance cognitiva de 1.040 crianças com oito anos de idade, filhas de grávidas que foram retrospetivamente divididas em duas categorias consoante a mUIC materna: < 150μg/L (carenciadas em iodo) e > 150μg/L (não-carenciadas).17 Após ajuste dos resultados para 21 fatores potencialmente confundidores, os autores sugerem que o défice ligeiro/moderado de iodo durante o 1º trimestre de gravidez associa-se a um aumento do risco da criança ter um QI no quartil mais baixo, com impacto negativo sobretudo em termos do QI verbal.17
Velasco demonstrou que crianças entre os três e os 18 meses, cujas mães foram suplementadas com 300μg de iodo/dia durante o 1º trimestre da gravidez, tinham melhores pontuações na Psychomotor Developmental Index e na Behavior Rating Scale do que crianças de mães não-suplementadas.38
Embora a generalidade dos estudos seja concordante, uma minoria deles não refere diferenças no desenvolvimento cognitivo das crianças conforme o aporte iodado materno. Isto pode ser explicado por diferenças metodológicas no que diz respeito ao tipo de estudo, ao tamanho amostral, aos testes usados para a avaliação das crianças e à idade em que foi feita esta avaliação.4,23
4. Métodos de avaliação do aporte de iodo
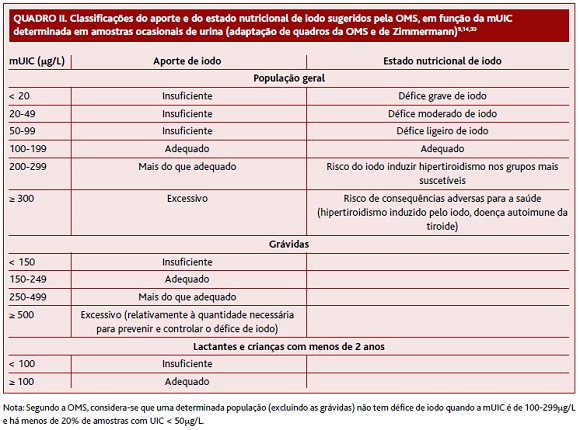
Têm sido vários os métodos utilizados para aferir o aporte de iodo nos indivíduos e populações: avaliação das dimensões da tiroide; doseamento da concentração urinária de iodo (UIC); doseamento da TSH; e doseamento da tiroglobulina (Tg).8 A OMS recomenda o doseamento da UIC para a avaliação do aporte de iodo numa população (Quadro II).9,14,33
4.1 Avaliação das dimensões da tiroide
O bócio é um sinal clássico do défice crónico de iodo.9-10 Portanto, como o aumento do volume tiroideu pode ser avaliado clínica e ecograficamente, a prevalência de bócio era utilizada para avaliar o balanço nutricional de iodo nas populações, em termos crónicos.8,14,20 Atualmente são utilizados marcadores mais objetivos do aporte de iodo, em detrimento deste método.20
4.2 Doseamento da UIC
Mais de 90% do iodo ingerido é excretado na urina. Logo, o doseamento do iodo urinário é um indicador sensível do aporte a curto prazo (dias).6-9,11,14,34 O iodo urinário pode ser expresso através da UIC de uma amostra ocasional (em μg/L), através da UIC de uma amostra de 24 horas (em μg/dia) ou em relação à creatinina (em μg/g creatinina; embora este método seja dispendioso e impreciso).8,14
Para avaliar o aporte de iodo de uma população por meio da UIC determinada numa amostra ocasional: deve incluir-se na investigação pelo menos 30 participantes representativos da população; deve colher-se uma amostra ocasional de urina de cada participante; a medida de tendência central usada para representar o estado nutricional de iodo deve ser a mediana das UICs, já que geralmente os valores das UICs da população não seguem uma distribuição normal.14
A excreção urinária de iodo de um indivíduo varia diariamente. Contudo, as condições referidas permitem atenuar o efeito desta variação.14 Assim, este indicador não reflete fielmente o aporte individual de iodo, mas a mUIC permite avaliar a adequação do aporte numa população.4,8,14,16 Além disso, este método é barato, pouco invasivo e facilmente executável.14
Por sua vez, a UIC de uma amostra de urina de 24 horas é o parâmetro com maior acuidade para avaliar o aporte individual de iodo, já que se associa a menor variabilidade da excreção urinária de iodo.8-9 Todavia, é difícil obter colheitas completas de urina de 24 horas e estas não são necessárias para o estudo das populações.9,14
A UIC é frequentemente estudada em crianças de idade escolar, já que se assume que estas têm um aporte de iodo representativo da população geral e a realização das colheitas é mais acessível neste grupo.11 Contudo, as necessidades de iodo variam consoante a idade, estado de gravidez e aleitamento e, portanto, quando se pretende avaliar o aporte de iodo nas grávidas a extrapolação dos resultados obtidos noutros grupos (como crianças ou mulheres não-grávidas) não é adequada, sendo necessário avaliar especificamente as UICs neste grupo populacional.8,11
4.3 Doseamento da TSH
Quando há défice de iodo, tipicamente a T3 e a TSH aumentam ou permanecem inalteradas e há uma diminuição da T4.9,14 Contudo, estas variações encontram-se geralmente dentro dos valores de referência; portanto, o doseamento da TSH não é recomendado para a monitorização nutricional já que é caro e pouco sensível.8-9,14
No caso dos recém-nascidos, a tiroide tem menor quantidade de iodo, mas tem uma renovação mais elevada deste nutriente, que provoca um aumento da TSH.9 De facto, o doseamento da TSH é um indicador sensível do défice de iodo em recém-nascidos; porém, a dificuldade na interpretação dos seus valores e o custo da sua implementação em programas de rastreio limitam a sua utilização.3,14
4.4 Doseamento da Tg
A Tg é um indicador sensível do aporte de iodo em crianças de idade escolar e parece ser uma alternativa melhor, face às UICs, para estimar o aporte a médio prazo (meses).14 Todavia, este doseamento recorre a um imunoensaio dispendioso e é necessário avaliar a prevalência dos autoanticorpos anti-Tg na população antes de dosear a Tg, de modo a controlar possíveis vieses.8-9
5. Epidemiologia do estado nutricional de iodo
5.1. Em termos mundiais
A colaboração entre organizações internacionais (como IGN, OMS e UNICEF), governos nacionais e profissionais de saúde tem levado a progressos no controlo das IDD, sobretudo nas regiões onde o défice de iodo assumia proporções mais graves.4,12
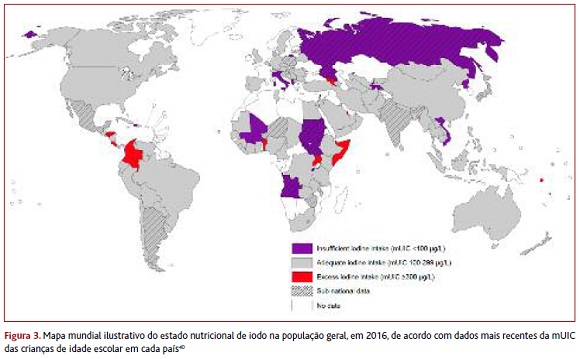
O estado nutricional das populações relativamente ao iodo não é uniforme (Figura 3).4,12,40 Em todo o mundo, 241 milhões de crianças em idade escolar têm défice de iodo, sendo que 76 milhões vivem no Sudeste Asiático e 58 milhões em África.21
Extrapolando estes resultados para a população geral pode dizer-se que 1,92 mil milhões de pessoas têm défice de iodo.30
A carência de iodo é mais marcada nas regiões subdesenvolvidas; contudo, tem ressurgido entre os países desenvolvidos (metade da população europeia tem défice ligeiro/moderado deste nutriente).4,8,11,18 Segundo dados de 2013, havia défice de iodo nas grávidas de nove países europeus (Albânia, Bélgica, República Checa, Grécia, Israel, Noruega, Portugal, Roménia e Sérvia) e esta carência afetava simultaneamente a população geral e as grávidas em cinco países da Europa (França, Hungria, Irlanda, Itália e Reino Unido).4
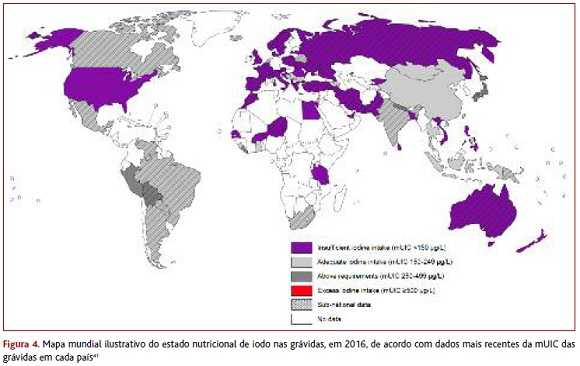
Devido ao aumento das necessidades de iodo durante a gravidez,10,13,15-16 não admira que exista um maior número de países com défice de iodo nas grávidas face ao número de países com défice na população geral (Figura 4).40-41 Além do défice, também o excesso de iodo tem impacto negativo na saúde e o número de países com consumo excessivo de iodo aumentou nos últimos anos.8,32
5.2 Em Portugal
Entre 2009 e 2012 foram publicados cinco estudos cujos resultados alertam para o défice de iodo nas grávidas e lactantes portuguesas.5,15,25-27
Num estudo transversal com 3.631 grávidas, em 17 maternidades de todo o país, constatou-se um défice ligeiro de iodo (mUIC=82,5μg/L),5 mais marcado no interior do país e nos arquipélagos, provavelmente devido ao menor nível socioeconómico e ao consumo reduzido de peixe nessas regiões:5,26 83% das grávidas continentais tinham aporte insuficiente de iodo;5 o défice era mais notório nas grávidas dos arquipélagos (mUIC=60,9μg/L), tendo 92% das madeirenses e 99% das açorianas níveis inadequados de iodo.5,26
Num estudo realizado no Minho avaliou-se o estado nutricional de iodo em 78 mulheres em idade fértil, bem como em 140 grávidas e respetivos filhos: a) as mulheres em idade fértil, grávidas e lactantes apresentavam deficiência de iodo; b) 14% das grávidas tinham bócio; c) o défice materno de iodo acompanhava-se de défice nos seus descendentes; d) aos três meses, as crianças que se alimentavam com leite de fórmula tinham uma mUIC significativamente maior do que as crianças que se alimentavam com leite materno (137 vs 80μg/L).15
Num outro estudo constatou-se que nenhuma das participantes consumia sal iodado, concluindo que as mulheres não reconheciam a importância do sal iodado na dieta.25
Além disto, estudou-se também a UIC de crianças em idade escolar (3.680 crianças de Portugal Continental; 987 dos arquipélagos).26-27 No continente observou-se um aporte de iodo borderline (mUIC=105,5μg/L); porém, 47% das crianças apresentavam défice de iodo.27 O aporte de iodo era significativamente menor nas regiões autónomas: na Madeira, a mUIC foi de 81,3μg/L e, nos Açores, a mUIC foi de 72,7μg/L (respetivamente, 68% e 78% das crianças eram iodocarentes).26
6. Défice de iodo
Quando há défice de iodo ocorre uma diminuição das reservas intratiroideias deste nutriente e um ajuste da produção e uso das hormonas tiroideias, de modo a otimizar o iodo existente:4,9 Verifica-se um aumento da TSH, uma diminuição da T4 sérica e um aumento da produção de T3 relativamente à produção de T4 (já que a primeira requer uma menor quantidade de iodo para a sua produção e é mais ativa biologicamente).4,10 O aumento da TSH estimula a captação e a organificação do iodo, a produção de Tg e peroxidase tiroideia (TPO), bem com a vascularização tiroideia e a hipertrofia/hiperplasia dos tireócitos (podendo causar bócio).4,9-10
A carência de iodo é uma das causas mais comuns de endocrinopatia no mundo e associa-se a consequências adversas para a saúde, coletivamente designadas por IDD (Quadro III).1,3,7-8,13-14,17
7. Excesso de iodo
Os benefícios da eliminação do défice de iodo parecem ser mais relevantes que os riscos associados ao excesso deste nutriente.8,11,20,32-33 De facto, o aporte excessivo de iodo é raro e, mesmo que aconteça, é relativamente bem tolerado.9 Todavia, a OMS aconselha a evicção de mUICs «excessivas» (≥ 300μg/L para a população em geral e ≥ 500μg/L para grávidas).33
7.1 Bócio e hipotiroidismo
O efeito de Wolff-Chaikoff é um mecanismo de autorregulação que evita a produção excessiva de hormonas tiroideias quando há níveis elevados de iodo:10 o que se verifica é que as altas concentrações de iodo têm efeito inibitório na TPO e na DUOX2, diminuindo a organificação do iodo e a formação de hormonas tiroideias.10 O efeito de Wolff-Chaikoff inicia-se 48 horas após a exposição e dura cerca de 10 dias, seguindo-se normalmente de um «fenómeno de escape».10,42 Neste fenómeno, devido à inibição da expressão do NIS, regista-se uma diminuição da concentração intratiroideia de iodo para níveis em que deixa de se verificar o efeito de Wolff-Chaikoff e, portanto, há uma normalização da organificação e da produção de hormonas tiroideias.10,42
Em alguns indivíduos existe maior suscetibilidade ao efeito de Wolff-Chaikoff e o escape pode não ocorrer, causando bócio e hipotiroidismo induzidos pelo iodo.10,42 Acontece sobretudo em indivíduos com patologia tiroideia, com antecedentes de terapêutica com iodo-131 ou radioterapia externa, com consumo de substâncias bociogénicas (lítio), bem como nos fetos e recém-nascidos (especialmente prematuros, já que o «fenómeno de escape» só se desenvolve completamente no final da gestação).10,32
7.2 Hipertiroidismo induzido pelo iodo (HII)
A OMS recomenda a evicção de mUICs > 200μg/L em populações com défice crónico de iodo em que há um aumento abrupto da ingestão deste nutriente,33 pelo risco de HII - efeito de Jod-Basedow.8,33 Apesar disso, esta patologia desenvolve-se numa minoria dos indivíduos, dependendo quer da quantidade de iodo fornecida quer da duração e gravidade do défice.10
O HII ocorre mais frequentemente quando existem tireócitos com função independente dos níveis de TSH (que podem captar iodo e produzir hormonas tiroideias ad libitum), sobretudo na presença da doença de Graves (nos doentes mais jovens) ou de bócio nodular tóxico (nos doentes mais velhos).10,32
Esta patologia não é uma contraindicação para o tratamento do défice endémico de iodo. Aliás, a incidência do efeito de Jod-Basedow diminui ao longo do tempo após a introdução da profilaxia do défice de iodo e espera-se que esta medida diminua a prevalência de bócio nodular tóxico.9,32
7.3 Tiroidite autoimune
O aporte excessivo de iodo aumenta a incidência de tiroidite autoimune.8,22,32-33 De facto, verifica-se associação com o aumento da incidência de tiroidite de Ha-shimoto e do título de anticorpos antitiroideus.32,43 Além disso, nos indivíduos com títulos elevados de anticorpos antitiroideus, o aumento da ingestão de iodo é fator de risco para o desenvolvimento ou progressão de hipotiroidismo.32,43
7.4 Alteração da proporção dos tipos histológicos de carcinoma da tiroide
O aporte de iodo não parece afetar a incidência de carcinoma tiroideu; porém, associa-se à alteração da proporção de cada tipo histológico.32 A razão carcinoma papilar/carcinoma folicular é superior nas populações com maior aporte de iodo e é possível que, quer a suplementação em áreas com défice prévio de iodo quer o aporte excessivo de iodo, possam levar a um aumento desta razão.32
8. Estratégias de prevenção e correção do défice de iodo
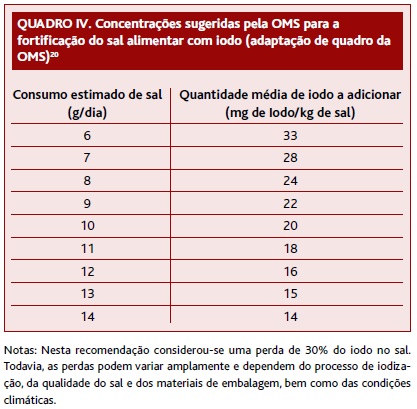
Nos últimos 30 anos várias estratégias foram tentadas para eliminar o défice de iodo, tendo como base a iodização de produtos alimentares.3 A OMS defende que a principal estratégia para resolver este problema é a iodização universal do sal alimentar (Quadro IV), a qual tem permitido importantes progressos no controlo das IDD.20
8.1 Iodização universal do sal alimentar
O sal é o produto alimentar preferido para a iodização pelas seguintes razões:
a) É ubíquo na dieta da população mundial;
b) A sua ingestão é proporcional à ingestão energética global;
c) Em muitos países, a produção de sal é assegurada por poucos centros, facilitando o controlo de qualidade;
d) A tecnologia necessária para a sua iodização está bem definida, é barata e facilmente implementável;
e) A iodização é segura e a aceitabilidade do consumidor é elevada;
f) O iodo não se perde nos alimentos processados que contêm sal;
g) A concentração de iodo no sal pode ser ajustada de modo a não interferir com a redução do consumo de sal preconizada para a prevenção de doenças cardiovasculares (< 5g de sal/dia; < 2g de sódio/dia).20
Como a designação indica, a iodização universal do sal alimentar exige a fortificação de todo o sal alimentar. Porém, na prática, a implementação desta medida focou-se apenas no «sal de mesa».20 Nas populações com um estilo de vida urbano, mais de 80% do sal consumido provém de alimentos processados, nos quais o sal iodado não é geralmente usado e, por esse motivo, o aporte de iodo da população pode ser insuficiente.11,20 Assim, é necessário alargar a iodização a todo o sal alimentar e estabelecer legislação, para produtores e distribuidores, acerca do teor de sal nos produtos alimentares e da iodização adequada do sal.20
A monitorização e melhoria da qualidade do sal iodado é essencial para garantir a eficácia e a segurança da intervenção.11,20 Cada país deve determinar as perdas de iodo que ocorrem nas condições locais de produção, embalamento e armazenamento do sal alimentar.20 Além disso, os programas de fortificação devem ser adequados à cultura das populações-alvo para que a intervenção seja bem aceite e sustentada.20 Em alguns países, a iodização do sal pode ser inviável, sendo necessário fortificar outros alimentos.20
Em 2012, a iodização do sal alimentar estava implementada em mais de 120 países e 71% das famílias em todo o mundo tinham acesso ao sal iodado.20 Contudo, segundo dados de 2013, apenas 37 países atingiam uma taxa de iodização de 90% e 39 países tinham uma taxa inferior a 50%.11 Na Figura 5 apresenta-se o tipo de legislação para a iodização do sal, existente em cada país, no ano de 2016.44
Em Portugal, a DGS reconhece que optar pelo sal iodado e comer mais peixe e produtos do mar é a melhor solução para combater as carências de iodo.6 Contudo, ainda há um longo caminho a percorrer (em termos de recomendações, intervenção e monitorização) para garantir o aporte apropriado deste nutriente.6
8.2 Suplementação farmacológica durante a gravidez e amamentação
Tendo em conta que as grávidas e lactantes necessitam de um aporte de iodo na ordem dos 250μg/dia, a maior parte das organizações internacionais (European Thyroid Association, Endocrine Society, ATA, IGN e OMS) recomendam a suplementação iodada das mulheres na preconceção, gravidez e amamentação, exceto aquelas com patologia tiroideia conhecida.22-23 Esta estratégia assegura o aporte adequado de iodo e não se associa a efeitos laterais indesejáveis, pelo que está recomendada pelo menos até que surjam dados que motivem uma decisão diferente.16,18,24
A ATA recomenda a suplementação de iodo, no valor de 150μg/dia, a todas as mulheres norte-americanas grávidas ou a amamentar.18 Esta recomendação baseou-se na constatação de que, apesar da mUIC das grávidas norte-americanas ser adequada (173μg/L), os intervalos de confiança a 95% para os valores de UIC variavam entre 75 e 229μg/L.18
Apesar desta recomendação, um estudo realizado em 2015, nos EUA, constatou que a prevalência da suplementação iodada na gravidez é de apenas 47%.45 Além disso, 49% dos suplementos vitamínicos pré-natais comercializados nos EUA não contêm iodo e, embora 89% dos suplementos rotule que permite um aporte de iodo ≥ 150μg/dia, o seu teor de iodo é extremamente variável (33-610μg/dia).31
À semelhança de várias organizações internacionais, em agosto de 2013, a DGS publicou uma orientação aconselhando a suplementação com iodo sob a forma de iodeto de potássio (KI) na dose de 150-200μg/dia, em mulheres na preconceção, gravidez e amamentação,46 fundamentando-se nos resultados dos estudos da UIC em grávidas portuguesas.5,15,25-26
A DGS delegou a avaliação do impacto desta orientação, a ser realizada dois anos após a sua publicação, à Sociedade Portuguesa de Endocrinologia, Diabetes e Metabolismo.46 Contudo, já se ultrapassou este período e ainda não existem dados dessa avaliação, que poderiam ser importantes para a melhor orientação das grávidas portuguesas no que diz respeito à suplementação de iodo.
9. Iodo e função tiroideia na gravidez
9.1 Função tiroideia na gravidez
Durante a gravidez regista-se um aumento das necessidades de hormonas tiroideias causado por três eventos: o aumento progressivo da TBG, por influência do hiper-estrogenismo; a estimulação direta da tiroide, pelas elevadas concentrações de gonadotrofina coriónica humana (hCG); e as alterações no metabolismo periférico das hormonas tiroideias maternas, sobretudo a nível placentário.47-48 Contudo, estas adaptações decorrem harmoniosamente se o aporte de iodo for adequado.48
O estado de hiperestrogenismo condiciona uma maior glicação da TBG, resultando no aumento da síntese hepática e diminuição da depuração desta proteína.4,13 Assim, a concentração da TBG aumenta gradualmente durante a primeira metade da gravidez, atingindo valores 1,5-2,5 vezes superiores aos basais, que mantém até ao final da gestação.1,13,48
Este incremento da TBG, juntamente com o incremento do volume plasmático, condiciona o aumento progressivo da T3 e T4 totais durante a primeira metade da gravidez, atingindo um planalto às 20 semanas, com valores 30-100% superiores aos basais.10,13 Como a TBG tem uma afinidade 20 vezes maior para a T4 do que para a T3, o aumento da T4 total tem um maior paralelismo com o aumento da TBG.13
Simultaneamente regista-se uma redução de 10-15% na concentração das frações livres, em virtude do aumento da TBG.13 Assim, é necessário aumentar a produção hormonal para suplantar a ligação da TBG e manter o nível normal de hormonas livres.1,13 Neste sentido, há um aumento moderado da TSH (permanecendo dentro dos limites de referência) que estimula a síntese hormonal, para a qual é importante ter reservas intratiroideias e um aporte de iodo adequados.13,48
O segundo evento deve-se ao aumento da produção de hCG pela placenta até ao final do 1º trimestre da gravidez, ao qual se sucede uma diminuição progressiva da produção.49 Dada a semelhança estrutural desta hormona com a TSH (mesma subunidade α, mas subunidade β específica), a hCG atua como um agonista fraco dos TSH-R dos tireócitos.4,10,49 Assim, no final do 1º trimestre regista-se um aumento ligeiro e transitório da T4 livre (FT4), acompanhado por uma supressão parcial da TSH.10,13,48 Posteriormente, ocorre um decréscimo das hormonas tiroideias livres (e um aumento moderado da TSH).10,13,48
O terceiro evento relaciona-se com as alterações no metabolismo periférico das hormonas tiroideias maternas que, embora ocorram durante toda gestação, têm maior relevância durante a segunda metade da gravidez.48 A placenta possui desiodinases tipo D2 e D3, cuja ação é fundamental na manutenção de níveis locais adequados de T3 e na regulação do influxo de hormonas tiroideias biologicamente ativas para o feto.4 A D2 é responsável por manter a produção de T3 quando há diminuição T4 de origem materna, ao passo que a expressão de D3 na unidade fetoplacentária contribui para o aumento das necessidades hormonais, já que esta enzima catalisa a inativação de T3 e de T4.10,48
Como consequência do hiperfuncionamento tiroideu regista-se um aumento da vascularização e hiperplasia glandular, conduzindo a um ligeiro aumento do tamanho da tiroide.50 Quando o aporte de iodo é adequado, o volume tiroideu e a Tg permanecem estáveis.50-52 Além disso, a concentração das hormonas tiroideias e da TSH deverá ser sempre fisiológica, exceto no curto período de tempo em que a TSH está suprimida devido ao efeito da hCG.50-52
No caso do feto, a concentração sérica de TSH e T4 é baixa até que, por volta das 24-28 semanas, ocorre um pico de TSH e a T4 começa a aumentar progressivamente.50 Durante a gravidez, a concentração da TSH fetal é maior do que a concentração esperada em adultos com função tiroideia normal e, na altura do nascimento, a tiroide fetal liberta abruptamente T3 e T4, criando um estado hipertiroideu que facilita os ajustes termorregulatórios para a vida extrauterina.10,50
9.2 Aporte de iodo e função tiroideia na gravidez
O estado das reservas de iodo e a função tiroideia maternos devem ser adequados desde o período preconcecional.53 Quando acontece, tipicamente as mulheres mantêm reservas intratiroideias de iodo apropriadas (10-20mg) e são capazes de suprir as necessidades da gestação.1,48,53 Contudo, quando se regista um défice de iodo durante a gravidez ocorre uma estimulação tiroideia excessiva que condiciona alterações patológicas.51 Habitualmente, nesta situação, as reservas intratiroideias de iodo estão diminuídas desde a preconceção e são rapidamente depletadas pela gravidez, podendo desencadear hipotiroidismo e bócio.8,48 Assim, uma UIC baixa sugere maior risco de patologia tiroideia e, quanto mais grave for o défice de iodo, mais marcadas e frequentes serão as suas repercussões.3,8,48
Mesmo que ligeiro, o défice de iodo na grávida cursa com diminuição da UIC e hipotiroxinemia.4,8,13,48,51-52 A hipotiroxinemia causa estimulação tiroideia excessiva, que se traduz por: aumento da TSH, por mecanismos de retroregulação; aumento da Tg sérica; aumento do volume tiroideu (e, eventualmente, bócio materno e fetal); e secreção preferencial de T3 a nível tiroideu (evidenciada pelo aumento da razão T3/T4 sérica).4,8,13,48,51-52,54 Caso o aporte de iodo permaneça deficitário, a estimulação tiroideia excessiva e as alterações decorrentes persistem ao longo da gestação.48
O aumento da TSH é progressivo até ao final da gravidez (atinge-se o dobro do valor basal) e geralmente reverte para os valores pré-gestacionais aos seis meses pós-parto.13,51,54 Tipicamente a hipotiroxinemia não se acompanha por hipotiroidismo, já que a T3 circulante está normal ou aumentada, prevenindo um aumento da TSH acima do limite da normalidade.55 Contudo, pode desenvolver-se hipotiroidismo, sobretudo nas mulheres predispostas para doença tiroideia e em regiões com défice grave de iodo.13
A formação de bócio gestacional pode ser explicada por fatores como o défice de iodo, o tabagismo e as gestações sucessivas.8,54 Em regiões de aporte adequado de iodo, o aumento médio do volume tiroideu é mínimo (10-15% do volume preconcecional).54 Contudo, quando ocorre um défice deste nutriente, o volume tiroideu aumenta em média 20-35% durante a gravidez e o bócio gestacional parece ser apenas parcialmente reversível no pós-parto.48,54
O aumento da TSH e da Tg referido na grávida está amplificado nos recém-nascidos;54 o que enfatiza a hipersensibilidade da tiroide fetal ao défice de iodo materno (a tiroide fetal tem baixas reservas de iodo, com uma renovação rápida) e sugere que a formação de bócio na descendência se inicia nos estádios iniciais do desenvolvimento da tiroide fetal.54 Contudo, ao contrário das grávidas com défice de iodo, os seus recém-nascidos não têm elevação da TBG nem hipotiroxinemia.51
9.2.1. Suplementação de iodo e função tiroideia na gravidez
Mesmo que a mUIC nas grávidas de uma população indique um aporte adequado de iodo, não garante que não existam grávidas com aporte insuficiente.18,56 Assim, a suplementação parece ser necessária, embora se permanecer atento ao risco de induzir aporte excessivo de iodo.18
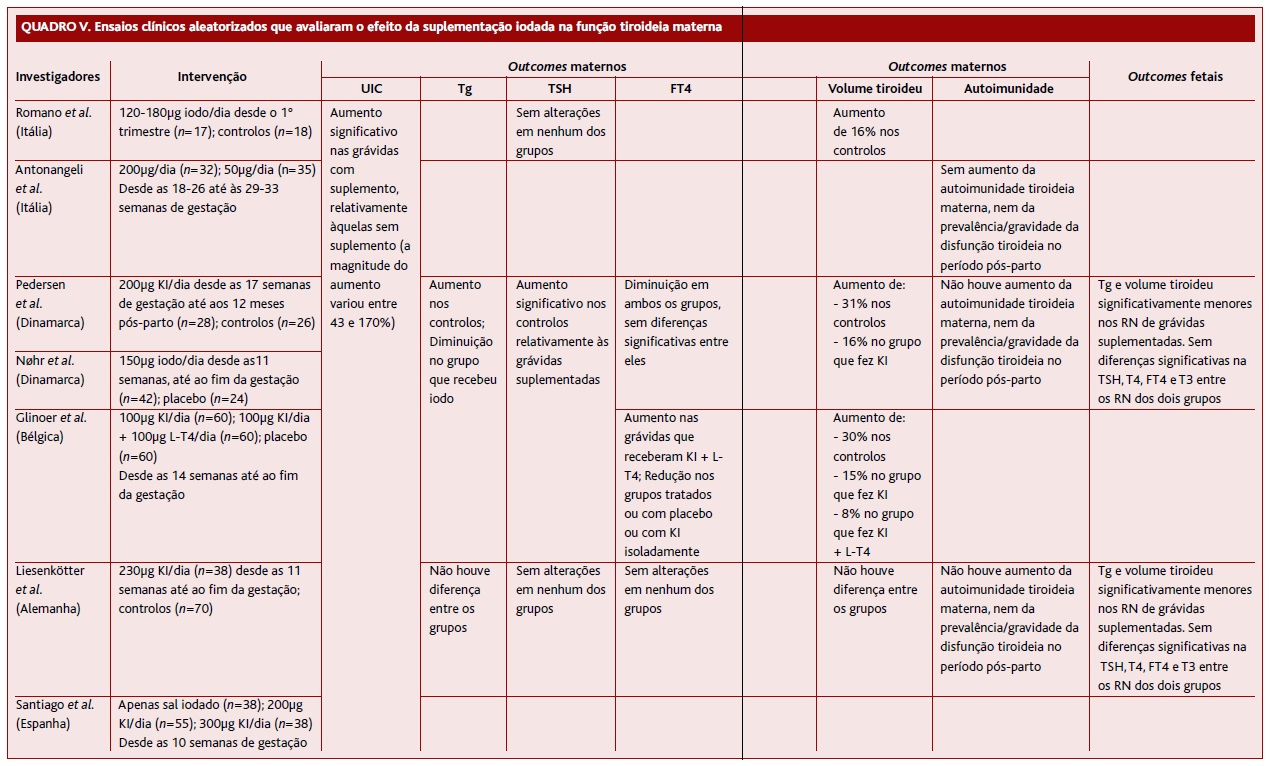
Cada vez mais se comprovam benefícios, para a saúde e para a economia, em proceder à suplementação para corrigir o défice de iodo durante a gravidez.24 Todavia, os ensaios clínicos aleatorizados (ECAs) que avaliaram o efeito da suplementação iodada na função tiroideia materna são escassos e foram conduzidos em países europeus, com défice ligeiro/moderado de iodo durante a gravidez (mUIC entre 36 e 109µg/L).24 Nestes sete ensaios, cujos principais achados são apresentados no Quadro V, foram incluídas um total de 641 grávidas e a dose de iodo usada para suplementação variou entre 0 e 300µg/dia:
(clique para ampliar ! click to enlarge)
Em Itália realizaram-se dois ensaios. Romano aleatorizou 35 grávidas saudáveis como controlos (n=18, mUIC=31μg/L) ou para receberem 120-180µg de iodo/dia, sob a forma de sal iodado iniciado no 1º trimestre (n=17, mUIC=37µg/L).57 Antonangeli suplementou 67 grávidas (mUIC=74mg iodo/g creatinina) com 50 ou 200µg de iodo/dia, desde as 18-26 até às 29-33 semanas de gestação.58
Na Dinamarca, Pedersen aleatorizou 54 grávidas como controlos ou para receberem 200µg de iodo/dia sob a forma de KI, desde as 17 semanas de gestação até 12 meses após o parto.59 Num estudo duplamente cego com placebo, Nøhr aleatorizou 66 grávidas anti-TPO+ como controlos ou para receberem 150µg de iodo/dia, desde as 11 semanas até ao termo da gestação.60
Noutro estudo duplamente cego com placebo, Glinoer aleatorizou 180 grávidas belgas (mUIC=36µg/L) para tratamento com placebo ou 100µg de KI/dia ou 100µg de KI/dia, juntamente com 100µg de levotiroxina/dia, a partir das 14 semanas até ao termo da gestação.52
Na Alemanha, Liesenkötter desenvolveu um ensaio controlado, quase-randomizado, com 230µg de iodo/dia desde as 11 semanas até ao termo da gestação (n=108, mUIC=53mg iodo/g creatinina).61
Santiago distribuiu aleatoriamente 131 grávidas espanholas por três grupos de intervenção, desde as 10 semanas de gestação: consumo de sal iodado; consumo de 200µg de KI/dia; consumo de 300µg de KI/dia.62
Em virtude dos diferentes desenhos de estudo é difícil comparar os resultados destes ECAs. Ainda assim, em seguida apresenta-se uma análise sumária dos resultados obtidos quanto aos parâmetros tiroideus maternos:
UIC - Aumentou significativamente nas grávidas suplementadas, face às não-suplementadas (a magnitude do aumento variou entre 43 e 170%).52,57,59-61 Nas mulheres não-suplementadas, a UIC permaneceu estável ou diminuiu, exceto no estudo realizado por Romano, em que a UIC aumentou (aumento esse significativamente inferior ao verificado nas grávidas suplementadas).57
Tg - Quatro ECAs compararam a concentração da Tg em grávidas suplementadas e não-suplementadas.52,59-61 Três mostraram um aumento dos níveis de Tg nas grávidas não-suplementadas e uma diminuição nas suplementadas.52,59-60
TSH - Cinco ECAs compararam a TSH em grávidas suplementadas e não-suplementadas e os resultados foram inconsistentes.52,57,59-61 Três ECAs mostraram um aumento nos níveis de TSH (dentro dos limites de referência) nas grávidas não-suplementadas, o qual não se verificou nas suplementadas.52,59-60 Nos outros dois ECAs, a TSH não aumentou em nenhum dos grupos.57,61 Antonangeli e Santiago não detetaram diferenças nas concentrações da TSH das grávidas consoante as doses usadas na suplementação.58,62
FT4 - Dois ECAs mostraram uma diminuição da FT4 no grupo tratado e no grupo controlo, sem diferenças significativas entre eles.59-60 Noutros dois ECAs, a concentração da FT4 manteve-se inalterada em ambos os grupos.58,61 Glinoer observou um aumento da FT4 nas grávidas que receberam KI juntamente com levotiroxina, bem como uma redução da FT4 nos grupos que fizeram placebo ou KI isoladamente.52
Volume tiroideu - Três ECAs demonstraram um aumento médio do volume entre 16-30% nas grávidas não-suplementadas, enquanto nas grávidas suplementadas o aumento foi inferior (3-16%).52,57,59 No estudo de Liesenkötter não se verificaram diferenças entre os grupos.61 Também não houve diferenças entre os grupos nos ensaios que comparam diferentes doses ou diferentes tipos de suplementação.58,62
Além disto, quatro ECAs apresentaram resultados sobre a função tiroideia dos recém-nascidos.52,59,61-62 A Tg e o volume tiroideu eram significativamente menores nos recém-nascidos das grávidas suplementadas.52,59,61 Não foram encontradas diferenças significativas na TSH, T4, FT4 e T3 entre os recém-nascidos das grávidas suplementadas e não-suplementadas.52,59,61 O estudo de Santiago não encontrou qualquer diferença nos parâmetros tiroideus neonatais entre os recém-nascidos das grávidas que tomaram suplementos ou sal iodizado.62
Um estudo observacional, de 2014, avaliou o impacto de diferentes níveis de aporte de iodo pelas grávidas na função tiroideia dos recém-nascidos.56 Este estudo indica-nos que as grávidas com um aporte excessivo têm um risco 2,6 vezes superior de ter recém-nascidos com baixos níveis de TSH e 4,9 vezes superior de ter um recém-nascido hipertiroideu, riscos que continuam a ser significativos após a exclusão de fatores confundidores.56
Face aos resultados dos ECAs, não parece haver uma relação dose-resposta clara entre a suplementação iodada durante a gravidez e os parâmetros tiroideus. Contudo, a suplementação parece ser segura e é eficaz na correção do défice de iodo, o que previne os aumentos da Tg e do volume tiroideu maternos e fetais.16,18,24 Finalmente, a suplementação parece ter um efeito benéfico menos consistente na TSH materna e não parece ter impacto na concentração das hormonas tiroideias, maternas ou do recém-nascido.8
Em estudos observacionais, a suplementação de iodo durante a gravidez também tem sido associada a resultados díspares na TSH e hormonas tiroideias maternas. Alguns estudos não encontraram qualquer correlação entre a UIC e parâmetros tiroideus maternos (TSH, T4, T3, FT4 e anticorpos anti-TPO) ao longo da gestação.47,63 Noutros, a suplementação associou-se a: redução moderada na TSH e aumento ligeiro da FT4;39 ou aumento moderado na TSH, sem alterações significativas nas concentrações de FT4;64 ou redução na percentagem de grávidas com hipotiroxinemia.65 Finalmente, segundo Brucker-Davis, os valores da TSH e do volume tiroideu apresentam uma «curva em U» de acordo com o aporte de iodo (verificam-se maiores valores no caso de aporte insuficiente ou excessivo de iodo).66
Quando se regista défice crónico de iodo, é difícil de alcançar um estado nutricional adequado deste nutriente durante a gestação.48 Nestes casos, decorre o período de latência de um trimestre até que os benefícios da suplementação na função tiroideia sejam evidentes.54 O estado nutricional deficitário, prolongado, é o principal determinante da quantidade de reservas intratiroideias de iodo e, assim, o ideal será promover um aporte adequado de iodo previamente à gravidez.48
Neste sentido, o consumo de sal iodado previamente à gravidez parece ter um efeito benéfico adicional na redução do risco de disfunção tiroideia durante a gestação, face à suplementação iniciada apenas na gravidez.8 Além disso, um atraso no início da suplementação de iodo durante a gestação aumenta o risco de atraso do neurodesenvolvimento na descendência.39 Face a estes factos, Moleti recomenda que as mulheres que ponderem engravidar devem ser suplementadas com iodo desde vários meses antes da gravidez.65 Tendo em conta o grande número de gestações não planeadas, este facto contribuiria para a aquisição de reservas intratiroideias de iodo adequadas e evitaria os efeitos adversos do défice de iodo na mulher e no feto.65
9.3 Aporte de iodo e autoimunidade tiroideia na gravidez
Os estudos apresentam resultados contraditórios. Guan verificou associação significativa entre um elevado aporte de iodo e um aumento da prevalência de autoanticorpos anti-TPO e de tiroidite pós-parto.67 Além disso, verificou-se um aumento da prevalência de autoanticorpos anti-TPO e anti-Tg cinco anos após a implementação do sal iodado na Dinamarca, sobretudo em mulheres jovens.68 Por outro lado, num estudo japonês, o elevado aporte de iodo não parecia aumentar a prevalência de autoanticorpos anti-Tg.47
Quatro ECAs avaliaram o efeito da suplementação iodada na autoimunidade tiroideia, não tendo constatado qualquer aumento da autoimunidade tiroideia materna nem da prevalência ou gravidade de disfunção tiroideia no período pós-parto.58-61 Contudo, esta ausência de diferenças significativas pode relacionar-se com os pequenos tamanhos amostrais destes ECAs e, portanto, é necessária mais investigação nesta área.24
Conclusão
Existe um desconhecimento acerca do iodo, das suas fontes alimentares, das funções no organismo e dos riscos/benefícios do aporte deste nutriente.25,69 Por este motivo, é importante desenvolver projetos educativos para informar a população geral e, particularmente as grávidas, acerca deste tema.18
Os médicos devem incentivar a adoção de uma dieta variada, incluindo boas fontes de iodo.46 Contudo, deve considerar-se que o elevado custo de alguns alimentos ricos em iodo pode diminuir o seu consumo.70 Potencialmente, o défice de iodo poderia resolver-se através de mecanismos que tornassem os solos «suficientes em iodo». Isto enriqueceria o teor de iodo em vários alimentos consumidos no quotidiano e, portanto, uma alimentação diversificada possibilitaria um aporte adequado deste nutriente.
O progresso no controlo das IDD fomenta o desenvolvimento económico, social e da saúde, contribuindo para alcançar alguns dos Objetivos de Desenvolvimento do Milénio.8-9 Assim, o estado nutricional de iodo deve ser monitorizado regularmente em todos os países, permitindo detetar e corrigir situações de aporte inapropriado nos vários grupos populacionais.21
Durante a gestação, o défice de iodo prejudica a função tiroideia materna e o neurodesenvolvimento fetal.1 A suplementação iodada deve ser sistematicamente recomendada desde o período preconcecional, já que parece prevenir o défice de iodo, a estimulação tiroideia excessiva e o prejuízo do desenvolvimento neurocognitivo.1,24
Fundamentando-se nos resultados dos estudos da UIC em grávidas portuguesas,5,15,25-26 a DGS publicou uma norma de orientação em que aconselha a suplementação com iodeto de potássio na dose de 150-200μg/dia em mulheres na preconceção, gravidez e amamentação.46 Contudo, esta suplementação poderá estar longe de ser rotineira em Portugal. Assim, é necessário: aconselhar as grávidas a realizarem a suplementação; avaliar a prevalência desta suplementação; e fiscalizar a quantidade de iodo realmente contida nos suplementos pré-natais para garantir uma suplementação segura e eficaz.
A decisão de suplementar uma grávida com base nos seus parâmetros individuais, em detrimento de uma decisão guiada pelos resultados de estudos populacionais (que não refletem o panorama individual de cada grávida), seria mais adequada; contudo, comportaria estudos diagnósticos potencialmente caros e complexos.
Em suma, é necessária investigação metodologicamente robusta (sobretudo ensaios clínicos controlados e aleatorizados com grandes dimensões amostrais) para clarificar e quantificar o impacto do aporte de iodo na função tiroideia durante a gravidez, bem como os riscos e benefícios da suplementação iodada. Através dos resultados obtidos poder-se-ão definir medidas de saúde pública que permitam otimizar a função tiroideia da grávida e o neurodesenvolvimento fetal.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Yarrington C, Pearce EN. Iodine and pregnancy. J Thyroid Res. 2011;2011:934104. [ Links ]
2. Delgado I, Coelho I, Andrade P, Antunes C, Castanheira I, Calhau MA. Quantificação de iodo em alimentos consumidos em Portugal: resultados preliminares [Iodine quantification in food consumed in Portugal: preliminary results]. Observações Bol Epidemiol. 2016;(7):30-2. Portuguese
3. Doggui R, El Atia J. Iodine deficiency: physiological, clinical and epidemiological features, and pre-analytical considerations. Ann Endocrinol. 2015;76(1):59-66. [ Links ]
4. Lazarus JH. The importance of iodine in public health. Environ Geochem Health. 2015;37(4):605-18. [ Links ]
5. Limbert E, Prazeres S, São Pedro M, Madureira D, Miranda A, Ribeiro M, et al. Iodine intake in Portuguese pregnant women: results of a countrywide study. Eur J Endocrinol. 2010;163(4):631-5. [ Links ]
6. Teixeira D, Calhau C, Pestana D, Vicente L, Graça P. Iodo: importância para a saúde e o papel da alimentação. Lisboa: Direção-Geral da Saúde; 2014. [ Links ] ISBN 9789726752226
7. Zimmermann MB. The role of iodine in human growth and development. Semin Cell Dev Biol. 2011;22(6):645-52. [ Links ]
8. Zimmermann MB. Iodine deficiency. Endocr Rev. 2009;30(4):376-408. [ Links ]
9. Zimmermann MB, Jooste PL, Pandav CS. Iodine-deficiency disorders. Lancet. 2008;372(9645):1251-62. [ Links ]
10. Melmed S, Polonsky KS, Larsen PR, Kronenberg HM. Williams textbook of endocrinology. 12th ed. Philadelphia: Saunders/Elsevier; 2011. [ Links ] ISBN 9781437703245
11. Pearce EN, Andersson M, Zimmermann MB. Global iodine nutrition: where do we stand in 2013? Thyroid. 2013;23(5):523-8. [ Links ]
12. Patrick L. Iodine: deficiency and therapeutic considerations. Altern Med Rev. 2008;13(2):116-27. [ Links ]
13. Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev. 1997;18(3):404-33. [ Links ]
14. World Health Organization. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 3rd ed. Geneva: WHO; 2007. [ Links ] ISBN 9789241595827
15. Costeira MJ, Oliveira P, Ares S, de Escobar GM, Palha JA. Iodine status of pregnant women and their progeny in the Minho Region of Portugal. Thyroid. 2009;19(2):157-63. [ Links ]
16. WHO Secretariat, Andersson M, de Benoist B, Delange F, Zupan J. Prevention and control of iodine deficiency in pregnant and lactating women and in children less than 2-years-old: conclusions and recommendations of the Technical Consultation. Public Health Nutr. 2007;10(12A):1606-11. [ Links ]
17. Bath SC, Steer CD, Golding J, Emmett P, Rayman MP. Effect of inadequate iodine status in UK pregnant women on cognitive outcomes in their children: results from the Avon Longitudinal Study of Parents and Children (ALSPAC). Lancet. 2013;382(9889):331-7. [ Links ]
18. Public Health Committee of the American Thyroid Association, Becker DV, Braverman LE, Delange F, Dunn JT, Franklyn JA, et al. Iodine supplementation for pregnancy and lactation - United States and Canada: recommendations of the American Thyroid Association. Thyroid. 2006;16(10):949-51. [ Links ]
19. Williams GR. Neurodevelopmental and neurophysiological actions of thyroid hormone. J Neuroendocrinol. 2008;20(6):784-94. [ Links ]
20. World Health Organization. Fortification of food-grade salt with iodine for the prevention and control of iodine deficiency disorders: guideline. Geneva: WHO; 2014. [ Links ] ISBN 9789241507929
21. Andersson M, Karumbunathan V, Zimmermann MB. Global iodine status in 2011 and trends over the past decade. J Nutr. 2012;142(4):744-50. [ Links ]
22. Santana Lopes M, Jácome de Castro J, Marcelino M, Oliveira MJ, Carrilho F, Limbert E, et al. Iodo e tiróide: o que o clínico deve saber [Iodine and thyroid: what a clinic should know]. Acta Med Port. 2012;25(3):174-8. Portuguese
23. Limbert E. A propósito do artigo «Suplementação de iodo na pré-concepção, gravidez e amamentação: a recomendação e a medicina baseada na inferência» [Iodine supplementation before conception and during pregnancy and lactation: recommendations and inference-based medicine]. Rev Port Clin Geral. 2014;30(3):203-4. Portuguese
24. Taylor PN, Okosieme OE, Dayan CM, Lazarus JH. Therapy of endocrine disease: impact of iodine supplementation in mild-to-moderate iodine deficiency: systematic review and meta-analysis. Eur J Endocrinol. 2013;170(1):R1-R15. [ Links ]
25. Costeira MJ, Oliveira P, Ares S, Roque S, de Escobar GM, Palha JA. Parameters of thyroid function throughout and after pregnancy in an iodine-deficient population. Thyroid. 2010;20(9):995-1001. [ Links ]
26. Limbert E, Prazeres S, Madureira D, Miranda A, Ribeiro M, Abreu FS, et al. Aporte do iodo nas Regiões Autónomas da Madeira e dos Açores [Iodine intake in the Autonomous Regions of Madeira and Azores]. Rev Port Endocrinol Diab Metab. 2012;7(2):2-7. Portuguese
27. Limbert E, Prazeres S, São Pedro M, Madureira D, Miranda A, Ribeiro M, et al. Aporte do iodo nas crianças das escolas em Portugal [Iodine intake in Portuguese school children]. Acta Med Port. 2012;25(1):29-36. Portuguese
28. Fuge R. Iodine deficiency: an ancient problem in a modern world. Ambio. 2007;36(1):70-2. [ Links ]
29. Morell SF. The great iodine debate [homepage]. Washington: The Weston A. Price Foundation; 2009. Available from: https://www.westonaprice.org/health-topics/modern-diseases/the-great-iodine-debate/ [ Links ]
30. Rohner F, Zimmermann M, Jooste P, Pandav C, Caldwell K, Raghavan R, et al. Biomarkers of nutrition for development: iodine review. J Nutr. 2014;144(8):1322S-42S. [ Links ]
31. Leung AM, Pearce EN, Braverman LE. Iodine content of prenatal multivitamins in the United States. N Engl J Med. 2009;360(9):939-40. [ Links ]
32. Prete A, Paragliola RM, Corsello SM. Iodine supplementation: usage with a grain of salt. Int J Endocrinol. 2015;2015:ID312305. [ Links ]
33. World Health Organization. Urinary iodine concentrations for determining iodine status in populations. Geneva: WHO; 2013. [ Links ]
34. Institute of Medicine. Dietary reference intakes for vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium and zinc. Washington: National Academy Press; 2001. [ Links ] ISBN 0309072905
35. Scientific Committee on Food, Scientific Panel on Dietetic Products Nutrition and Allergies. Tolerable upper intake levels for vitamins and minerals. Parma: European Food Safety Authority; 2006. [ Links ] ISBN 9291990140
36. Boron WF, Boulpaep EL. Medical physiology. 3rd ed. Philadelphia: Elsevier; 2016. [ Links ] ISBN 9781455733286
37. Riaño Galán I, Sánchez Martínez P, Pilar Mosteiro Díaz M, Rivas Crespo MF. Psycho-intellectual development of 3 year-old children with early gestational iodine deficiency. J Pediatr Endocrinol Metab. 2005;18 Suppl 1:1265-72. [ Links ]
38. Velasco I, Carreira M, Santiago P, Muela JA, García-Fuentes E, Sánchez-Muñoz B, et al. Effect of iodine prophylaxis during pregnancy on neurocognitive development of children during the first two years of life. J Clin Endocrinol Metab. 2009;94(9):3234-41. [ Links ]
39. Berbel P, Mestre JL, Santamaría A, Palazón I, Franco A, Graells M, et al. Delayed neurobehavioral development in children born to pregnant women with mild hypothyroxinemia during the first month of gestation: the importance of early iodine supplementation. Thyroid. 2009;19(5):511-9. [ Links ]
40. Iodine Global Network. Global scorecard of iodine nutrition 2016: based on median urinary iodine concentration (mUIC) in school-age children [homepage]. Ontario: IGN; 2016. Available from: http://www.ign.org/cm_data/2016_SAC.pdf [ Links ]
41. Iodine Global Network. Global scorecard of iodine nutrition 2016: based on median urinary iodine concentration (mUIC) in pregnant women [homepage]. Ontario: IGN; 2016. Available from: http://www.ign.org/cm_data/2016_PW.pdf [ Links ]
42. Wémeau JL. Hypothyroidism related to excess iodine. Presse Med. 2002;31(35):1670-5. [ Links ]
43. Li Y, Teng D, Shan Z, Teng X, Guan H, Yu X, et al. Antithyroperoxidase and antithyroglobulin antibodies in a five-year follow-up survey of populations with different iodine intakes. J Clin Endocrinol Metab. 2008;93(5):1751-7. [ Links ]
44. Iodine Global Network. Legislation for salt iodization (June 2016) [homepage]. Ontario: IGN; 2016. Available from: http://www.ign.org/cm_data/Salt11X14.png [ Links ]
45. Stagnaro-Green A, Dogo-Isonaige E, Pearce EN, Spencer C, Gaba ND. Marginal iodine status and high rate of subclinical hypothyroidism in Washington DC women planning conception. Thyroid. 2015;25(10):1151- [ Links ]
46. Direção-Geral da Saúde. Aporte de iodo em mulheres na preconceção, gravidez e amamentação: orientação nº 011/2013, de 26/08/2013. Lisboa: DGS; 2013. [ Links ]
47. Fuse Y, Ohashi T, Yamaguchi S, Yamaguchi M, Shishiba Y, Irie M. Iodine status of pregnant and postpartum Japanese women: effect of iodine intake on maternal and neonatal thyroid function in an iodine-sufficient area. J Clin Endocrinol Metab. 2011;96(12):3846-54. [ Links ]
48. Glinoer D. What happens to the normal thyroid during pregnancy? Thyroid. 1999;9(7):631-5. [ Links ]
49. Leung AM. Thyroid function in pregnancy. J Trace Elem Med Biol. 2012;26:137-40. [ Links ]
50. Feldt-Rasmussen U, Mathiesen ER. Endocrine disorders in pregnancy: physiological and hormonal aspects of pregnancy. Best Prac Res Clin Endocrinol Metab. 2011;25(6):875-84. [ Links ]
51. Glinoer D, Delange F, Laboureur I, de Nayer P, Lejeune B, Kinthaert J, et al. Maternal and neonatal thyroid function at birth in an area of marginally low iodine intake. J Clin Endocrinol Metab. 1992;75(3):800-5. [ Links ]
52. Glinoer D, De Nayer P, Delange F, Lemone M, Toppet V, Spehl M, et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects. J Clin Endocrinol Metab. 1995;80(1):258-69. [ Links ]
53. Pearce EN. Effects of iodine deficiency in pregnancy. J Trace Elem Med Biol. 2012;26(2-3):131-3. [ Links ]
54. Glinoer D. Clinical and biological consequences of iodine deficiency during pregnancy. Endocr Dev. 2007;10:62-85. [ Links ]
55. Suárez Rodríguez M, Azcona San Julián C, Alzina de Aguilar V. Ingesta de yodo durante el embarazo: efectos en la función tiroidea materna y neonatal [Iodine intake during pregnancy: effects on thyroid function in mother and child]. Endocrinol Nutr. 2013;60(7):352-7. Spanish
56. Medici M, Ghassabian A, Visser W, de Muinck Keizer-Schrama SM, Jaddoe VW, Visser WE, et al. Women with high early pregnancy urinary iodine levels have an increased risk of hyperthyroid newborns: the population-based Generation R Study. Clin Endocrinol. 2014;80(4):598-606. [ Links ]
57. Romano R, Jannini EA, Pepe M, Grimaldi A, Olivieri M, Spennati P, et al. The effects of iodoprophylaxis on thyroid size during pregnancy. Am J Obstet Gynecol. 1991;164(2):482-5. [ Links ]
58. Antonangeli L, Maccherini D, Cavaliere R, Di Giulio C, Reinhardt B, Pinchera A, et al. Comparison of two different doses of iodide in the prevention of gestational goiter in marginal iodine deficiency: a longitudinal study. Eur J Endocrinol. 2002;147(1):29-34. [ Links ]
59. Pedersen KM, Laurberg P, Iversen E, Knudsen PR, Gregersen HE, Rasmussen OS, et al. Amelioration of some pregnancy-associated variations in thyroid function by iodine supplementation. J Clin Endocrinol. 1993;77(4):1078-83. [ Links ]
60. Nohr SB, Jorgensen A, Pedersen KM, Laurberg P. Postpartum thyroid dysfunction in pregnant thyroid peroxidase antibody-positive women living in an area with mild to moderate iodine deficiency: is iodine supplementation safe? J Clin Endocrinol Metab. 2000;85(9):3191-8. [ Links ]
61. Liesenkötter KP, Göpel W, Bogner U, Stach B, Grüters A. Earliest prevention of endemic goiter by iodine supplementation during pregnancy. Eur J Endocrinol. 1996;134(4):443-8. [ Links ]
62. Santiago P, Velasco I, Muela JA, Sánchez B, Martínez J, Rodriguez A, et al. Infant neurocognitive development is independent of the use of iodised salt or iodine supplements given during pregnancy. Br J Nutr. 2013;110(5):831-9. [ Links ]
63. Amouzegar A, Khazan M, Hedayati M, Azizi F. An assessment of the iodine status and the correlation between iodine nutrition and thyroid function during pregnancy in an iodine sufficient area. Eur J Clin Nutr. 2014;68(3):397-400. [ Links ]
64. Rebagliato M, Murcia M, Espada M, Alvarez-Pedrerol M, Bolúmar F, Vioque J, et al. Iodine intake and maternal thyroid function during pregnancy. Epidemiology. 2010;21(1):62-9. [ Links ]
65. Moleti M, Di Bella B, Giorgianni G, Mancuso A, De Vivo A, Alibrandi A, et al. Maternal thyroid function in different conditions of iodine nutrition in pregnant women exposed to mild-moderate iodine deficiency: an observational study. Clin Endocrinol. 2011;74(6):762-8. [ Links ]
66. Brucker-Davis F, Ferrari P, Gal J, Berthier F, Fenichel P, Hieronimus S. Iodine status has no impact on thyroid function in early healthy pregnancy. J Thyroid Res. 2012;2012:168764. [ Links ]
67. Guan H, Li C, Li Y, Fan C, Teng Y, Shan Z, et al. High iodine intake is a risk factor of post-partum thyroiditis: result of a survey from Shenyang, China. J Endocrinol Invest. 2005;28(10):876-81. [ Links ]
68. Pedersen IB, Knudsen N, Carlé A, Vejbjerg P, Jørgensen T, Perrild H, et al. A cautious iodization programme bringing iodine intake to a low recommended level is associated with an increase in the prevalence of thyroid autoantibodies in the population. Clin Endocrinol. 2011;75(1):120-6. [ Links ]
69. Charlton K, Yeatman H, Lucas C, Axford S, Gemming L, Houweling F, et al. Poor knowledge and practices related to iodine nutrition during pregnancy and lactation in Australian women: pre- and post-iodine fortification. Nutrients. 2012;4(9):1317-27. [ Links ]
70. Fisher J, Tran T, Biggs B, Tran T, Dwyer T, Casey G, et al. Iodine status in late pregnancy and psychosocial determinants of iodized salt use in rural northern Viet Nam. Bull World Health Organ. 2011;89(11):813-20. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Jaime Luís da Rocha Oliveira
E-mail: jaimelroliveira@gmail.com
https://orcid.org/0000-0002-2424-2392
Conflito de interesses
Os autores declaram não ter quaisquer conflitos de interesse.
Financiamento do estudo
Os autores declaram que o trabalho relatado neste manuscrito não foi objeto de qualquer tipo de financiamento externo.
Recebido em 02-05-2017
Aceite para publicação em 23-06-2018