1. Introdução
Os ecossistemas intertidais estão actualmente sujeitos a uma perda acelerada da biodiversidade e as consequências potenciais para os ecossistemas e bem-estar humano são ainda desconhecidos (Nordlund, 2012). Em países tropicais em desenvolvimento como é o caso de Moçambique, as comunidades costeiras são muito dependentes dos recursos naturais para a sua subsistência e, portanto, tendem a ser bastante vulneráveis a mudanças no ecossistema (Boer e Longamaine, 1996; De La Torre-Castro, 2006; Norte-Campos, Campos e Villarta, 2006; Nordlund, 2011).
Em Pemba, muitas mulheres e crianças que vivem na zona costeira praticam a pesca de recolha de moluscos, como gastrópodes e bivalves, tanto para a sua subsistência alimentar, como para a sua renda (Fernando, 2014).
Por outro lado, a população humana costeira está a crescer rapidamente ao longo da costa Leste Africana colocando os ecossistemas costeiros sob crescente pressão de exploração (Nordlund, 2011). A sobre-exploração desses recursos tem determinado mudanças no ecossistema, tanto ao nível das comunidades biológicas (composição específica e abundância) como nos próprios habitats, podendo levar à diminuição significativa dos stocks de moluscos (Rius, Kaehler, e McQuaid, 2006).
Actualmente muitos estudos sobre a ecologia do intertidal têm sido levados a cabo (De Boer, 1996; Strait et al., 2000; Castilla e Defeo, 2001; Gullstrom et al., 2011; Rius, Kaehler, e McQuaid, 2006; Nordlund, 2012). Contudo, em Moçambique a fauna de invertebrados é ainda pouco conhecida, sendo que a maior parte dos estudos foram realizados na ilha de Inhaca (Barnes et al., 1998).
Uma vez que os moluscos são importantes na renda e nutrição das comunidades costeiras da Cidade de Pemba e por não haver instrumentos normativos que regulam a apanha destes invertebrados no país (Hoguane, 2007), existe a necessidade de caracterizar a diversidade de colecta na zona intertidal das praias de Pemba como forma de contribuir para a gestão e conservação da biodiversidade de invertebrados marinhos, possibilitando simultaneamente a melhoria da renda das comunidades locais.
1.1. Área de Estudo
A Cidade de Pemba situa-se na costa, Norte de Moçambique e é limitada a Este pelo Oceano ĺndico, a Oeste e a Norte pela Baia de Pemba e a Sul pelo Distrito de Mecúfi, através do Posto Administrativo de Murrébuè (Azevedo, 2006). A área municipal apresenta uma superfície de 194 km2 e ocupa uma península que define a Baia de Pemba, a terceira maior do mundo (Azevedo, 2006).
Pemba tem um clima semi-tropical húmido, com inverno seco. As temperaturas variam ligeiramente ao longo do ano devido à localização tropical e proximidade do oceano. A precipitação mostra duas estações durante o ano, a chuvosa de Dezembro a Abril, sendo Março o mês de maior precipitação e a seca de Maio a Novembro, sendo Setembro o mês mais seco (Souto, 2014).
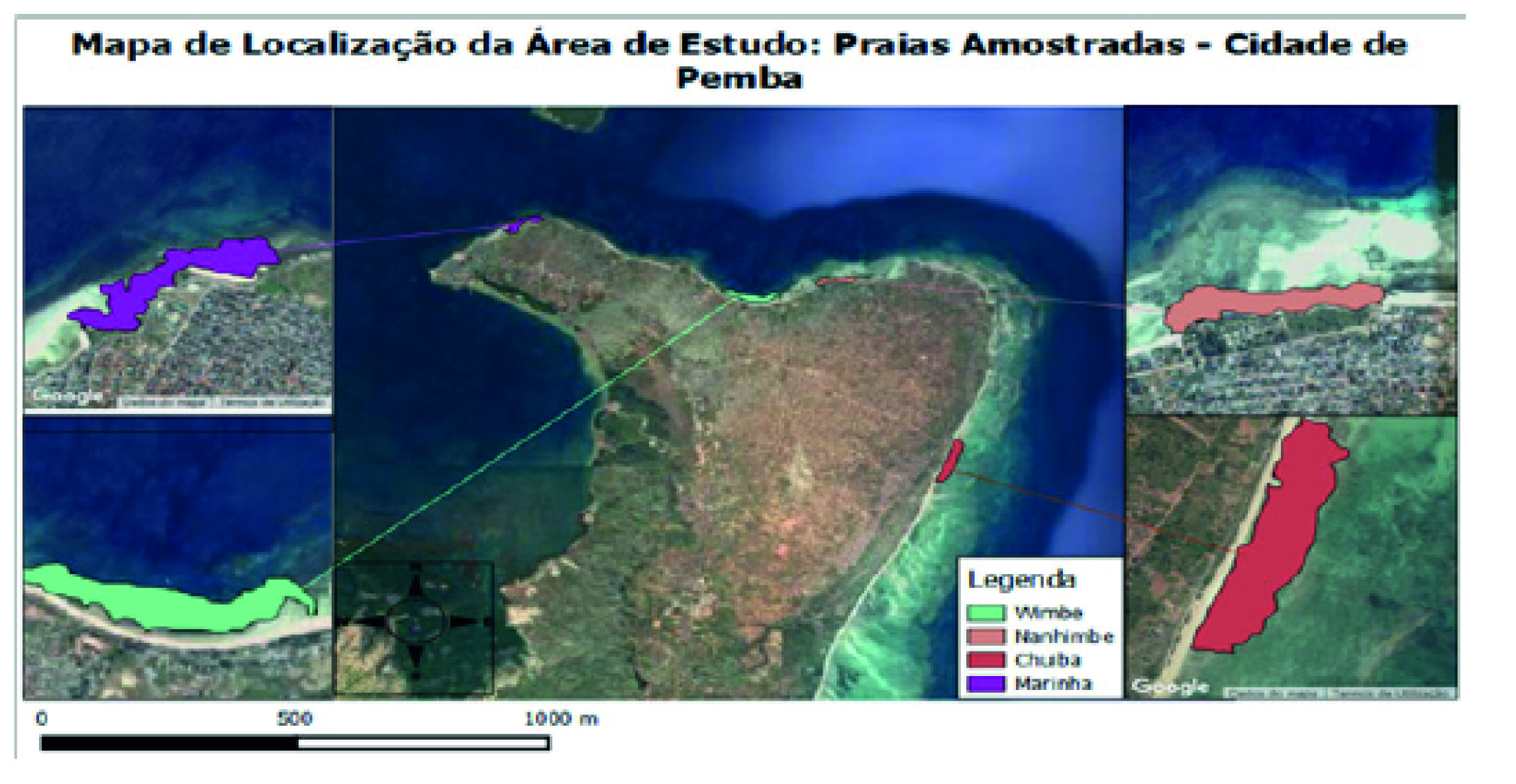
O estudo foi realizado em quatro praias urbanas de Pemba, Marinha, a mais próxima da cidade, Wimbe, Nanhimbe e Chuiba, a mais afastada (Figura 1). Chuiba é uma praia arenosa e rochosa, que apresenta um substrato com elevada ocorrência de macroalgas castanhas e de ervas marinhas. Nesta praia pratica-se a pesca artesanal utilizando-se várias artes nomeadamente: arrasto com redes mosquiteiras, gaiolas, linha-de-mão, rede de emalhar e principalmente a recolha manual de pequenos invertebrados para consumo. Nanhimbe é uma praia rochosa e arenosa, com ocorrência de macroalgas, ervas marinha e corais. A praia é rica em diversos invertebrados incluindo equinodermes, moluscos e crustáceos, entre outros. Nesta praia, pratica-se pesca artesanal com rede de arrasto para a praia, rede de cerco, gaiolas, pesca à linha e apanha de invertebrados pela população local. Wimbe é uma praia caracterizada pela dominância de substrato arenoso com ervas marinhas, alguma cobertura de coral e macroalgas. Observa-se a pesca de arrasto com redes mosquiteiras, armadilhas, arpão, redes de cerco, emalhe de superfície, gaiola, pesca à linha, apanha de crustáceos, ouriços e moluscos para venda e consumo. A praia da Marinha é rochosa e arenosa, com um substrato com cascalho de rochas de coral e galerias de poliquetas na superfície. É a praia mais próxima da cidade, com predominância de macroalgas verdes do género Ulva. Apresenta águas muito turvas e caracteriza-se pela ocorrência de fecalismo a céu aberto. Aqui, pratica-se pesca artesanal com rede de arrasto para praia, rede de cerco, emalhe de superfície, gaiola, pesca à linha e apanha de pequenos invertebrados para consumo (Saidia et al., 2015).
2. Material e Métodos
O estudo foi realizado durante seis meses, de Março a Agosto de 2016, com visitas às praias em período de maré-viva. Para obter as amostras, os pescadores foram abordados no final da actividade de colecta. Foram selecionadas somente capturas com peso igual ou superior a 1000 g. Por cada colector, retirou-se uma amostra aleatória de 1000 g para caracterizar a composição específica da pescaria. Durante os seis meses do estudo, realizaram-se duas amostragens por mês, na primeira e na última semana de maré-baixa de cada mês, perfazendo um total de 12 amostragens por praia e um conjunto total de 217 réplicas nas quatro praias. A quantidade de réplicas variou por praia e por amostragem, uma vez nem sempre foi possível obter amostras, como nas praias da Marinha e Wimbe, por não se encontrarem pessoas a praticar esta actividade, ou porque o número de pescadores variou bastante entre as amostragens, como nas praias de Chuiba e Nanhimbe.
As amostras foram identificadas no campo com auxílio de guias de identificação de espécies (Richmond, 2010; Branch et al., 2010; Deuss et al., 2013). No caso de espécies de difícil identificação taxonómica, foram selecionados exemplares que foram levados para o laboratório da Faculdade de Ciências Naturais da Universidade Lúrio para posterior identificação. A identificação das espécies foi feita com o auxílio de um microscópio estereoscópico e/ou através da captura de imagens que foram posteriormente enviadas para especialistas.
2.2. Análise de Dados
Os dados de abundância de cada espécie por réplica foram organizados numa planilha de Microsoft Excel 2010, tendo sido preparada uma matriz de dados que foi exportada para o programa PRIMER v6 para análise multivariável (Clarke e Gorley, 2006). Os dados foram submetidos a uma transformação de raiz quadrada de modo a equilibrar o contributo das espécies abundantes e raras. Foi criada uma matriz de similitude de Bray-Curtis para calcular a relação de semelhança entre as amostras, e desta foi calculada a matriz de distâncias entre os centróides correspondentes ao centro de gravidade das réplicas recolhidas por mês em cada praia. Os centróides foram representados numa análise de ordenação por nMDS (escalonamento multidimensional não paramétrico) para visualizar a relação entre as colheitas realizadas nas várias praias ao longo do tempo.
A diversidade específica das coletas foi calculada com o índice de diversidade de Shannon-Wiener (H’) e foi usado o método SIMPER para verificar quais as espécies que mais contribuíram para a dissimilitude de Bray-Curtis entre as praias. A hipótese nula de não existência de diferença significativa entre praias quanto às comunidades de moluscos colectados, foi testada com o método ANOSIM (Análise de Similitude). Este teste de hipóteses foi conduzido tendo em consideração a composição específica das colectas, a abundância das espécies bem como sobre os valores de diversidade específica. Todos os cálculos foram realizados com o programa PRIMER v6 (Clarke e Gorley, 2006).
Resultados
Durante o estudo foram identificadas 55 espécies de moluscos, das quais 12 de bivalves e 43 de gastrópodes. A diversidade de colecta mostrou grandes variações ao longo dos meses, com tendências a decrescer de Março a Maio e a aumentar de Junho a Agosto, coincidente com as épocas húmida e seca em Pemba. A diversidade média de colecta foi mais elevada em Agosto e mais baixa em Maio (H’ = 1,79 e 0,43 respectivamente).
Foram encontradas diferenças estatísticas significativas entre praias quanto à composição específica dos moluscos colectados (ANOSIM, R Global = 0,721; p<0,01). O estudo mostrou também que as praias estão bem separadas quanto à estrutura (ANOSIM; Abundância: R Global = 0,675 e p < 0,01; Diversidade: R Global = 0,648 e p < 0,01). A análise de ordenação mostrou bem esta separação entre praias (Figura 2), representadas ao longo do eixo horizontal segundo uma disposição de afastamento à cidade de Pemba, surgindo a Praia da Marinha, a mais próxima da cidade, isolada no eixo vertical.

Figura 2 Análise de ordenação dos centróides representando as réplicas obtidas por mês em cada praia. As praias sucedem-se ao longo do eixo horizontal de acordo com o seu afastamento à cidade de Pemba, no sentido Wimbe --» Nanhimbe --» Chuiba, estando a praia da Marinha, a mais próxima da cidade, isolada no pólo positivo do eixo vertical. Os algarismos correspondem aos meses de amostragem, 3: Março; 4: Abril; 5: Maio; 6: Junho; 7: Julho; 8: Agosto.
A praia da Marinha apresentou a maior diversidade média de colecta (H’=1,55) e a praia de Chuiba a menor (H’ = 0,21) (Figura 3), sendo também nesta que a abundância média mensal foi mais elevada, com 25696 indivíduos (Tabela 1).
Tabela 1 Abundância e diversidade de espécies por praia, onde S=total de espécies; N= total de indivíduos (abundância); d=riqueza especifica de Margalef; J=Índice de Pielou; H´(loge)= Índice de Shannon-Wiener;
| S | N | d | J | H'(loge) | |
|---|---|---|---|---|---|
| Chuiba | 33 | 25696 | 3,15 | 0,10 | 0,34 |
| Marinha | 35 | 2946 | 4,26 | 0,72 | 2,58 |
| Nanhimbe | 41 | 7923 | 4,46 | 0,35 | 1,31 |
| Wimbe | 43 | 3681 | 5,11 | 0,48 | 1,81 |
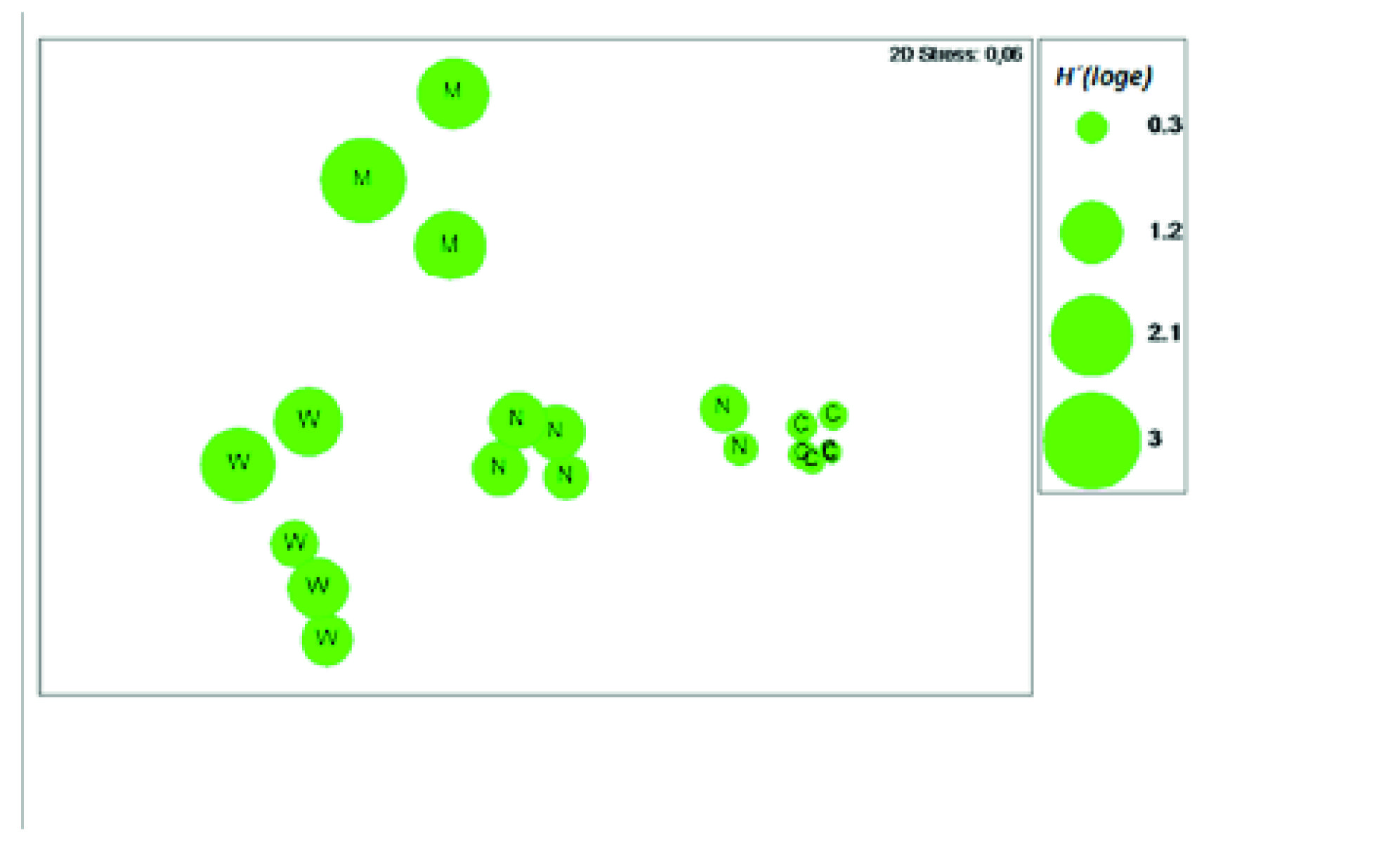
Figura 3 Representação sobre a análise de ordenação da Figura 2 dos valores de diversidade de Shannon-Wiener (H’) da colecta de Moluscos nas praias de M: Marinha, W: Wimbe, N: Nanhimbe e C: Chuiba.
A espécie M. auriculatus foi a mais colectada em praias de substrato rochoso, com uma abundância média de 97,74 indivíduos enquanto a espécie A. antiquata foi mais coletada em praias de substrato arenoso com uma abundância média de 15,62 indivíduos (Tabela 2; Figuras 4 e 5). No entanto na praia da Marinha, de substrato rochoso, a abundância do M. auriculatus foi pouco expressiva.
Tabela 2 Abundância média das espécies por praia. Valores destacados a negrito onde as espécies apresentaram maior abundância e os valores representam as duas espécies mais abundantes durante o período de estudo
| C | M | W | N | |
|---|---|---|---|---|
| Acanthopleura sp. | 0 | 1,39 | 0,03 | 0,02 |
| Anadara antiquata | 1,14 | 2,97 | 45,26 | 8,76 |
| Atrina vexullum | 0 | 0 | 0,29 | 0 |
| Barbatia sp. | 0 | 0,23 | 0,03 | 0,02 |
| Bursa granularis | 0 | 1,31 | 0,06 | 0,07 |
| Bursa Rosa | 0,15 | 6,92 | 1,59 | 1,28 |
| Cantharus undosus | 0 | 0,37 | 0 | 0 |
| Cellana eucosmia | 0 | 0 | 0 | 0,01 |
| Cerithium caeruleum | 14,73 | 18,45 | 0,71 | 3,91 |
| Cerithium echinatum | 0,40 | 0 | 0,08 | 0,28 |
| Codakia tigerina | 0 | 0 | 0,21 | 0,14 |
| Conomurex decorus | 0 | 0,03 | 0,01 | 0 |
| Conus betulinus | 0,01 | 0 | 0,01 | 0 |
| Conus lividus | 0,06 | 6,18 | 0,38 | 0,60 |
| Conus miles | 0,01 | 0,42 | 0 | 0,03 |
| Conus striatus | 0 | 0 | 0,04 | 0 |
| Conus textile | 0 | 0 | 0,01 | 0,01 |
| Chicoreus ramosus | 0,23 | 2,03 | 1,17 | 0,80 |
| Donax sp. | 0,60 | 0 | 0 | 0 |
| Drupa rubusidaeus | 0,01 | 0,74 | 0 | 0,18 |
| Drupina lobate | 0,05 | 0,18 | 0 | 0,40 |
| Gastropode sp. | 0,01 | 0 | 0,45 | 0,10 |
| Gafrarium divaricatum | 0 | 0 | 0,06 | 0 |
| Gafrarium pecnatum | 2,05 | 0,92 | 7,55 | 2,87 |
| Gutturnium muricinum | 0,32 | 2,45 | 2,17 | 1,18 |
| Haliotis sp. | 0,05 | 17,10 | 0,01 | 0,03 |
| Harpa amouretta | 0 | 0 | 0,21 | 0,03 |
| Lambis lambis | 0 | 0 | 0,01 | 0 |
| Latirus polygonus | 0,02 | 0 | 0,01 | 0 |
| Lynciana lynx | 0,05 | 0,13 | 0,04 | 0,07 |
| Lyrocardium lyratum | 0 | 0 | 0,16 | 0 |
| Mancinella alouina | 0,03 | 0,5 | 0 | 0,06 |
| Modiolus auriculatus | 205,63 | 16,29 | 1,97 | 149,92 |
| Monoplex aquatilis | 0,03 | 2,08 | 1,09 | 0,35 |
| Natica sp. | 0 | 0 | 0,06 | 0,03 |
| Natica arachnoidea | 0 | 0 | 0,12 | 0 |
| Nassarius arcularia plicatus | 0 | 0,03 | 0,37 | 0,22 |
| Nerita albicilla | 0,58 | 3,45 | 0,38 | 5,13 |
| Oxymeris dimidiate | 0,02 | 0 | 0,03 | 0,02 |
| Pinctada margaritifera | 0,06 | 0,31 | 0,04 | 0,22 |
| Pinna muricata | 0,03 | 0,18 | 3,60 | 0,32 |
| Polinices mammilla | 0 | 0,03 | 0,08 | 0,04 |
| Strombus mutabilis | 0,08 | 3,60 | 1,30 | 1,26 |
| Canaruim mutabilis | 0,13 | 5,21 | 1,5 | 1,72 |
| Canarium labiatum | 0,05 | 0,45 | 0,10 | 0,18 |
| Stombidae sp. | 0,02 | 2,95 | 0,95 | 0,30 |
| Strombus gibberulus | 0,75 | 0 | 1,03 | 0,15 |
| Tapes sulcarius | 0 | 0,03 | 0,06 | 0,03 |
| Tectus tentorium | 0,10 | 1,95 | 0 | 0,06 |
| Tectus mauritianus | 0,05 | 0,13 | 0,08 | 0,04 |
| Turbo radiates | 0,15 | 3,31 | 0,01 | 0,34 |
| Trachycardium rubicudum | 0,08 | 0,47 | 2,18 | 1,57 |
| Tridacna maxima | 0,06 | 0,13 | 0,01 | 0,13 |
| Varsum turbinellus | 0,08 | 1,60 | 0 | 0,04 |
| Volema pyrum | 0,01 | 0,05 | 0,053 | 0,07 |
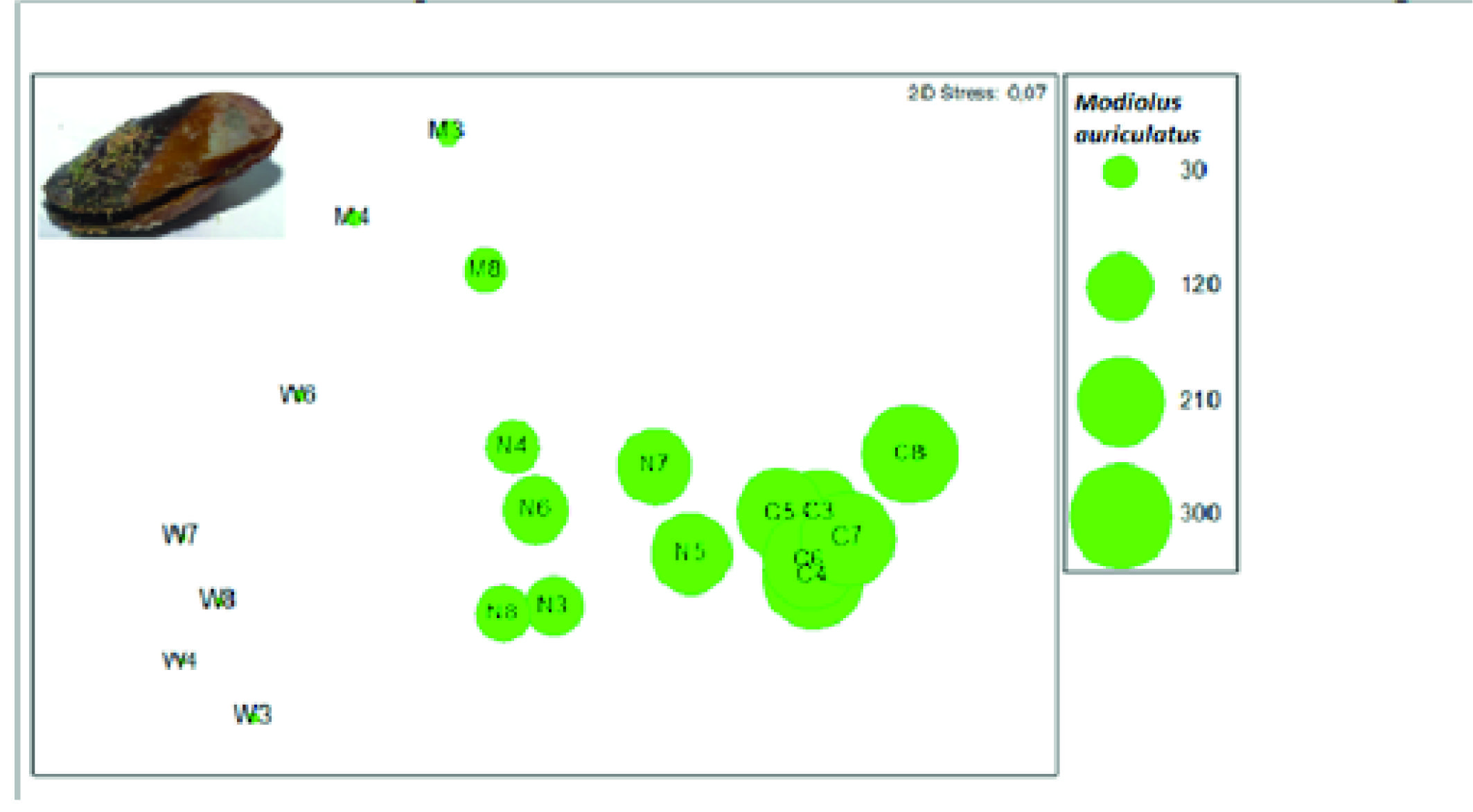
Figura 4 Representação sobre a análise de ordenação da Figura 2, da abundância do bivalve Modiolus auriculatus em cada praia. M: Marinha, W: Wimbe, N: Nanhimbe, C: Chuiba. Os algarismos representam os meses do ano sendo 3: Março; 4: Abril; 5: Maio; 6: Junho; 7: Julho; 8: Agosto.
A análise com o método SIMPER mostrou que a média de dissimilitude de Bray-Curtis entre praias foi elevada, quase sempre acima de 80%. As praias de Chuiba e Wimbe foram as mais distintas (dissimilitude média de 97,83%), enquanto Chuiba e Nanhimbe foram as menos distintas (dissimilitude média de 54,93%). As espécies que mais contribuíram para essa dissimilitude estão referidas na Tabela 3, com destaque para M. auriculatus e A. antiquata. Na Tabela 4 é apresentada a relação das espécies que mais contribuíram para a similitude interna de cada praia, ou seja, para a similitude das amostras obtidas em cada praia ao longo do período de estudo.
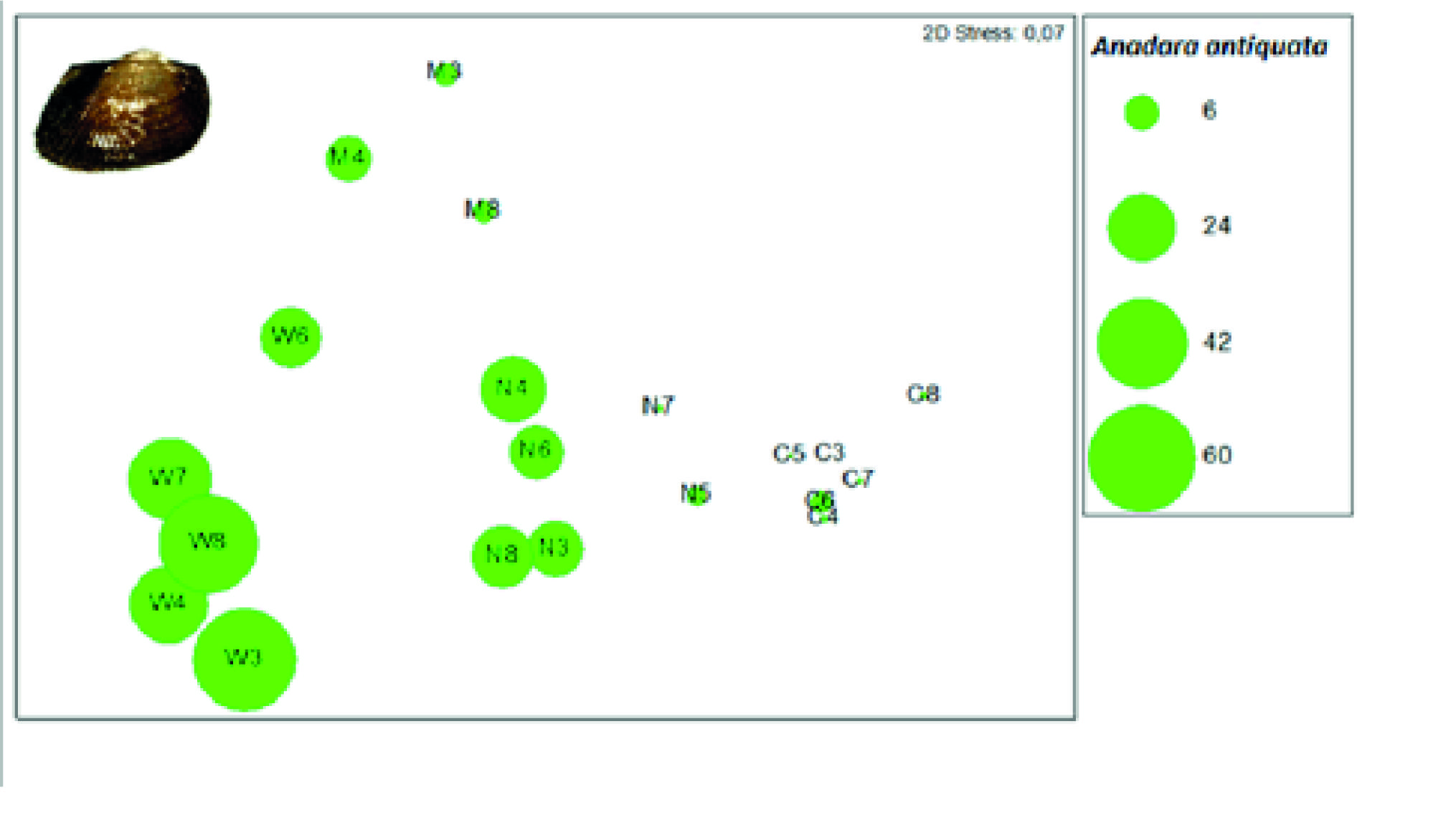
Figura 5 Representação sobre a análise de ordenação da Figura 2, da abundância do bivalve Anadara antiquata em cada praia. M: Marinha, W: Wimbe, N: Nanhimbe, C: Chuiba. Os algarismos representam os meses do ano sendo 3: Março; 4: Abril; 5: Maio; 6: Junho; 7: Julho; 8: Agosto.
Tabela 3 Dissimilitude média de Bray-Curtis entre praias e relação das espécies que mais
| Praias | Dissimilitude média (%) | Contribuição das Espécies (%) |
|---|---|---|
| Chuiba e Marinha | 85,91 | Modiolus auriculatus (63,25), Haliotis sp. (8,07), Cerithium caeruleum (7,02), Conus lividus (3,47), Bursa rosa (3,37), Strombus mutabilis (2,23), Strombidae sp.1 (2,15), Turbo radiatus (1,17). |
| Chuiba e Wimbe | 97,93 | Modiolus auriculatus (72,27), Anadara antiquata (15,34), Cerithium caeruleum (2,80). |
| Marinha e Wimbe | 89,85 | Anadara antiquata (23,03), Haliotis sp. (13,90), Modiolus auriculatus (13,23), Cerithium caeruleum (7,66), Conus lividus (5,98), Bursa rosa (5,66), Strombus mutabilis (4,83), Strombidae sp.1 (3,95),Grafarium pecnatum (3,67), Turbo radiatus (3,06), Gutturnium muricinum (2,32), Monoplex aquatilis (1,74). |
| Chuiba e Nanhimbe | 54,93 | Modiolus auriculatus (72,55), Anadara antiquata (8,60), Cerithium caerukleum (6,12), Nerita albicilla (3,79). |
| Marinha e Nanhimbe | 83,99 | Modiolus auriculatus (40,31), Haliotis sp. (11,06), Cerithium caeruleum (8,26), Anadara antiquata (8,14), Conus lividus (4,70), Bursa rosa (4.25) Nerita albicilla (3,94), Strombus mutabilis (3,41), Strombidae sp. (3,31), Turbo radiatus (2,33), Morula sp. (1,78). |
| Wimbe e Nanhimbe | 80,82 | Modiolus auriculatus (51,51), Anadara antiquata (20,75), Nerita albicilla (4,31), Grafarium pecnatum (3,92), Cerithium caeruleum (3,54), Strombus mutabilis (2,39), Trachycardium rubicudum (1,95), Gutturnium muricinum (1,72) |
Tabela 4 Similitude média de Bray-Curtis entre as amostras obtidas em cada praia ao longo do período em estudo e percentagens de contribuição das várias espécies para essa similitude interna.
| Praias | Similitude média (%) | Contribuição das Espécies (%) |
|---|---|---|
| Chuiba | 62,63 | Modiolus auriculatus (99,38) |
| Marinha | 17,68 | Bursa rosa (18,53), Haliotis sp. (18,35), Modiolus auriculatus (13,50), Conus lividus (12,17), Turbo radiatus (6,83), Varsum turbinellus (4,78), Anadara antiquata (4,70), Strombus mutabilis (4,50), Gutturnium muricinum (3,43), Monoplex aquatilis (3,20), Chicoreus ramosus (2,62). |
| Nanhimbe | 38,74 | Modiolus auriculatus (79,70), Anadara antiquata (13,58). |
| Wimbe | 48,90 | Anadara antiquata (85,85), Grafarium pecnatum (4,55). |
Discussão
Das 55 espécies de moluscos colectadas em Pemba, algumas foram identificadas em estudos similares feitos no arquipélago das Quirimbas como é o caso das espécies Atrina vexillum, Pinna muricata, Chicoreus ramosus, Lambis lambis, Varsun turbinellum e Strombus mutabilis; sendo, no entanto, a maioria distintas das espécies colectadas no Sul do país (Barnes, 1998). Isto deve-se provavelmente a diferentes condições ecológicas associadas ao clima e à geologia nesta região do país, que se caracteriza por apresentar uma região costeira lamacenta e arenosa, em grande parte associada a terraços fluviais, assim como dunas. Estas características são distintas da Cidade de Pemba que apresenta uma zona costeira com fraca influência de água doce, caracterizada por apresentar substracto rochoso na área de ocorrência de bivalves (Souto, 2014).
A disposição das praias representa um gradiente natural de afastamento à Baia de Pemba, daí as amostras estarem representadas no diagrama de ordenação conforme com a sua localização. Apesar da diversidade de moluscos entre as praias ter diferido, observou-se maior semelhança entre as praias de Chuiba e Nanhimbe, provavelmente por serem praias de substrato rochoso e por partilharem espécies abundantes como Modiolus auriculatus, Cerithium caeruleum, Naerita albicila e Grafarium pecnatum, tendo sido a espécie M. auriculatus a que mais contribuiu para esta similaridade. Segundo Nordlund (2006), esta espécie é igualmente a mais colectada no sul do país, na ilha da Inhaca. M. auriculatus é uma espécie comum em habitats rochosos (Razek et al., 2014), enquanto A. antiquata vive em habitats arenosos e fundos lamacentos (Bernard, Cai, e Morton, 1993).
Apesar da praia da Marinha apresentar substrato rochoso, não foi a espécie M. auriculatus a mais abundante na colecta, ao contrário do que se observou nas outras praias com este tipo de substracto. Este facto estará provavelmente relacionado com a elevada poluição e sobre-exploração de M. auriculatus nesta praia, que, contudo, apresentou uma diversidade alta da colecta. A diversidade da colecta pode refletir a preferência dos colectores associada à disponibilidade das espécies, fazendo com que na praia de Chuiba os colectores optem apenas por apanhar M. auriculatus. De acordo com Boer, Blijdenstein e Longamane (2002) e Belovsky, Ritchie e Moorehead, (1988), em ambientes com elevada abundância de recursos, a dieta inclui normalmente apenas as espécies mais lucrativas, resultando menor impacto sobre a restante biodiversidade. Pelo contrário, em ambientes com menos recursos, como a praia da Marinha, a colecta tende a ser mais diversa, incluindo igualmente espécies menos lucrativas (Boer, Blijdenstein e Longamane, 2002).
A diversidade mais elevada da colecta em Agosto poderá estar relacionada com o fato deste período coincidir com a reprodução de muitos invertebrados marinhos, pois segundo Giese (1958), apesar dos invertebrados se poderem reproduzir ao longo do ano, a maior parte tende a reproduzir-se no verão o que coincide com o período seco em Pemba.
Como principal conclusão deste trabalho, pode-se afirmar que a biodiversidade de colecta de moluscos se deve a vários factores, alguns naturais (substrato, proximidade à Baia, exposição ao hidrodinamismo), outros antropogénicos (saúde ambiental das praias), outros ainda devido à preferência dos colectores associada à disponibilidade das espécies. Os resultados reportados constituem a primeira abordagem na região de Pemba à pesca artesanal de moluscos marinhos por parte das populações locais e constituem um importante manancial de informação para uma futura gestão desta pescaria. A falta de programas de monitorização no país para estes invertebrados acarreta implicações da marginalização desta actividade e faz com que a pressão sobre os recursos seja subestimada. Neste trabalho fica, no entanto, demostrado o potencial impacto desta actividade sobre os ecossistemas costeiros.
6. Conclusão
Como principal conclusão deste trabalho, pode-se afirmar que a biodiversidade de colecta de moluscos se deve a vários factores, alguns naturais (substrato, proximidade à Baia, exposição ao hidrodinamismo), outros antropogénicos (saúde ambiental das praias), outros ainda devido à preferência dos colectores associada à disponibilidade das espécies. Os resultados reportados constituem a primeira abordagem na região de Pemba à pesca artesanal de moluscos marinhos por parte das populações locais e constituem um importante manancial de informação para uma futura gestão desta pescaria.