INTRODUÇÃO
Em Dermatologia, a utilização de fármacos com ação imunomoduladora tem sido a norma no tratamento das doenças inflamatórias cutâneas como a psoríase ou o pênfigo vulgar. Estes fármacos têm como alvo citocinas, mediadores imunes, moléculas e recetores de superfície celular, componentes celulares da cascata de resposta inflamatória, elementos intervenientes na fisiopatologia de doenças neoplásicas, autoimunes e inflamatórias,1 que correspondem a elementos importantes da resposta fisiológica do organismo nomeadamente ao nível da homeostasia imunitária e controlo do ciclo celular. O bloqueio ou interferência destes alvos pode condicionar desregulação da resposta imune e promover o risco de infeção.
O conhecimento e investigação na avaliação de risco infecioso, rastreio e prevenção associado a moléculas com ação imunossupressora de que são exemplo os anticorpos monoclonais é já bastante conhecido, contudo o risco associado a DMARDs (disease-modifying anti-rheumatic drugs) tradicionais, está menos esclarecido não sendo, contudo desprezível. Segue-se uma revisão destes aspetos centrada nos corticoides sistémicos, metotrexato e ciclosporina.
MÉTODOS
Foi realizada uma revisão de literatura nas plataformas PubMed, B-on e Medline através das palavras-chave “Infeção”, “Corticoide”, “Metotrexato”, “Ciclosporina”, “Tuberculose”, “VHZ”, “Vacinas vivas”, “Pneumocistose”, “Imunossupressor”, no período compreendido entre novembro de 2020 e janeiro de 2021. Foram incluídos artigos publicados em língua portuguesa e inglesa.
RESULTADOS E DISCUSSÃO
Corticoide sistémico
Amplamente usados há mais de 60 anos, os corticoides sistémicos inibem a secreção de citocinas inflamatórias levando à redução da migração de leucócitos e diferenciação de macrófagos, redução da capacidade fagocítica e da função de linfócitos T, inibindo a produção de citocinas inflamatórias essenciais à cascata imune.2 São excelentes fármacos no controlo e tratamento de doença inflamatória e autoimune, contudo acarretam efeitos adversos importantes como hiperglicemia, aumento da resistência periférica a insulina, hipertensão, alterações iónicas, osteoporose, linfopenia e imunossupressão.
Estes efeitos variam consoante a população em estudo, parecendo relacionar-se com idade, etnia, género e comorbilidades do doente.3 A forma de administração, dose utilizada e uso concomitante de outra medicação contribuem para diferentes efeitos adversos.4
Vacinação
Atendendo à ação destes fármacos no sistema imunitário torna- se importante avaliar os riscos inerentes à vacinação. Segundo as recomendações da Infectious Diseases Society of America (IDSA) a administração de vacinas polissacáridas pode ser realizada em qualquer fase de doença ou tratamento, contudo deve, preferencialmente, anteceder em 2 semanas a imunossupressão, por forma a aumentar a taxa de imunização subsequente5 Da mesma forma estes doentes devem realizar anualmente a vacinação contra o vírus Influenza bem como o esquema completo de vacinação pneumocócica, que se deve iniciar com a vacina conjugada pneumocócica e reforço com a vacina pneumocócica polissacarídea (Pn23), pelo menos 8 semanas depois. Posteriormente deve ser realizado reforço com Pn23 a cada 5 anos.6
As vacinas vivas atenuadas podem originar infeção e formas graves de apresentação de doença no imunocomprometido. Assim são contraindicadas quando o doente está sob prednisolona em dose >20 mg/dia por mais de duas semanas ou equivalente,5,7mas podem ser aplicadas com segurança se suspensão de corticoide por 1 mês antes da sua administração,8,9Por outro lado, os corticoides não constituem contraindicação se: curto tempo de terapêutica (<2 semanas); dose baixa a moderada (<20 mg/dia de prednisolona ou equivalente); administração tópica cutânea ou ocular; corticoide inalado ou administração intrarticular; administração prolongada ou em dias alternados com corticoide de curta ação; doses de manutenção fisiológicas.7
Infeção bacteriana
O risco de infeção bacteriana grave existe e parece relacionar-se com a dose de corticoide utilizada, não sendo desprezível a partir de 5mg/dia de prednisolona ou equivalente.10 Uma meta-análise de dados agrupados de 71 ensaios clínicos mostrou uma taxa geral de complicações infeciosas, associadas a corticoides, de 12,7% em comparação com 8% registada no braço do placebo.8 Um estudo realizado no Québec evidenciou que na doença inflamatória do intestino (DII) sob corticoide oral havia risco 2,8 vezes superior de internamento por infeção grave.11
Risco de tuberculose
Segundo a organização mundial da saúde, a forma latente de tuberculose caracteriza-se pela presença de Mycobacterium tuberculosis sem que se expresse clinicamente doença. O risco de evolução para tuberculose ativa ou para formas graves de apresentação está bem descrito com a utilização de biológicos e imunossupressores.12
Os corticoides levam a inibição de linfócitos e monócitos, encontrando-se o risco de reativação descrito em terapêutica prolongada ou doses > 15 mg/dia de prednisolona ou equivalente, por mais de 2-4 semanas.13 Uma revisão por Fabrizio Cantini e colaboradores mostrou um risco relativo de reativação de 2,4 (categorizado como risco minor pelos autores) com a utilização de corticoide.13 Já um estudo de Lai-Shan Tam et al mostrou que as doses cumulativas de prednisolona são fator independente para o desenvolvimento de tuberculose em doentes com LES.14 Susan S. Jick e colaboradores objetivaram, num estudo de caso, um risco relativo de 4,9 de desenvolvimento de tuberculose quando administrados corticoides, sendo que este risco variou de 2,8 quando as doses de prednisolona foram <15 mg/dia e 7,7 quando acima desta dose, ambos superiores ao grupo controlo.15
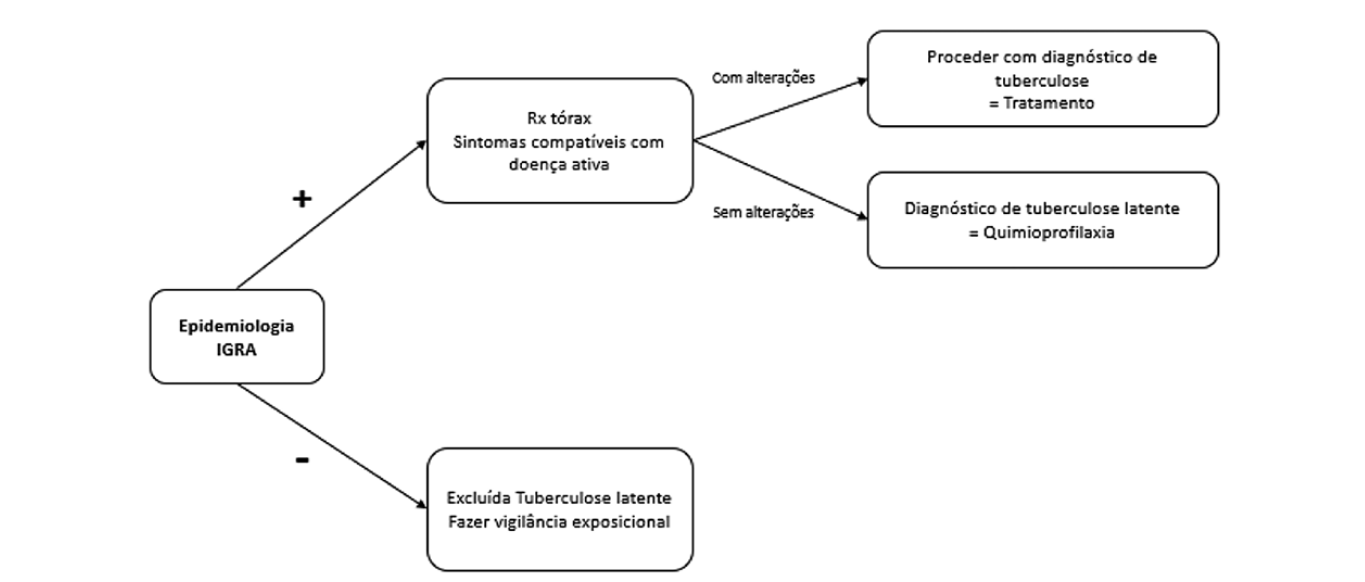
Acredita-se que a evolução da doença se deve tanto à terapêutica utilizada como à doença de base e apoiando-se nisso, o Center for Disease Control and Prevention (CDC) recomenda um rastreio adequado em doentes que vão iniciar tratamento prolongado ou altas doses de corticoide.16 O rastreio pode ser realizado através de uma estratégia dual step onde se inclui sempre a avaliação epidemiológica, seguida das provas IGRA (interferon gamma release assay) e TST (tuberculin skin test), ou uma abordagem sigle step onde se realiza apenas o teste IGRA. Ana Sousa e colaboradores mostraram que a estratégia dual step é menos custo-efetiva.17 Na mesma linha de pensamento, um estudo realizado com 757 doentes e com o objetivo de mostrar o grau de concordância entre provas TST e IGRA evidenciou que o maior fator de discordância para ter um IGRA positivo e TST negativo foi a utilização de corticoterapia.18 Propõe-se assim uma avaliação inicial com base em estratégia single step (Fig. 1). Sempre que o teste IGRA for positivo deve realizar-se um radiograma de tórax para exclusão de doença ativa. Atendendo às limitações do teste quantitativo IGRA QuantiFERON® TB GOLD em doentes com linfopenia decorrente da corticoterapia, deve ser preferido o teste qualitativo T-SPOT.
TB®, que tem maior sensibilidade nestes casos.19,20Uma vez realizado o diagnóstico de tuberculose latente procede-se então a quimioprofilaxia. Existem vários esquemas recomendados, entre eles 9 meses de isoniazida em toma diária, 4 meses de rifampicina em toma diária, ou ainda 3 meses da combinação isoniazida e rifampicina em toma diária. A administração destes fármacos exige vigilância de hepatotoxicidade.
Um doente que já tenha realizado quimioprofilaxia ou mesmo terapêutica antibacilar completa, não carece de nova avaliação com IGRA já que este será sempre reativo. Deve sim fazer vigilância de sintomas e avaliação de novas exposições de risco que lhe confiram critério para novo esquema terapêutico.
Risco de infeção por Pneumocystis jirovecii Pneumocistis jirovecii é um fungo com tropismo pulmonar. Origina pneumonia com insuficiência respiratória parcial, podendo evoluir para formas graves de doença e necessidade de suporte ventilatório. É ainda hoje uma importante causa de morbimortalidade no imunocomprometido, sendo a corticoterapia um importante fator de risco nos doentes não VIH.21 A evidência de pneumocistose associada a terapêutica com corticoide baseia-se em estudos de caso controlo e pequenas publicações. Um estudo que seguiu 116 doentes com pneumocistose e sem infeção VIH mostrou que 91% tinha feito terapêutica com corticoide no mês precedente à infeção. A dose administrada foi de 30 mg/dia.22 Um outro estudo de caso que avaliou 15 doentes com LES e pneumocistose em comparação com 60 doentes com LES sem pneumocistose, mostrou que doses >20 mg/ dia de prednisolona se associaram à infeção.23
Não está definida a dose de corticoide a partir da qual o risco justifique início de profilaxia. Uma revisão mostrou maior risco, e defende início de profilaxia, quando usadas doses de prednisolona, ou equivalente, acima dos 20 mg/dia por mais de 4 semanas em doentes com doença pulmonar obstrutiva crónica (DPOC) ou patologia pulmonar.21 A American Thoracic Society recomenda início de profilaxia quando usadas doses >20 mg/dia por mais de 1 mês.23
Apesar destas referências, o risco de pneumocistose para doses <15mg/dia não é desprezível.23-26A IDSA define >20 mg/dia por mais de 14 dias como alto risco5 pelo que poderá ser aconselhável a realização de profilaxia em doentes que façam esta dose e tenham outros fatores de risco como idade avançada ou patologia estrutural pulmonar.
Finalmente um estudo por Park e colaboradores mostrou que os benefícios da profilaxia suplantam largamente os efeitos adversos inerentes ao fármaco, quando a dose de corticoide administrada é de 60 mg/dia.27
A profilaxia é realizada em primeira linha com trimetropim-sulfametoxazol, podendo este ser administrado em dose dupla (1 comprimido de 960 mg) três vezes por semana, ou em dose simples (1 comprimido de 480 mg) diariamente. Contraindicações ou intolerâncias à mesma podem ser colmatadas com um fármaco de segunda linha, a atovaquona na dose de 1500 mg/dia. O melhor momento para suspender profilaxia não está definido, alguns estudos apontam para quando se atingem doses <15 mg/dia, mas um relato de casos clínicos mostrou que esta poderá ser necessária por vários meses após suspensão da imunossupressão.25
Risco de reativação de infeção viral Reativação de vírus Herpes Zoster (VHZ) - Os principais fatores de risco para a reativação do VHZ são a idade superior a 50 anos e a imunossupressão. A incidência aumenta com o avançar da idade e é mais prevalente em mulheres.28 O risco estimado de ocorrência de zona num indivíduo ao longo da sua vida é de 10%-20%,29 podendo este valor aumentar no imunocomprometido.
Um estudo de Zisman e colaboradores mostrou que o risco de reativação de VHZ em doentes com psoríase aumentava se existissem cofatores como idade avançada, associação terapêutica com corticoides ou combinada entre inibidores do TNFα e outro fármaco não biológico.30 Um estudo de coorte avaliou 121 doentes, dos quais 76% com dermatomiosite, mostrando uma correlação entre a utilização de corticoide sistémico e zona.31 Um estudo por Kevin Winthrop et al avaliou doentes com psoríase, artrite psoriática, artrite reumatoide, espondilite anquilosante e DII mostrando que doses de corticoide >10 mg/dia se associavam a risco de reativação de VHZ independentemente da doença de base.32 Na maioria dos estudos o risco aumenta se houver terapêutica biológica concomitante.12,30,32
Como forma de profilaxia existe a vacinação com a Zostavax®, uma vacina viva atenuada, contraindicada em doentes que tenham já algum grau de imunossupressão.5,7É a única vacina aprovada para utilização em Portugal, ressalvando-se, contudo, uma forma de vacina recombinante, Shingrix®, licenciada em 2018, ainda indisponível.
O CDC aconselha a vacinação se idade superior a 60 anos, sem contraindicação, com ou sem episódios prévios de zona33 e a terapêutica imunossupressora só poderá iniciar-se 4 semanas após administração vacinal.8,9No caso de se tratar de um doente que nunca tenha tido contacto com VHZ poderá então ser proposto um esquema vacinal com a Varivax® (2 administrações de 0,5 mL espaçadas em 4-8 semanas) em lugar da anterior.33 Um estudo retrospetivo mostrou redução de reativação de infeção por VHZ de 2080 casos para 21 quando avaliados e comparados doentes com patologia autoimune incluindo psoríase, sob corticoide sistémico e que realizaram vacinação.34
A utilização de profilaxia antiviral com aciclovir ou valaciclovir foi descrita e aprovada apenas para patologia hematológica, transplante de órgão sólido ou de medula óssea.35
Reativação de VHB - Estima-se que na Europa mais de 15 milhões de pessoas vivam com infeção crónica por vírus da hepatite B, podendo isto levar a complicações hepáticas graves em cerca de 20% a 30% dos infetados. As formas de reativação tornam-se uma realidade no doente imunossuprimido e podem manifestar-se com apresentação grave.36 Ocorrem tanto em doentes com AgHBs positivo como naqueles que expressam contato prévio (AgHBs negativo, mas AcHBc positivo) sendo o risco superior no primeiro grupo36 e pouco estudado no segundo.37 Um estudo prospetivo que pretendeu mostrar o efeito da corticoterapia na recuperação de doentes com hepatite B crónica mostrou que doses de corticoide de 10 mg/dia foram suficientes para aumentar as recorrências, a frequência de complicações e a taxa de mortalidade.38 Um outro estudo por Cheng e colaboradores comparou a taxa de reativação de hepatite B em doentes com linfoma que se encontravam sob esquema de quimioterapia com ou sem corticoide associado, mostrando reativação em 73% vs 38% dos grupos respetivamente.39
A estratégia de rastreio e profilaxia não é totalmente consensual, mas recomenda-se:
• O rastreio do doente que vai iniciar corticoide em alta dose deve incluir uma avaliação serológica com AgHBs, AcHBc e AcHBs40,41 independentemente de ter ou não realizado esquema vacinal completo prévio, já que a imunidade pós-vacinal se perde ao longo dos anos.
• A reativação caracteriza-se pela subida na quantificação do ADN viral (100x o basal se quantificável inicialmente ou uma quantificação de novo) ou por serorreversão com ressurgimento de AgHBs, aliados a subida de transaminases, que caracterizam o padrão de hepatite.36
• Pode assumir-se como alto risco (>10%) a administração de corticoide por mais de 4 semanas em doentes com AgHBs positivo. Estes terão indicação para profilaxia com TDF (tenofovir disoproxil fumarato) ou entecavir. Doentes que façam corticoide por mais de 4 semanas e tenham apenas AcHBc positivo, poderão ter indicação ou para profilaxia ou terapêutica preemptiva, de acordo com os restantes fatores de risco existentes. Se realizarem corticoide por curto período não é necessária profilaxia ou vigilância.37 Entende-se por terapêutica preemptiva a vigilância e quantificação trimestral do ADN viral, marcadores serológicos e transaminases hepáticas com o objetivo de identificar reativação precocemente.
• Doentes que não tenham tido contacto com o vírus devem ser avaliados quanto ao risco de vir a contrair infeção e realizar esquema vacinal completo,40 o mesmo se aplica a doentes previamente vacinados mas que tenham perdido imunidade pós vacinal, ou seja, que tenham AcHBs negativo.
Risco de infeção parasitária - Estrongiloidíase
A infeção por Strongyloides stercoralis é mais comum em países de clima tropical como a África Subsariana, América do Sul e Este Asiático, mas pode estar presente em regiões do sul da Europa,
encontrando-se descritos casos em Portugal.42 O contágio é feito pelo contacto da pele com solo contaminado, podendo a infeção ser assintomática por longos períodos. Com capacidade de autoinoculação, o parasita origina uma infeção gastrointestinal, disseminação e síndrome de hiperinfeção, sobretudo no imunocomprometido. A corticoterapia é dos principais fatores de risco associados a formas disseminadas de doença e atingimento pulmonar.43 Al Maslamani et al reportaram dois casos clínicos de síndromes de hiperinfeção após utilização de corticoterapia,44 uma outra publicação exemplifica um caso de dermatomiosite em doente da Guatemala, submetido a múltipla terapêutica imunossupressora, nomeadamente corticoides em alta dose, e desenvolvimento de estrongiloidíase disseminada.45
É assim aconselhável a avaliação com um exame parasitológico de fezes e serologia em doentes propostos para início de terapêutica com corticoide em alta dose. A profilaxia e terapêutica devem ser adequadas e são realizadas normalmente com ivermectina.46
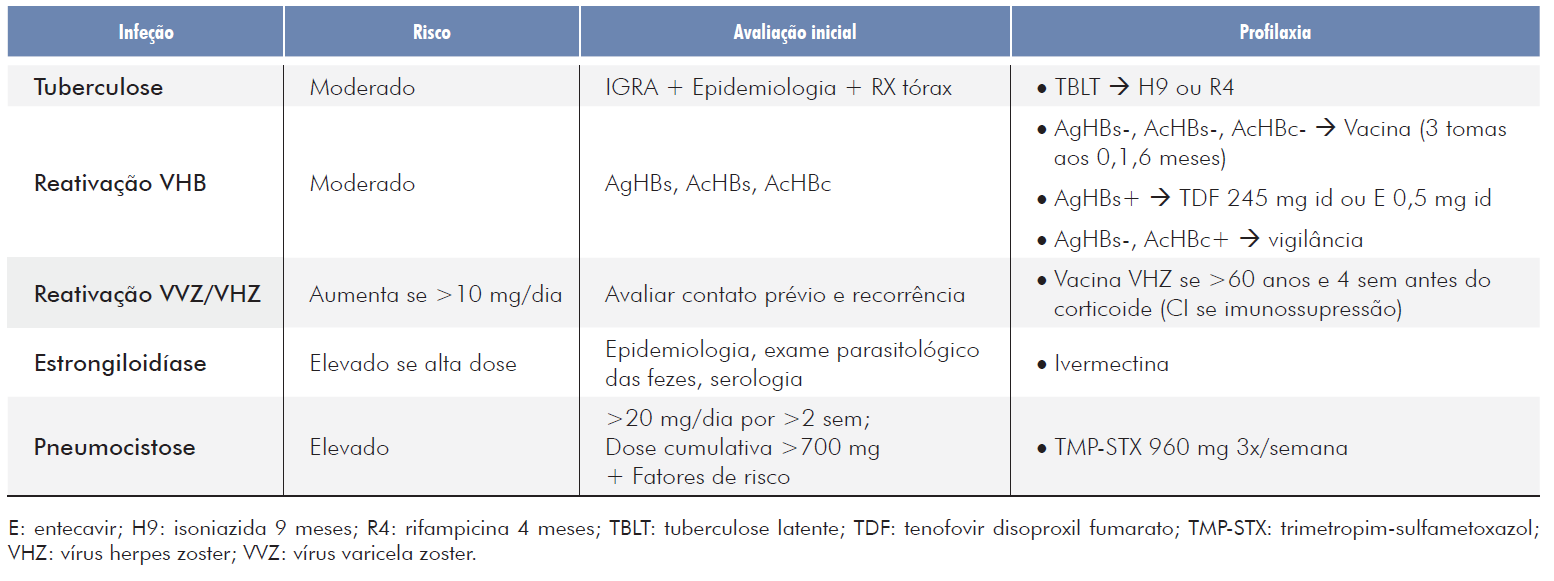
Apesar de extensamente usados, há muito ainda por saber sobre o risco infecioso associado ao corticoide sistémico e quando devem ser aplicadas profilaxias dirigidas (Tabela 1). Aquilo que parece ser consensual é que este risco, no tratamento de patologia autoimune, parece depender da dose administrada, da duração da terapêutica e da coadministração de outros fármacos.
Ciclosporina
Licenciada desde o final dos anos 70 como fármaco imunossupressor em doentes transplantados, a ciclosporina é um inibidor da calcineurina que impossibilita a resposta imune adaptativa de forma seletiva, através do bloqueio da biossíntese dependente de células T, nomeadamente da IL2.47 Atualmente é de grande utilidade em dermatologia, sobretudo no tratamento da psoríase.
Estão descritos múltiplos efeitos secundários associados a este fármaco, como hipertensão arterial, hiperuricemia, nefro e neurotoxicidade.
Atendendo ao seu mecanismo de ação, torna-se expectável o risco infecioso associado, contudo, quando em monoterapia e no tratamento de patologia não neoplásica, tal não se parece comprovar.48-50Um estudo retrospetivo, que comparou infeção no tratamento de dermatite atópica, mostrou que a ciclosporina e o metotrexato tinham muito baixo risco de infeção grave, ao contrário do risco não desprezível da prednisolona, azatioprina e micofenolato de mofetilo.51 Um outro estudo prospetivo multicêntrico que avaliou ocorrência de infeção no tratamento da psoríase, evidenciou maior risco com a utilização de ciclosporina quando comparada com metotrexato, ainda que em ambos este fosse muito inferior ao dos inibidores do TNFα.52 Não obstante, é conhecida a suscetibilidade a infeção bacteriana sobretudo em doentes com patologia hematológica, parecendo a ciclosporina atrasar a clearance de bactérias como o S. aureus.53 Desconhece-se, contudo, a importância clínica desta evidência.
Risco de tuberculose
A taxa de desenvolvimento de tuberculose ativa a partir da sua forma latente é de 5%-10% ao longo da vida.54 Este valor aumenta no imunocomprometido e depende da doença de base. Um estudo retrospetivo mostrou que poderá haver risco de reativação de tuberculose em doentes com artrite reumatoide tratados com DMARDs tradicionais, contudo não explicita o verdadeiro contributo da ciclosporina.55 Um segundo estudo realizado pelo mesmo autor, no Québec, mostrou risco em doentes tratados com fármacos convencionais, contudo inferior ao da corticoterapia.56 Em suma a evolução para tuberculose doença parece ser superior quando existe combinação
de fármacos imunossupressores.57 Assume-se assim baixo risco de reativação de tuberculose na patologia inflamatória sob ciclosporina,50pelo que poderá estar indicado o rastreio e quimioprofilaxia, mas não devendo estes atrasar o início da terapêutica.
Risco de reativação de infeção viral
A ciclosporina associa-se a risco de reativação de vírus sobretudo da família herpes como o VHZ. Pode associar-se a nevralgia incapacitante e, no imunocomprometido, evoluir para formas disseminadas graves. Até à data, os estudos não são consensuais quanto ao risco de reativação em doentes que fazem imunossupressores.
Um estudo retrospetivo realizado por Guy Shalom et al não mostrou aumento de risco estatisticamente significativo aquando do tratamento de psoríase com ciclosporina.58 Um outro estudo que comparou o tratamento de doentes com artrite psoriática não mostrou aumento significativo de zona nos doentes tratados com DMARDs em monoterapia, o que já não se verificava aquando da associação de medicação.30 Em contrapartida J. Dreiher e colaboradores mostraram aumento de risco de reativação em doentes com psoríase tratados com ciclosporina.59
Assim e até melhor esclarecimento, propõem-se como forma de profilaxia, o aconselhamento dos doentes e a sua educação para reconhecerem a infeção precocemente e iniciarem tratamento atempadamente.29 Poderá ser proposta vacinação a indivíduos com mais de 60 anos, sem contraindicação e com outros fatores de risco (idade, terapêutica com corticoides ou combinação com outra imunossupressão).30,59
Risco infeção fúngica
Estão bem descritas infeções por Pneumocystis jirovecii em doentes com patologia hematológica, oncológica ou após transplante e que façam esquemas imunossupressores com ciclosporina60,61porém o risco quando este fármaco é utilizado em monoterapia noutro tipo de patologia não está definido ou quantificado.
Vacinação
Finalmente e apesar do baixo risco infecioso comprovado, a ciclosporina é um fármaco imunossupressor pelo que as contraindicações na administração de vacinas vivas prevalecem.5,7
De forma geral pode assumir-se que o efeito imunossupressor e risco infecioso associados à ciclosporina depende da doença de base, eventualmente da dose administrada, e da associação com outros imunossupressores. O risco de infeção na doença autoimune, onde a ciclosporina é sobretudo administrada em monoterapia, torna-se desprezível, sendo a vigilância sintomática a única forma de controlo necessária.
Metotrexato
O metotrexato é um antimetabolito que interfere com a síntese de purina/pirimidinas inibindo a ativação de células T e função de granulócitos. Utilizado desde a década de 40 tem sido largamente útil no tratamento de doença neoplásica e autoimune. Estão descritos efeitos secundários associados ao fármaco de onde se destaca supressão medular, doença e fibrose pulmonar, fibrose hepática.62
Quanto ao risco de infeção, os estudos são contraditórios. No tratamento da artrite reumatoide o metotrexato parece aumentar o número de infeção respiratória,63,64sem alteração da taxa de mortalidade63; por outro lado, uma meta-análise não mostrou aumento de risco de infeção em doentes com patologia autoimune sob metotrexato, à exceção da artrite reumatoide62; uma revisão de literatura não mostrou aumento de risco de infeção quando usado metotrexato em baixa dose.65 Outros estudos mostram risco infecioso desprezível quando utilizado metotrexato no tratamento de artrite reumatoide.66-68
A posologia utilizada parece ter importância no grau de imunossupressão provocado e risco infecioso associado. Doses >0,4 mg/ kg/semana ou associação com outros fármacos imunossupressores resultam em maior risco e contraindicam a realização de vacinas vivas atenuadas.7
Risco de tuberculose
O risco de tuberculose foi descrito sobretudo para doentes com artrite reumatoide e tratamento com metotrexato tanto em monoterapia como em coadministração com outros imunossupressores.69,70
Contudo, quando os estudos são alargados a outras doenças autoimunes ou inflamatórias, nomeadamente do foro da dermatologia, os resultados divergem. Uma revisão por Fabrizio Cantini et al mostrou um risco relativo de ativação de 3,4 (categorizado como risco minor pelos autores) quando terapêutica de doença autoimune com metotrexato.13 Uma revisão de literatura mostrou igualmente baixo risco quando usadas doses de metotrexato <30 mg por semana.71
Assim o rastreio inicial com teste IGRA torna-se importante sobretudo em doentes oriundos de país endémico ou que tenham outros fatores de risco associados, contudo este não deve atrasar ou comprometer o início terapêutico.
Risco de reativação de infeção viral
Reativação de VHZ
A reativação de infeções virais, como por VHZ, encontra-se já bem descrita no doente imunocomprometido, nomeadamente com infeção por VIH, neoplasia hematológica e após transplante, existindo protocolos de profilaxia adequados a estes doentes. Já a patologia autoimune ou inflamatória e administração de metotrexato carecem de melhor esclarecimento.
Um estudo retrospetivo realizado em Israel que comparou a reativação de VHZ no tratamento da psoríase, mostrou aumento de risco nos doentes sob metotrexato em associação com biológico, sendo este desprezível quando usado em monoterapia.58 Um outro estudo prospetivo objetivou aumento de risco quando realizada terapêutica com metotrexato em monoterapia no tratamento da psoríase.59 Finalmente Antonelli e colaboradores mostraram aumento de zona em doentes com AR tratados com metotrexato em baixa dose, independentemente do tempo de terapêutica.72
Assim é aconselhável a profilaxia vacinal segundo as indicações previamente explanadas, se doença autoimune com necessidade de início de metotrexato e outros fatores de risco associados, como idade avançada ou comedicação com outros imunossupressores.30, 59
Reativação de VHB
A terapêutica imunossupressora pode induzir a reativação viral em doentes com infeção crónica pelo vírus da hepatite B (VHB) e, mais raramente, em pacientes com infeção passada. O metotrexato poderá contribuir, ainda que a informação disponível seja muito escassa. São raros os casos de reativação documentados na literatura, exemplificando-se apenas dois, um caso de AR e outro de artrite psoriática tratados com metotrexato em monoterapia.73,74Um estudo realizado na Tailândia composto por uma amostra de 173 doentes com patologia autoimune e contacto prévio com VHB (apenas um tinha AgHBs positivo) não mostrou importante risco de reativação quando usado metotrexato por longos períodos.75
O principal fator de risco parece ser o estadiamento VHB, sendo maior se presença de AgHBs. O metotrexato em monoterapia associa-se a baixo risco de reativação, podendo este aumentar com o uso concomitante de corticoide sistémico.37,74
Dessa forma é aconselhável o rastreio inicial com avaliação serológica (AgHBs, AcHBs e AcHBc). Se o doente tiver formas de doença crónica deverá ser proposto para vigilância ou profilaxia, de acordo com diferentes autores; se tiver apenas contacto prévio com o vírus assume-se baixo risco de reativação e não carece de profilaxia direcionada.37,41
CONCLUSÃO
Apesar de usados há largos anos, há ainda muito por saber sobre infeção associada à terapêutica com corticoide sistémico, metotrexato ou ciclosporina. Até à data pode assumir-se que o risco inerente depende da doença de base, da dose cumulativa e tempo de tratamento, bem como da combinação com outros imunossupressores.
O corticoide sistémico acarreta risco de infeção bacteriana, fúngica, viral e parasitária, estando já descritas formas de avaliação e profilaxia adequadas no que respeita à tuberculose, pneumocistose, reativação de infeção por VHZ e VHB, bem como estrongiloidíase. A ciclosporina e metotrexato associam-se a baixo risco infecioso, sobretudo quando usados em monoterapia e no tratamento de patologia não neoplásica. Assim, o conhecimento e vigilância de sintomas são as melhores formas de profilaxia nestes doentes. Não obstante, todos eles são fármacos imunossupressores que implicam cuidado na administração vacinal. De forma geral as vacinas vivas atenuadas são contraindicadas em qualquer forma de imunossupressão, enquanto as produzidas sob a forma polissacarídea podem ser administradas sem risco.
Desmistificar o risco de infeção na utilização de terapêutica imunossupressora permite a sua aplicação de forma mais informada e segura. A realização de estudos de avaliação torna-se assim crucial, permitindo identificar o real risco de eventos adversos que pode ser diferente do esperado.