INTRODUÇÃO
O melanoma é uma neoplasia que tem origem nas células produtoras de melanina (melanócitos), e ocorre preferencialmente na pele. Apesar de representar menos de 5% de todos os tumores cutâneos, está associado a uma maior mortalidade devido ao seu potencial metastático.1,2Nas últimas décadas, a incidência do melanoma tem vindo a aumentar de forma significativa, estimando-se que atinja os 6-8 casos por 100 000 habitantes, em Portugal, de acordo com o Registo Oncológico Regional.3
A exposição solar à radiação ultravioleta (UV) é considerada o principal fator de risco para o desenvolvimento de melanoma, sobretudo se for intensa e intermitente. Associadamente, a suscetibilidade genética (olhos e pele clara, cabelo ruivo), que confere uma maior sensibilidade à exposição solar, o número de nevos melanocíticos e a história familiar de melanoma também são importantes fatores de risco a considerar neste tipo de cancro cutâneo.2
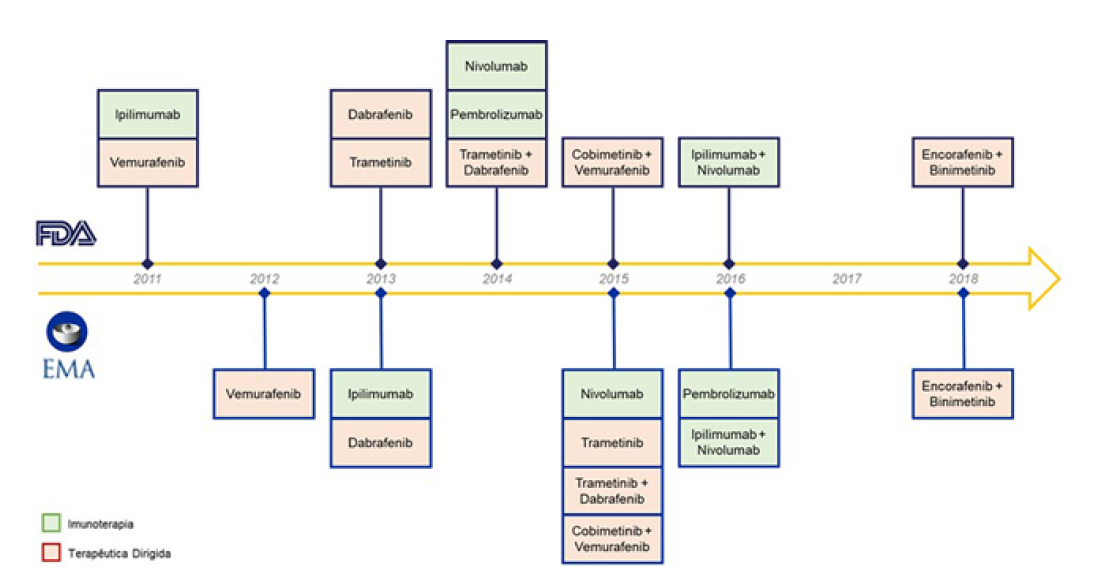
A taxa de sobrevivência está relacionada com o estádio da doença no momento do diagnóstico. No melanoma em estádio inicial, a cirurgia é potencialmente curativa, contrariamente ao melanoma em estádio IV ou metastático em que, até 2011, a taxa de sobrevivência aos 5 anos era cerca de 10%. Até essa data, os únicos tratamentos aprovados pela Food and Drug Administration (FDA) eram a quimioterapia sistémica e a imunoterapia com interleucina-2 (IL-2).1,4
Ao longo dos últimos anos surgiram novas abordagens terapêuticas que permitiram alterar o prognóstico dos doentes com melanoma metastático, nomeadamente a terapêutica dirigida e a imunoterapia baseada em inibidores do checkpoint imunológico.
Via MAPK
A via MAPK (Fig. 1) é uma via de sinalização intracelular essencial para o crescimento e proliferação celular. Em células normais, os estímulos externos, como fatores de crescimento, ligam-se ao recetor tirosina quinase (RTK), que leva à ativação de proteínas da família do sarcoma de rato (RAS): NRAS, KRAS, HRAS, podendo estas sinalizar duas vias diferentes: MAPK e PI3K, sendo esta última a segunda via mais frequentemente ativada no melanoma e a responsável pela homeostase celular. A via MAPK é ativada quando RAS dimeriza as proteínas quinases serina-treonina da família do fibrossarcoma acelerado (RAF), como ARAF, BRAF, CRAF, iniciando-se, assim, uma cascata de sinalização em que há fosforilação da quinase da proteína quinase ativada por mitogénos (MEK) que, por sua vez, atuam nas quinases reguladas por sinal extracelular (ERK). ERK é responsável pela transdução do sinal até ao núcleo contribuindo, desta forma, para a expressão de genes importantes para a proliferação, diferenciação e sobrevivência celular.2,5-9
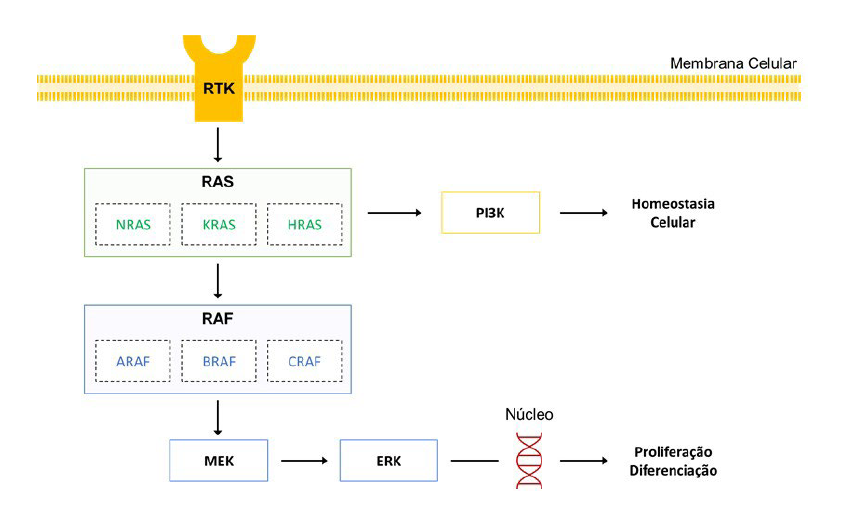
Figura 1 Via da proteína quinase ativada por mitogénos (MAPK). Adaptado de Arch V, et al. Molecular genetic and immunotherapeutic targets in metastatic melanoma. Virchows Arch. 2017;471:281-93.5
Mutação BRAF
As mutações BRAF ocorrem em 40%-60% dos melanomas cutâneos.
Em mais de 75% dos casos deve-se a uma mutação V600E em que há a substituição de valina por glutamina no códão 600.6 Estes casos estão mais associados à exposição à radiação UV intermitente e tende a afetar indivíduos mais jovens (<55 anos).2 A segunda mutação mais comum (5%-12%)2 é a V600K (substituição de valina por lisina) e, contrariamente à anterior, ocorre em indivíduos mais velhos e em pele exposta cronicamente aos raios UV.5 Existem outras mutações menos comuns como a V600D (substituição de valina por ácido aspártico) e a V600R (substituição de valina por arginina), que correspondem a menos de 5% dos casos.7
A descoberta e a melhor compreensão da biologia do melanoma com mutação BRAF permitiu desenvolver terapêuticas dirigidas, como os inibidores BRAF e MEK, contribuindo, desta forma, para uma melhoria significativa do prognóstico destes doentes.10
Tratamento do melanoma maligno metastático BRAF mutado
Historicamente, o melanoma metastático tem sido associado a um mau prognóstico por apresentar uma sobrevivência média de 8 a 10 meses e uma taxa de sobrevivência a 5 anos de 10%.11 Até 2011, os únicos tratamentos disponíveis para o melanoma em estádio IV eram a quimioterapia (QT) e a imunoterapia com IL-2.
A partir de 2011, a imunoterapia com inibidores dos pontos de verificação imunológicos e a terapêutica dirigida com inibidores BRAF e MEK passaram a ser o padrão de tratamento no melanoma metastático BRAF mutado.
1. Imunoterapia
Em condições normais, o sistema imunológico é capaz de controlar a duração e a magnitude das suas respostas, prevenindo, desta forma, a autoimunidade. Isto é conseguido pela interação de recetores específicos das células T com os seus ligantes, que ativam os chamados pontos de controlo imunológicos, com consequente bloqueio da resposta imune.12 Os dois recetores inibitórios das células T mais importantes são o antigénio 4 associado a linfócito T citotóxico (CTLA-4) e a proteína da morte celular programada 1 (PD-1).13
CTLA-4 e CD28, ambos expressos na superfície das células T naive, vão competir pela ligação ao CD80 (B7-1) e ao CD86 (B7-2) presentes nas células apresentadoras de antigénios (APC). A molécula CD28 é coestimulatória, pois ativa as células T, mas como CTLA-4 tem maior afinidade para os ligantes, vai haver um bloqueio da resposta imune por inibição das células T (Fig. 2).14-18
PD-1 é expresso na superfície das células T efetoras, das células B e das células natural killer (NK).16 Quando este recetor interage com os seus ligantes, PD-L1 e PD-L2, habitualmente presentes nas células tumorais, há inibição da proliferação das células T e, consequentemente, diminuição da resposta imune (Fig. 2).12
O melanoma consegue escapar ao controlo do sistema imunológico por hiperativação dos pontos de verificação imunológicos.12 O desenvolvimento de inibidores desses pontos de controlo veio revolucionar o tratamento dos doentes com melanoma metastático e tem sido um dos grandes avanços na área da imunoterapia.
Os inibidores dos pontos de verificação imunológicos são anticorpos monoclonais direcionados aos recetores PD-1 e CTLA-4, que impedem a sua ligação aos ligantes e são essenciais para a ativação do sistema imunológico e consequente destruição das células tumorais (Fig. 2).19
Atualmente estão disponíveis três anticorpos monoclonais para o tratamento do melanoma metastático: ipilimumab (anticorpo anti-CTLA-4), nivolumab e pembrolizumab (anticorpos anti-PD-1).
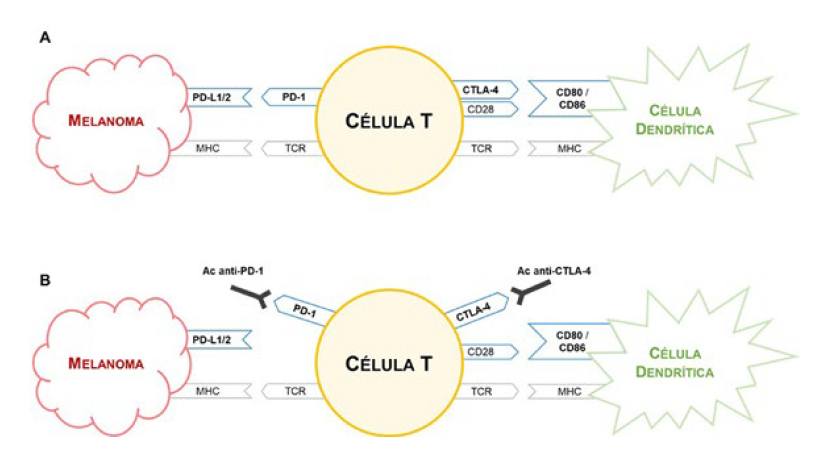
Figura 2 Regulação da resposta das células T. (A) Inibição da resposta das células T. (B) Anticorpos anti-PD-1 e anti-CTLA-4 ativam a resposta das células T. Adaptado de Davis LE, et al. Current state of melanoma diagnosis and treatment. Cancer Biol Ther. 2019;20:1366-79.20
1.1. Ipilimumab
Ipilimumab (YERVOY®) é um anticorpo monoclonal anti-CTLA-4 e foi o primeiro inibidor do ponto de verificação imunológico a ser aprovado, com base em dois ensaios clínicos de fase III: MDX010-2016,19,21-23e CA184-02411,16,17,19,21,24,25que demonstraram uma melhoria significativa na sobrevivência global (SG) em doentes com melanoma metastático.21 Com os resultados destes estudos, em 2011, a FDA aprovou o seu uso em doentes com melanoma metastático irressecável. Só mais tarde, em 2013, é que foi aceite pela Agência Europeia do Medicamento (EMA). O regime de tratamento aprovado consiste numa infusão de 3 mg/kg durante 90 minutos, a cada 3 semanas, num total de 4 doses.25
Apesar do ipilimumab ter sido o primeiro fármaco a ser aprovado para uso clínico no melanoma metastático, é necessário ter em consideração os efeitos adversos associados a este tratamento, nomeadamente os que estão relacionados com o sistema imunológico, por ativação do mesmo. Os efeitos adversos mais frequentemente relatados são ao nível intestinal (diarreia, colite), hepático (elevação das enzimas hepáticas, hepatite), hipofisário e de outras glândulas endócrinas (hipofisite, hipotiroidismo, tiroidite, insuficiência da suprarrenal) e cutâneo (erupção cutânea, prurido e vitiligo). Mais raramente pode verificar-se o aparecimento de uveíte, conjuntivite, citopenias, pneumonite, nefrite, pancreatite, neuropatia e miopatia.
Geralmente estes efeitos adversos são reversíveis com a interrupção ou descontinuação do tratamento, associado a imunossupressores como os corticosteroides.13,26,27
Posteriormente, com a aprovação de fármacos anti-PD1, o ipilimumab deixou de ser a terapêutica de primeira linha no melanoma metastático.
1.2. Nivolumab
Nivolumab (OPDIVO®) é um anticorpo monoclonal que tem como alvo o recetor PD-1. Foi aprovado pela FDA em 201417 e pela EMA em 201528 para o tratamento do melanoma maligno metastático, com base em dois estudos de fase III: CheckMate-0376,19,29,30e CheckMate-06629,31(Tabela 1).
Com base nestes dois estudos, que revelaram resultados promissores nomeadamente na duração da resposta e na tolerabilidade, as doses de nivolumab aprovadas pela FDA no melanoma metastático consistem em 240 mg a cada duas semanas ou 480 mg a cada quatro semanas, numa infusão durante 30 minutos, até à progressão da doença ou até a toxicidade não ser tolerada.32
No que diz respeito aos efeitos adversos relacionados com o nivolumab, é importante realçar que a taxa de eventos de grau 3-4 foi inferior (5%-10% dos doentes) às relatadas com o ipilimumab (22%- 24% dos doentes).14 Os EA mais comummente observados foram fadiga, prurido, erupção cutânea, artralgias, diarreia, náuseas e hipotiroidismo.11
1.3.Pembrolizumab
Pembrolizumab (KEYTRUDA®) foi o segundo anticorpo anti-PD-1 a ser aprovado pela FDA em 2014 e pela EMA em 2016 para o tratamento do melanoma maligno metastático. Os ensaios KEYNOTE-001, KEYNOTE-00222,31 e KEYNOTE00617,18,32,33 (Tabela 1) contribuíram para que este fármaco fosse aprovado para uso clínico no melanoma metastático na dose de 200 mg em infusão durante 30 minutos, a cada 3 semanas, até progressão da doença ou toxicidade não tolerada.34
No ensaio clínico KEYNOTE-006 foi possível constatar que, após descontinuação do tratamento com pembrolizumab ao fim de 24 meses, a maioria dos doentes que obteve resposta completa ou parcial (78,4%) manteve um controlo da doença durante 2 anos de acompanhamento. Estes resultados reforçam a ideia de que se obtém memória imunológica, que contribui para respostas sustentadas e prolongadas ao longo do tempo.16,33
Tabela 1 Estudos realizados com anticorpos anti-PD-1 para o tratamento do melanoma metastático
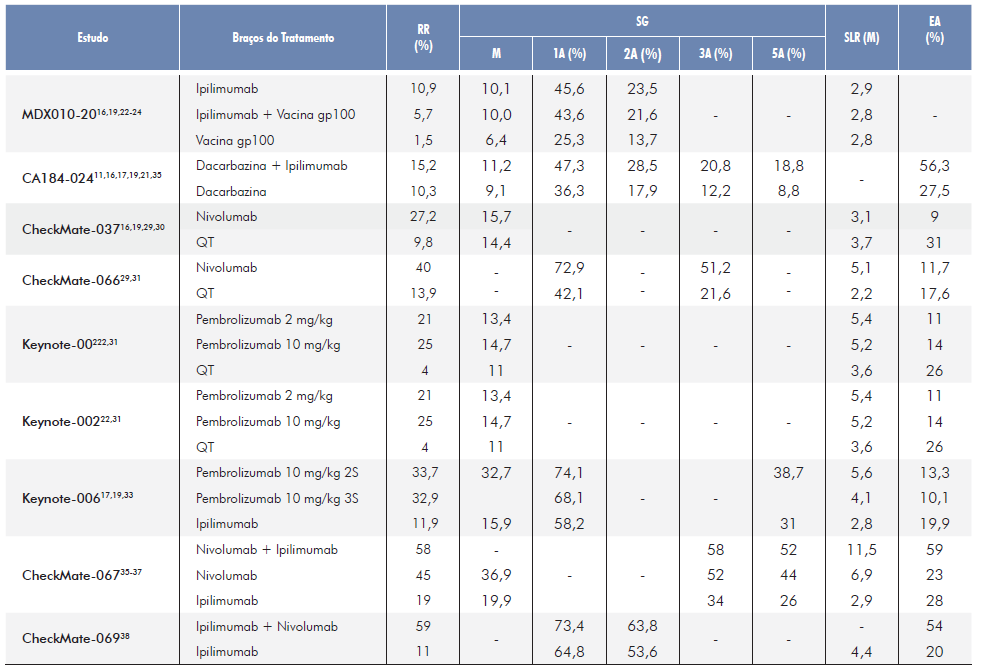
A: ano(s); M: média; RR: response rate; SG: sobrevivência global; SLR: sobrevivência livre de recorrência; EA: efeitos adversos
1.4. Nivolumab + Ipilimumab
Os resultados clínicos obtidos com os inibidores do ponto de controlo imunológico contribuíram para que se começasse a investigar a possibilidade de combinar diferentes agentes de imunoterapia com diferentes mecanismos de ação.16 Foram realizados três ensaios clínicos para avaliar a terapêutica combinada de nivolumab com ipilimumab: CheckMate-064, CheckMate-06735-37e CheckMate-069.38
Apesar de nos três estudos se ter verificado que a combinação de nivolumab e ipilimumab apresentou uma maior taxa de efeitos adversos (diarreia e elevação da lipase), a eficácia foi superior comparativamente ao nivolumab e ipilimumab em monoterapia.35,36
A FDA e a EMA aprovaram, em 2016, a combinação de nivolumab e ipilimumab para o tratamento do melanoma metastático, no seguinte esquema de dosagem: nivolumab 1 mg/kg em infusão durante 60 minutos, seguido de ipilimumab no mesmo dia, a cada 3 semanas, até 4 doses. A dose subsequente de nivolumab é de 240mg a cada 2 semanas, até progressão da doença.32
1.5. Pembrolizumab + Ipilimumab
A combinação de nivolumab e ipilimumab demonstrou melhor eficácia mas toxicidade elevada, pelo que foi conduzido um estudo,KEYNOTE-029, com o objetivo de avaliar a segurança e tolerabilidade de pembrolizumab em combinação com ipilimumab. Os doentes receberam pembrolizumab 2 mg/kg em combinação com ipilimumab 1 mg/kg, a cada 3 semanas, até 4 doses, seguido de pembrolizumab 2 mg/kg, a cada 3 semanas, até 2 anos ou até progressão da doença ou toxicidade não tolerada. Os resultados disponíveis até ao momento revelaram que a taxa de efeitos adversos de grau 3-4 foi de 27% e que a descontinuação do tratamento devido a EA ocorreu em 14% dos doentes com esta combinação, comparativamente a 8% e a 9% nos casos de descontinuação apenas de ipilimumab e pembrolizumab, respetivamente. Após um acompanhamento de 17 meses, a taxa de resposta foi de 61% e as taxas de sobrevivência global e sobrevivência livre de recorrência em 1 ano foram de 69% e 89%, respetivamente. Os resultados da SG e da SLR médias ainda não foram alcançados e esperam-se novos resultados em 2021, que corresponde à data estimada de conclusão deste estudo.16,39
2. Terapêutica dirigida
A compreensão da via MAPK e a descoberta de mutações somáticas BRAF levou ao desenvolvimento de novas abordagens terapêuticas.
Os inibidores BRAF foram desenvolvidos com o objetivo de inibir a via MAPK, nos doentes com melanoma metastático com mutação BRAF V600. Apesar de apresentarem uma rápida taxa de resposta, o principal desafio prende-se com o desenvolvimento de resistências ao fim de 6 a 8 meses após o início da terapêutica, sobretudo por reativação da via MAPK, com consequente progressão da doença. A combinação de inibidores BRAF (vemurafenib, dabrafenib e encorafenib e inibidores MEK (trametinib, cobimetinib e binimetinib) tornou-se a terapêutica padrão do melanoma metastático com mutação BRAF, por atrasar o desenvolvimento de resistências, ao permitir uma maior inibição da via MAPK, e por diminuir as toxicidades associadas à monoterapia com inibidores BRAF.7,8
2.1. Vemurafenib
Vemurafenib (ZELBORAF®) foi o primeiro inibidor BRAF a ser aprovado pela FDA, em 2011, e pela EMA, em 2012, na dose de 960mg, por via oral, duas vezes por dia40, com base no ensaio BRIM-3 (Tabela 2). Quase todos os doentes relataram pelo menos um efeito adverso, sendo os mais comuns a erupção cutânea, artralgias, alopécia, fadiga e reações de fotossensibilidade. Os efeitos adversos graves foram observados em 49% dos doentes do grupo do vemurafenib, dos quais os mais frequentes foram o carcinoma espinhocelular e o queratoacantoma (11%), que geralmente surgem ao fim de 8 a 12 semanas após o início do tratamento. Pensa-se que o desenvolvimento deste tipo de cancro cutâneo não melanoma se deve a uma ativação paradoxal da via MAPK.8,41
Tabela 2 Estudos realizados com inibidores BRAF e inibidores MEK para o tratamento do melanoma metastático com mutação BRAF
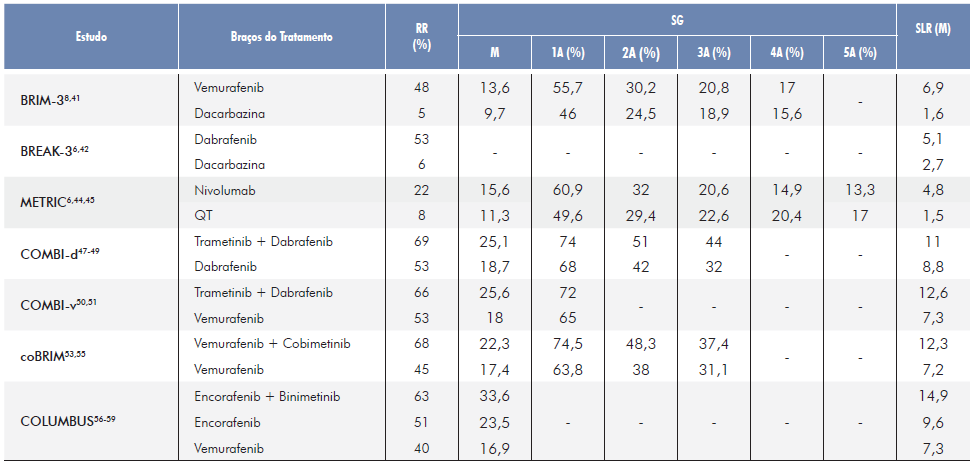
A: ano(s); M: média; RR: response rate; SG: sobrevivência global; SLR: sobrevivência livre de recorrência; EA: efeitos adversos
2.2. Dabrafenib
Com base no estudo BREAK-36,42(Tabela 2), dabrafenib (TAFINLAR®) foi o segundo inibidor BRAF a ser aprovado pela FDA e pela EMA, em 2013, na dose de 150 mg, por via oral, duas vezes por dia, por ter demonstrado uma taxa de resposta, SLR e SG superior relativamente à dacarbazina.43
Os efeitos adversos mais comuns com dabrafenib foram erupção cutânea, fadiga, cefaleias e artralgias. Em 6% dos doentes deste grupo constatou-se o aparecimento de carcinoma espinhocelular.6,42
2.3. Trametinib
Trametinib (MEKINIST®) foi o primeiro inibidor MEK a ser aprovado para uso clínico em doentes com melanoma metastático com mutação BRAF, com base no estudo METRIC, que avaliou a eficácia e a segurança de trametinib em monoterapia em comparação com a quimioterapia. Relativamente aos efeitos adversos associados ao tratamento com trametinib, os mais frequentemente observados foram erupção cutânea, diarreia, fadiga, edema periférico, náuseas e dermatite acneiforme.6,44,45
Após os resultados deste estudo (Tabela 2), que beneficiaram o trametinib, este foi aprovado pela FDA, em 2013, e pela EMA, em 2014, para o tratamento do melanoma metastático BRAF mutado, na dose de 2 mg, por via oral, uma vez por dia, até à progressão da doença ou até a toxicidade não ser tolerada.44,46
2.4. Trametinib + Dabrafenib
O inibidor MEK, trametinib, e o inibidor BRAF, dabrafenib, foram aprovados em monoterapia para o tratamento do melanoma metastático com mutação BRAF. Com base em dois estudos, COMBI-d47-49e COMBI-v,50,51a combinação destes fármacos mostrou benefício tanto ao nível da sobrevivência global como da sobrevivência livre de recorrência e da taxa de resposta, sem estar associada a um aumento da toxicidade global em relação às monoterapias de dabrafenib e vemurafenib, pelo que foi aprovada pela FDA, em 2014, e pela EMA, em 2015 no seguinte esquema de dosagem: dabrafenib 150 mg, por via oral, duas vezes por dia, associado a trametinib 2 mg, por via oral, uma vez por dia, até à progressão da doença ou toxicidade não tolerada.43,46
Os resultados permitiram constatar que com a combinação destes fármacos se observou uma menor incidência de efeitos adversos relacionados com a pele, nomeadamente hiperqueratose, queratoacantoma e carcinoma espinhocelular, assim como uma diminuição da frequência de alopécia, provavelmente por uma menor ativação paradoxal da via MAPK. Pelo contrário, verificou-se que os doentes apresentavam mais frequentemente febre, fadiga, náuseas, calafrios, diarreia e edema periférico.47,50
2.5. Cobimetinib + Vemurafenib
O cobimetinib (COTELLIC®) é um inibidor MEK que foi aprovado pela FDA e pela EMA, em 2015, em combinação com vemurafenib, para o tratamento do melanoma metastático com mutação BRAF, no seguinte esquema de dosagem: 60 mg, por via oral, uma vez por dia, durante 21 dias, seguido de um intervalo de 7 dias, até à progressão da doença ou toxicidade não tolerada.52
A eficácia desta combinação foi demonstrada pelos estudos BRIM-7 e coBRIM (Tabela 2), que permitiram, ainda, verificar que os efeitos adversos mais específicos relacionados com o inibidor MEK foram a retinopatia serosa, a diminuição da fração de ejeção do ventrículo esquerdo e o aumento dos valores de creatina quinase.53-55
2.6. Encorafenib + Binimetinib
O estudo COLUMBUS, um RCT de fase III, dividido em duas partes, foi desenvolvido com o objetivo de avaliar a eficácia e segurança da combinação de encorafenib (inibidor BRAF) e binimetinib (inibidor MEK), em doentes com melanoma metastático BRAF mutado. Verificou-se que a SG média, SLR e taxa de resposta foram superiores com esta combinação, quando comparada ao encorafenib e vemurafenib em monoterapia, assim como uma menor incidência de efeitos adversos.
Os mais frequentes foram efeitos gastrointestinais (diarreia, dor abdominal e obstipação), aumento da creatina quinase e visão turva.56-59
Comparando de uma forma geral os efeitos adversos mais frequentes entre os três grupos de combinação de inibidores BRAF e MEK, pode-se concluir que as reações febris são mais comuns com dabrafenib e trametinib, assim como a disfunção ventricular esquerda, que está particularmente relacionada com o trametinib. Por outro lado, reações de fotossensibilidade estão mais associadas à combinação de vemurafenib e cobimetinib. Por último, os efeitos gastrointestinais são observados com maior frequência com encorafenib e binimetinib. Em todos os grupos foi comum o aparecimento de toxicidades oculares, que já são conhecidas dos inibidores MEK.59
A combinação de encorafenib (BRAFTOVI®) e binimetinib (MEKTOVI®) foi aprovada pela FDA e pela EMA, em 2018, no seguinte esquema de dosagem: encorafenib 450 mg, por via oral, uma vez por dia, associado a binimetinib 45 mg, por via oral, duas vezes por dia, até à progressão da doença ou toxicidade não tolerada.60,61
CONCLUSÃO
Ao longo dos últimos anos, tem-se verificado uma alteração no paradigma do tratamento do melanoma metastático. Desde a aprovação do ipilimumab, em 2011, até à atualidade (Fig. 3), o prognóstico destes doentes mudou drasticamente.
Atualmente estão disponíveis vários padrões de tratamento de primeira linha para o melanoma metastático BRAF mutado: anti-PD-1 em monoterapia (nivolumab e pembrolizumab), combinação de anti-PD-1 e anti-CTLA-4 (nivolumab associado a ipilimumab), inibidores BRAF (vemurafenib e dabrafenib) e inibidores MEK (trametinib) em monoterapia ou em combinação (dabrafenibe com trametinibe, vemurafenibe com cobimetinibe e encorafenibe com binimetinibe).
Com base nos estudos clínicos desenvolvidos, a combinação de inibidores BRAF e MEK mostrou vantagem sobretudo no facto de apresentar taxas de resposta mais altas e permitir um rápido controlo tumoral.
No entanto, a durabilidade da resposta é limitada, que foi demonstrada pelos diversos estudos em que a sobrevivência livre de recorrência foi de aproximadamente 12 meses e a sobrevivência global de 24 meses, o que reflete a aquisição de mecanismos de resistência na maioria dos doentes, sobretudo por reativação da via MAPK.
Pelo contrário, a imunoterapia, apesar de ter um início de ação mais lento comparativamente à terapêutica dirigida, é responsável por respostas sustentadas e duráveis a longo prazo, por conseguir manter uma memória imunológica contra o tumor. Este facto é apoiado pela manutenção da resposta após a interrupção da imunoterapia.62
A decisão sobre a terapêutica sistémica de primeira linha a instituir nos doentes com melanoma metastático com mutação BRAF ainda permanece incerta. No entanto, nos casos de doença sintomática, com grande carga tumoral e com um rápido ritmo de progressão, associada a metástases no sistema nervoso central (SNC), tem-se optado por tratar com a combinação de inibidores BRAF e inibidores MEK, assim como nos doentes que progrediram após terapêutica inicial com
imunoterapia. Pelo contrário, nos doentes que têm um bom estado geral, sem metástases no SNC e em que não é necessário um controlo rápido da doença por apresentarem uma carga tumoral limitada e um ritmo mais lento de progressão, a terapêutica com inibidores do checkpoint imunológico é a preferida. É importante ainda referir que a rápida progressão tumoral está associada a fatores como o nível elevado de LDH, ECOG (do inglês Eastern Cooperative Oncology Group) ≥ 1 e a presença de metástases cerebrais.4,63
Alguns estudos demonstraram ainda que o início do tratamento com inibidores da via MAPK pode reduzir a resposta subsequente da imunoterapia. Um desses é o KEYNOTE-006 (pembrolizumab versus ipilimumab), em que os doentes com melanoma BRAF mutado, sem tratamento prévio, apresentaram uma sobrevivência livre de recorrência mais longa do que os que tinham recebido previamente um inibidor BRAF (7 meses versus 2,8 meses, respetivamente). Por outro lado, há outros dados que sugerem que a imunoterapia em primeira linha não tende a afetar a terapêutica seguinte com inibidores BRAF.4
Muito se tem especulado sobre a possível combinação da imunoterapia e da terapêutica dirigida, que tem potencial para aumentar as taxas de resposta e contribuir para uma sustentabilidade das mesmas.
Foi realizado, inicialmente, um estudo de fase I que testou a combinação de vemurafenib e ipilimumab, em doentes não previamente tratados, mas foi interrompido pela toxicidade hepática grave. Outro estudo de fase I foi desenvolvido com o intuito de avaliar a segurança da combinação de dabrafenib e ipilimumab, com e sem trametinib.
Como alguns doentes do braço triplo de tratamento apresentaram colite com perfuração, o estudo acabou também por ser encerrado.21
O estudo COMBI-I de fase III está ainda a decorrer e pretende demonstrar a eficácia da associação de espartalizumab (anti-PD-1) ao dabrafenib e trametinib. Ainda não estão disponíveis resultados e estima-se que a data de conclusão deste estudo seja em julho de 2023.64
Existem, ainda, estudos que têm demonstrado outras opções de tratamento no melanoma metastático, nomeadamente a terapêutica sistémica logo de início, com o intuito de minimizar a progressão e a carga tumoral, tornando, posteriormente, a cirurgia uma possibilidade nestes casos em que o melanoma se converte num tumor ressecável.
No entanto, a seleção dos doentes que são candidatos é de extrema importância. Por exemplo, os que apresentam doença oligometastática têm uma melhor SG com a cirurgia, assim como aqueles que têm um estadiamento M1a, contrariamente ao M1c. Assim, uma das hipóteses é, então, iniciar o tratamento com terapêutica dirigida com inibidores BRAF, com o objetivo de induzir uma resposta rápida e converter para uma doença oligometastática, sendo posteriormente indicada a cirurgia, seguida de tratamento com imunoterapia para aumentar a resposta imunológica.65 Serão necessários mais estudos que combinem a terapia sistémica com outros tratamentos, para se conseguir fazer propostas de tratamento baseadas na evidência.
Novas combinações de fármacos, sobretudo terapêutica dirigida associada a imunoterapia, assim como estudos de sequenciação (DREAMseq: dabrafenib e trametinib seguido de ipilimumab e nivolumab e sequência inversa; SECOMBIT: encorafenib e binimetinib seguido de ipilimumab e nivolumab e o inverso; ImmunoCobiVem: vemurafenib e cobimetinib seguido de atezolizumab e o contrário) estão em andamento em vários ensaios clínicos. Espera-se que, num futuro próximo, os resultados dos estudos clínicos que estão a ser desenvolvidos permitam tirar novas conclusões e definir com mais clareza qual o melhor tratamento a ser instituído como primeira linha nos doentes com melanoma metastático com mutação BRAF, culminando, assim, numa melhoria substancial do prognóstico.