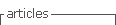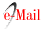Introdução
A disseção aórtica ocorre quando uma disrupção da camada íntima permite a passagem de sangue entre a camada média e o flap de íntima, o que leva à formação de um falso lúmen (FL).
Classicamente a disseção aórtica classifica-se quanto à anatomia, tempo de apresentação e sintomatologia. Anatomicamente, subdivide-se, pela classificação de Stanford, em tipo A (porta de entrada localizada na aorta ascendente) e tipo B (na aorta torácica descendente).1 Quanto ao tempo de apresentação, classifica-se como aguda (<14 dias), subaguda ou crónica (>90 dias).2
Na presença de rutura, síndrome de malperfusão (visceral, renal, medular ou dos membros), dor e/ou hipertensão recorrente/refratária, progressão da disseção (proximal ou distal) ou expansão aórtica rápida (falso aneurisma), a disseção aórtica aguda tipo B (DAAB) é considerada complicada. Os restantes casos são considerados DAAB não complicada.3
A DAAB representa 30-40% das disseções aórticas4 e cerca de metade destas são não complicadas.5,6 A DAAB apresenta elevada taxa de mortalidade (3-10% aos 30 dias nos casos de DAAB não complicada5,6, chegando aos 25% nos casos de DAAB complicada), principalmente na fase aguda.7,8
O tratamento inclui sempre terapêutica médica: controlo da dor, da tensão arterial sistólica e da frequência cardíaca, de forma a reduzir o stress na parede aórtica.9 Nos casos de DAAB complicada, está ainda indicado o tratamento cirúrgico.10
Caso clínico
Apresentamos o caso de uma doente de 70 anos, do sexo feminino, autónoma nas atividades de vida diária, com antecedentes pessoais relevantes de hipertensão arterial, dislipidemia e obesidade, medicada habitualmente com amlodipina, furosemida, ramipril e atorvastatina. A doente recorreu ao serviço de urgência de um hospital periférico por quadro de dor abdominal, hematemeses e diarreia de início súbito. À admissão, apresentava-se desorientada, hipotensa, taquicardica, sudorética e com dor generalizada à palpação abdominal, mais intensa ao nível do epigastro. Após colocação de sonda nasogástrica, com saída de conteúdo biliar com vestígios hemáticos, foi realizada endoscopia digestiva alta, que não identificou hemorragia ativa nem lesões estruturais. A angio-TC toraco-abdomino-pélvica (figura 1) mostrou disseção aórtica tipo B, com origem após a emergência da artéria subclávia esquerda e com extensão até às artérias ilíacas primitiva esquerda e externa direita. As artérias viscerais emergiam do verdadeiro lúmen (VL) - que se encontrava colapsado a este nível - com exceção da artéria renal direita, que tinha origem no FL. Destacava-se ainda dilatação aneurismática (6 cm) da aorta torácica descendente proximal e volumoso hemotórax esquerdo.
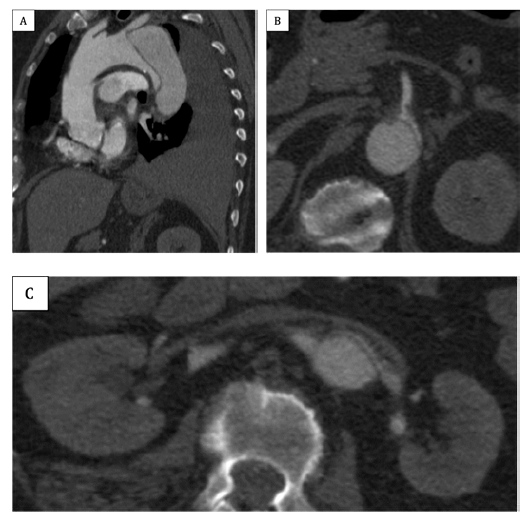
Figura 1 Angio-TC: A. Disseção aórtica tipo B com origem após a emergência da artéria subclávia esquerda e com falso aneurisma (6 cm da aorta torácica descendente proximal; hemotórax esquerdo; B. Origem da artéria mesentérica superior (AMS) no VL, que se encontra colapsado; C. Emergência da artéria renal direita no FL e da artéria renal esquerda no VL, que se encontra colapsado.
Após ressuscitação volémica, estabilização e realização destes exames complementares de diagnóstico, a doente foi transferida para o serviço de Cirurgia Vascular de um hospital central, tendo sido admitida na madrugada do dia seguinte.
À chegada, mantinha dor à palpação abdominal e apresentou hematoquezias.
Considerando o diagnóstico de disseção aórtica complicada de falso aneurisma, rotura e isquemia intestinal, a doente foi proposta para tratamento cirúrgico urgente. Após planeamento cirúrgico através do programa Horos e pedido de material, a doente foi operada nessa manhã.
A cirurgia (figura 2) foi realizada sob anestesia geral e por acesso femoral percutâneo bilateral ecoguiado. Pelo acesso femoral direito foi cateterizado o FL e o VL foi cateterizado pelo acesso femoral esquerdo. De seguida procedeu-se à implantação da endoprótese torácica (ZDEG 42-164-PF, Cook Medical, Bloomington, IN) na zona 2 e extensão com stent descoberto aórtico (ZDES 36-180, Cook, Inc., Bloomington, IN). Na angiografia de controlo verificou-se deslocamento distal de cerca de 1 cm da endoprótese, que ficou posicionada justa origem da artéria subclávia esquerda (zona 3), e migração do stent descoberto, que ficou posicionado na aorta infrarrenal e artéria ilíaca esquerda. De seguida, foi implantado um stent descoberto aórtico (ZDES-46-185, Cook Medical, Bloomington, IN) na aorta descendente até à aorta infrarrenal. Através do VL, foi cateterizada a artéria renal direita através da fenestra do flap correspondente ao óstio da artéria renal e implantado um stent coberto expansível por balão (Advanta V12 7x32mm; Atrium Medical Corporation, Hudson, NH). Por fim, procedeu-se à implantação de stents na artéria ilíaca primitiva bilateralmente (Advanta V12 9x59mm; Atrium Medical Corporation, Hudson, NH) e na artéria ilíaca externa direita (Protégé GPS 10x80mm, Medtronic, Minneapolis, Minn). Na angiografia final confirmou-se exclusão do falso aneurisma e da porta de entrada, bem como expansão do VL. O acesso femoral esquerdo foi encerrado com dois dispositivos de encerramento vascular mediado por sutura (Perclose ProStyle, Abbott Vascular, CA, USA) e direito por um dispositivo de encerramento com colagénio (Angioseal VIP, St. Jude Medical, St. Paul, MN). No final do procedimento, foi colocado um dreno torácico esquerdo, com saída imediata de 600cc de conteúdo hemático.
A cirurgia teve uma duração de 4 horas e foram administradas, no total, 7500 unidades de heparina não fracionada. As perdas hemáticas estimadas foram de 1L, o valor mínimo de hemoglobina intraoperatório foi 8.4 g/dL e houve necessidade de transfusão de 3 unidades de concentrado eritrocitário, 1 pool de plaquetas, 1 unidade de plasma, 2g de fibrinogénio e 2g de complexo protrombínico ativado.
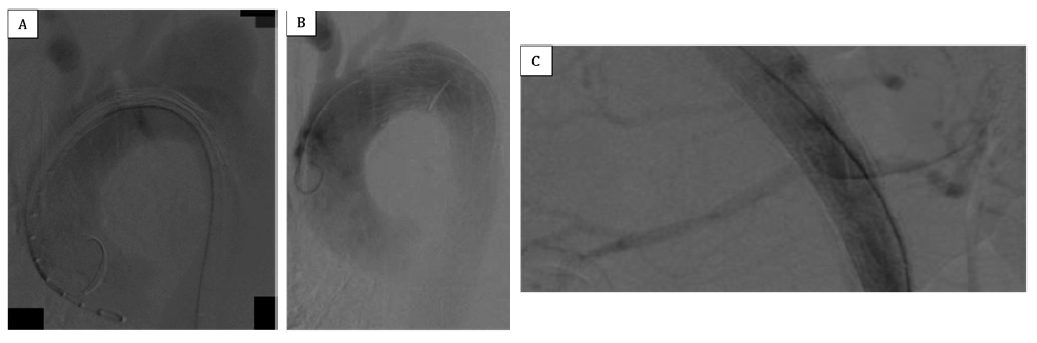
Figura 2 (A) Angiografia pré e (B) pós-TEVAR. PETTICOAT e angioplastia com stent das artérias renal direita (C).
O pós-operatório precoce decorreu na unidade de cuidados intensivos, tendo sido extubada nas primeiras 48 horas. Após reduzir a sedação, ao 2º dia de pós-operatório, foi objetivada plegia do membro superior esquerdo e paresia do membro inferior esquerdo. A angio-TC cranio-encefálica realizada no imediato não mostrou áreas de enfarte agudo, oclusão de artérias intracranianas ou disseção retrograda com extensão aos vasos do pescoço. A TC cranio-encefálica de reavaliação após 24h também não mostrou lesões agudas. Uma vez que o défice neurológico não reverteu no período de 24 horas, foi diagnosticado AVC isquémico do hemisfério direito sem tradução imagiológica. Durante o internamento, iniciou reabilitação motora com recuperação franca do défice motor (força grau 4 no membro superior esquerdo e grau 3 no membro inferior esquerdo) à data de alta.
Ainda no internamento realizou angio-TC toraco-abdomino-pélvica de controlo que demonstrou exclusão do falso aneurisma (sem endoleak), expansão do VL (com adequada perfusão das artérias viscerais) e FL permeável.
A doente teve alta ao 21º dia pós-operatório, sem mais intercorrências, com indicação para controlo rigoroso da tensão arterial, antiagregação plaquetária e manter reabilitação motora e seguimento em consulta externa de Cirurgia Vascular.
A angio-TC de controlo, aos 2 meses (figura 3), mantém exclusão do falso aneurisma (sem endoleak), VL adequadamente expandido (com permeabilidade de todas as artérias viscerais), trombose parcial do FL (exceto em zonas focais de preenchimento retrógrado pelas artérias intercostais e lombares, principalmente ao nível da aorta abdominal) e derrame pleural residual
Discussão
A DAAB complicada tem elevada taxa de mortalidade pelo que, além do tratamento médico inicial, está indicado o tratamento cirúrgico.
A cirurgia aberta está associada a taxas de mortalidade até 25% aos 30 dias11, muito superiores à cirurgia endovascular (até 10% aos 30 dias12), pelo que as recomendações mais recentes favorecem o tratamento endovascular como 1ª linha sempre que possível. A cirurgia aberta no tratamento da DAAB fica assim reservada para os casos de falência do tratamento endovascular ou quando este não é possível (por razões anatómicas ou doença do tecido conjuntivo).13
O tratamento endovascular mais consensual e amplamente estudado atualmente é a implantação de uma endoprótese na aorta torácica, de forma a cobrir a porta de entrada. Esta técnica permite direcionar o fluxo para o VL e despressurizar o FL, o que causa expansão do VL e diminui o risco de extensão disseção. Objetivos adicionais desta técnica, a longo prazo, são a trombose do FL e o remodeling positivo da aorta, que se associam a menores taxas de degenerescência aneurismática e rotura na fase crónica.14,15 Neste caso, além de cobrir a porta de entrada, a endoprótese torácica permitiu o tratamento (exclusão) do falso aneurisma e da rutura aórtica.
Mais recentemente, foi desenvolvida uma variação desta técnica, chamada provisional extension to induce complete attachment technique (PETTICOAT), que consiste na extensão distal da endoprótese torácica com stents descobertos, ao longo da aorta dissecada, para aumentar rapidamente o diâmetro do VL, diminuindo o risco de mortalidade relacionada com malperfusão, sem cobrir as artérias intercostais e lombares lombares, logo sem aumentar o risco de isquemia medular.16,17 O consenso atual é que o PETTICOAT deve ser usado seletivamente na disseção aguda com expansão sub-ótima do VL e com persistente défice de perfusão após a implantação da endoprótese.18 Adicionalmente, esta técnica parece ter outras vantagens, nomeadamente a longo prazo, por apresentar maior taxa de remodeling aórtico e menores taxas de crescimento aórtico/degenerescência aneurismática, quando comparada com o uso isolado da endoprótese torácica.19
Neste caso, como existia um quadro de malperfusão visceral associado a dor abdominal e hematoquézias, com mais de 12h de evolução, optou-se pela realização da técnica PETTICOAT, com resolução imediata da síndrome de malperfusão.
Durante a cirurgia, verificou-se migração da endoprótese e do stent descoberto. Uma explicação para esta complicação é que tenha sido subestimado o diâmetro da aorta na zona 2 pela presença de choque hipovolémico no momento da angio-TC. O choque hipovolémico pode originar uma contração da aorta, com risco de subestimar o seu diâmetro real em cerca de 5-40%,20,21 levando a que tenham sidos selecionadas próteses e stents de diâmetro inferior ao ideal.
Apesar da migração distal da endoprótese, esta ficou ancorada imediatamente após a emergência da artéria subclávia esquerda, e não mostrou endoleak na angiografia de controlo, pelo que apresentou selagem adequada. Por outro lado, a migração do stent aórtico para a aorta infra-renal e artéria ilíaca primitiva esquerda determinou um ajuste no planeamento cirúrgico inicial, tendo sido implantado outro stent aórtico, de maior diâmetro, na aorta torácica distal e visceral.
A cirurgia foi ainda complicada de AVC isquémico do hemisfério direito, sem tradução imagiológica. Esta é uma complicação bem descrita associada ao tratamento endovascular da DAAB (0,5-3% dos casos22). Entre outras complicações/morbilidade associadas a este tipo de tratamento, destacam-se o risco de isquemia medular23, disseção retrograda24 e rutura aórtica.25
O tratamento da DAAB não termina na fase aguda uma vez que 20-50% das DAAB desenvolvem complicações relacionadas com a aorta (degenerescência aneurismática, progressão da disseção e rutura do FL) na fase crónica.26 Para diminuir este risco, deve ser mantida terapêutica médica com controlo rigoroso da tensão arterial (TAS <130mmHg e TAD <85mmHg), incluindo sempre beta-bloqueantes, que se associam a menor o risco de eventos aórticos.27 Deve ainda ser mantido seguimento imagiológico e clínico regular, em consulta de Cirurgia Vascular, de forma a diagnosticar e tratar precoce e eletivamente a degenerescência aneurismática ou progressão da disseção.
Em doentes tratados apenas com terapêutica médica, preconiza-se reavaliação imagiológica (angio-TC ou angio-RMN) aos 3, 6 e 12 meses e depois anualmente. Nos doentes submetidos a tratamento endovascular, esta avaliação deve ser feita no 1º mês e depois anualmente. Em ambas as situações, se a disseção se mantiver estável aos 3 anos, pode espaçar-se a reavaliação para cada 2-3 anos.28,29 Além disso, é essencial manter o controlo dos fatores de risco cardiovasculares, que são uma causa importante de mortalidade tardia nos doentes com disseção aórtica cronica.
Conclusão
Este caso mostra uma DAAB complicada que foi tratada, através das técnicas de TEVAR e PETTICOAT, com resolução imediata e precoce das complicações (falso aneurisma, rotura e malperfusão visceral). Apesar do sucesso do tratamento inicial, esta doente, à semelhança de todos os doentes com disseção aórtica, tem indicação para manter controlo rigoroso da tensão arterial e da frequência cardíaca, vigilância imagiológica e seguimento regular em consulta de Cirurgia Vascular pelo risco a longo prazo de degenerescência aneurismática e rotura.