Introdução
A menopausa é um biomarcador, na vida da mulher, de transição da capacidade reprodutiva para a falência ovárica. O diagnóstico é clínico e retrospetivo, após um ano de amenorreia. Em mulheres caucasianas, e considerando as variações étnicas e regionais, ocorre habitualmente entre os 45 e os 55 anos, sendo a idade média de 51 anos1. Em Portugal, um estudo realizado por Martins et al.2, em mulheres da região centro, mostrou que a média de idades na menopausa é de 49,5 anos.
A esperança de vida da mulher tem aumentado progressivamente, pelo que importa investir na qualidade de vida após a menopausa, já que esta corresponde a cerca de um terço da vida da mulher. Embora a menopausa represente um evento fisiológico, os sintomas associados são por vezes incómodos e pouco tolerados, podendo limitar o desempenho nas atividades quotidianas1.
O período de transição, chamado climatério, associa-se frequentemente a um conjunto de sinais e sintomas relacionados com a diminuição da reserva folicular ovárica e consequente hipoestrogenismo. A curto prazo salienta-se sobretudo a sintomatologia vasomotora (SVM), as alterações do sono e emocionais3. Estudos longitudinais, realizados em todo o mundo e em diversas populações, confirmam que as mulheres têm 2 a 5 vezes mais probabilidade de apresentar perturbações depressivas durante a menopausa3,4. A médio prazo pode surgir a síndrome génito-urinária da menopausa (SGUM), alterações cutâneas, atrofia vulvovaginal e disfunção sexual5,6. Como manifestações mais tardias, destacam-se as complicações cardiovasculares, a osteoporose e doenças neurocognitivas5,6,7.
A Terapia Hormonal (TH) é o tratamento mais eficaz para o controlo dos sintomas de hipoestrogenismo associados à menopausa, mas deve ser recomendada apenas sob uma clara indicação médica, nomeadamente: SVM moderados a graves; SGUM; Prevenção da osteoporose e redução de fraturas na pós-menopausa; Hipogonadismo ou Insuficiência ovárica prematura1.
A TH pode conter diferentes composições hormonais: os estrogénios (o natural/micronizado - 17 b-estradiol e estriol; os sintéticos - valerato de estradiol, estrogénios equinoconjugados-EEC e o etinilestradiol); os progestativos (o natural/micronizado - progesterona micronizada - PM; os sintéticos - didrogesterona, derivados da progesterona, derivados da 17a-Hidroxiprogesterona, como o acetato de medroxiprogesterona - AMP, derivados da 17a-Hidroxinorprogesterona, derivados da 19-norprogesterona, derivados da 19-nortestosterona e a drosperinona); os estroprogestativos (TH combinada); a tibolona; os moduladores seletivos dos recetores de estrogénios (SERMs; mais utilizados - tamoxifeno, raloxifeno e o bazedoxifeno); o complexo estrogénico seletivo do tecido - TSEC (EEC + acetato de bazedoxifeno); os androgénios; a terapêutica local e as hormonas bioidênticas1.
A TH combinada pode adotar dois regimes terapêuticos: o sequencial cíclico (que associa à terapia estrogénica um progestativo 10-14 dias por mês) ou o contínuo combinado (em que o progestativo é administrado diariamente em conjunto com o estrogénio) 1.
A TH mostra ser a terapêutica mais eficaz para o tratamento dos SVM e SGUM8,9. Pode ainda melhorar as dores musculares e articulares, perturbações de humor ou do sono e a disfunção sexual5,9. O controlo da sintomatologia ocorre, na maioria das mulheres, após um período de tratamento de 3-5 anos1. Quando indicado, este tratamento deve ser individualizado, com a escolha da TH mais adequada, de acordo com a sintomatologia, história pessoal e familiar, de modo a maximizar os benefícios e minimizar os riscos, e com reavaliações periódicas para aferir os resultados e decidir sobre continuação ou interrupção do tratamento8,10. Independentemente de quaisquer avanços farmacológicos, deve ser enfatizada a importância em adotar um estilo de vida saudável, com exercício e nutrição adequados8,10.
No passado, a TH foi usada em cerca de 1 em cada 5 mulheres com mais de 50 anos, no tratamento de sintomas vasomotores e na prevenção de doença cardiovascular e osteoporose. No entanto, resultados controversos dos estudos “Women’s Health Initiative (WHI)” em 200211 e o “Million Women Study (MWS)” em 200312 alertaram para um risco aumentado de cancro da mama (CM) e de eventos cardiovasculares adversos com o uso de TH. A publicação destes estudos teve um grande impacto na prescrição da TH nos cuidados de saúde primários13, tendo-se verificado uma diminuição significativa da sua prescrição em mulheres menopáusicas sintomáticas, e um aumento de afluência à consulta com sintomatologia psiquiátrica, com maior prescrição de ansiolíticos13.
Relativamente aos dois estudos acima descritos, a análise de fatores como o tipo de terapia e dose utilizadas, modo de administração, duração do tratamento, idade das mulheres tratadas, follow-up cumulativo e comparação com outros estudos mais recentes, sugere uma revisão mais detalhada, de forma a esclarecer as circunstâncias dos riscos da prescrição de TH. Assim, o presente estudo visa determinar, à luz da evidência mais atual, o risco de CM e/ou ginecológico nas mulheres medicadas com TH na pós-menopausa.
Metodologia
Para a condução da presente revisão sistemática não quantitativa foi realizada uma pesquisa bibliográfica nas seguintes bases de dados: Pubmed, Cochrane Library, Bandolier, DARE, TRIP database, Evidence Based Medicine Online, Clinical Evidence, NICE, National Guideline Clearinghouse e Canadian Medical Association Practice Guidelines Infobase. Utilizaram-se os termos MeSH “hormone replacement therapy, post menopausal”, “genital neoplasms, female”, “breast neoplasms”, “endometrial neoplasms”, “cervical uterine neoplasms”, e “ovarian neoplasms”. Limitou-se a pesquisa a Normas de Orientação Clínica (NOCs)/guidelines/consensos; revisões sistemáticas (RS) e meta-análises (MA); estudos originais, incluindo ensaios clínicos controlados aleatorizados (ECCA), estudos de coorte e estudos caso-controlo. Foram selecionados os artigos publicados entre janeiro de 2015 e outubro 2021, em língua portuguesa e inglesa.
Os critérios de inclusão foram definidos segundo o modelo PICO (População, Intervenção, Comparação, Outcome). Foram incluídos estudos referentes a mulheres na pós-menopausa e sem antecedentes pessoais de cancro da mama e/ou ginecológico (População), sob TH (Intervenção), em comparação com mulheres não submetidas a TH (Comparação), medindo o aumento do risco de cancro da mama e/ou ginecológico, assim como a mortalidade associada a esses cancros (Outcome).
Foram excluídos os artigos que não cumpriram os critérios de seleção estabelecidos pelos autores ou artigos já incluídos em RS selecionadas.
Foi utilizada a Strength Of Recommendation Taxonomy (SORT), da American Family Physician (Quadro I), para avaliação da qualidade dos estudos selecionados e posterior atribuição de níveis de evidência (NE) e forças de recomendação (FR) 14.
Resultados
Dos 84 artigos encontrados, 65 foram excluídos por não cumprirem os critérios de inclusão, por serem repetidos ou por já se encontrarem incluídos em RS selecionadas. Obtiveram-se, portanto, 19 publicações, agrupadas de acordo com a tipologia do artigo.
As 6 NOC’s/Guidelines/Consensos selecionadas encontram-se sumariados na Quadro II e, segundo a SORT, esta tipologia de artigos enquadra-se no NE 3, uma vez que nem sempre são baseadas em evidência científica, sendo realizadas por consenso informal de peritos14. Incluíram-se 4 RS com MA (Quadro III), tendo-lhes sido atribuído um nível de evidência 214, dado que se basearam em estudos de moderada qualidade ou com elevada heterogeneidade entre si. Foram ainda selecionadas 5 revisões sistemáticas que se classificaram com diferentes níveis de evidência, de acordo com a qualidade dos artigos, e que se encontram descritos no Quadro IV e detalhados no texto. Os resultados consideram também 4 estudos originais, cujos resultados não estavam incluídos nos restantes trabalhos e que estão descritos no Quadro V, assim com o seu NE.
Quadro II Normas de orientação clínica, Guidelines e Consensos.
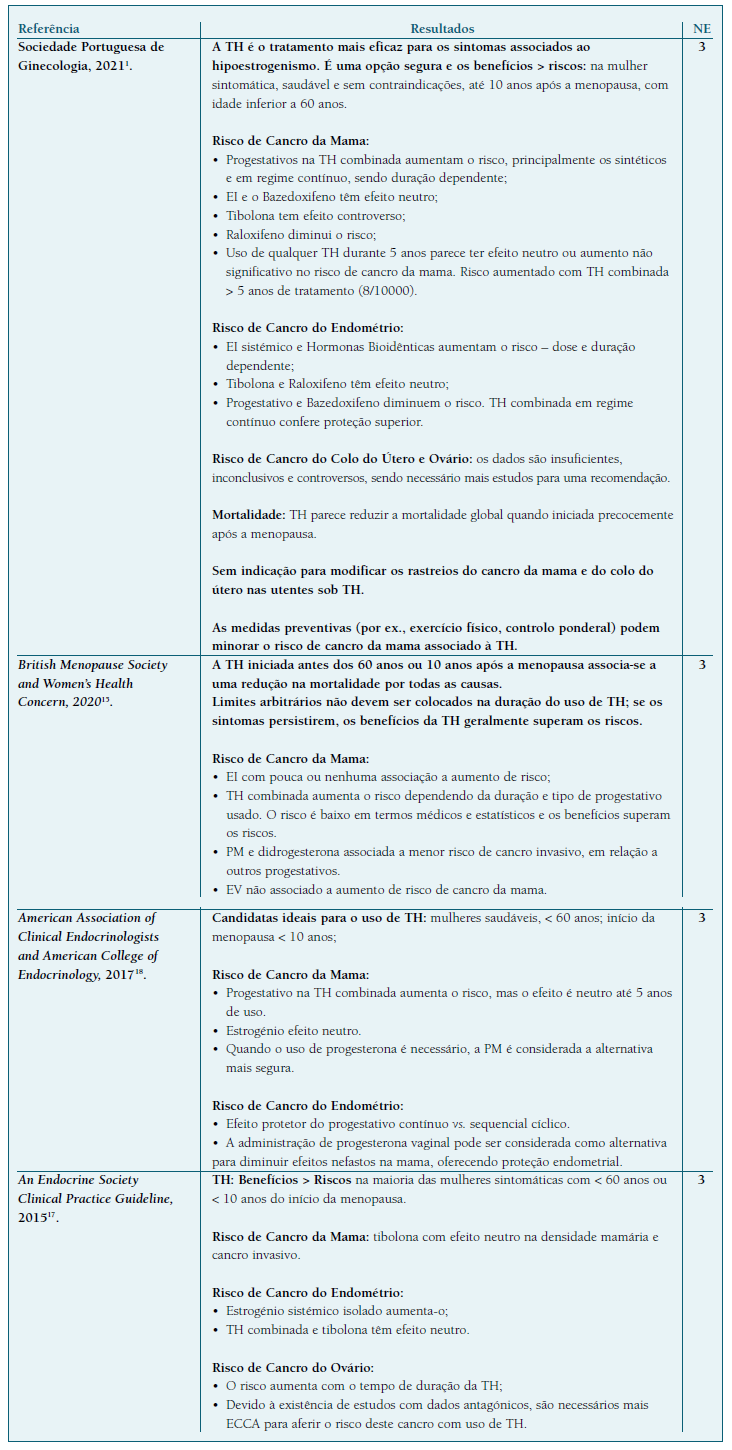
Legenda: NE - Nível de evidência; TH - Terapia Hormonal; PM - Progesterona Micronizada; EI - Estrogénio Isolado; EV - Estrogénio. Vaginal; ECCA - Ensaio Clínico Controlado Aleatorizado; WHI - Women’s Health Initiative.
Quadro III Revisões sistemáticas com Meta-análises .
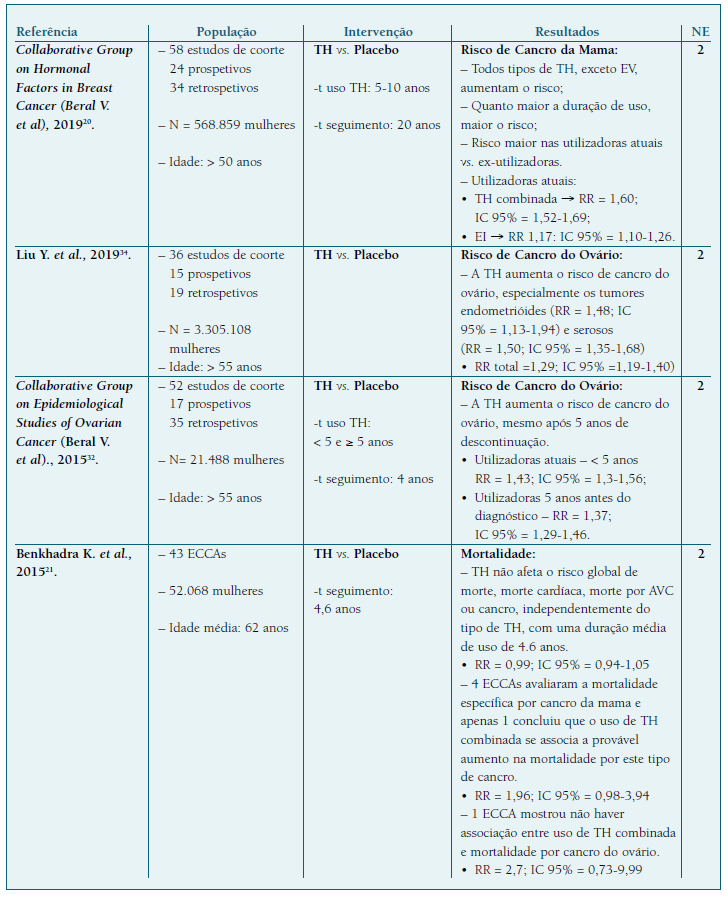
Legenda: NE - Nível de evidência; PM - Progesterona Micronizada; EI - Estrogénio Isolado; EV - Estrogénio Vaginal; ECCA - Ensaio Clínico. Controlado Aleatorizado; TH - Terapia Hormonal; AVC - Acidente Vascular Cerebral; t - tempo.
Quadro IV Revisões sistemáticas.
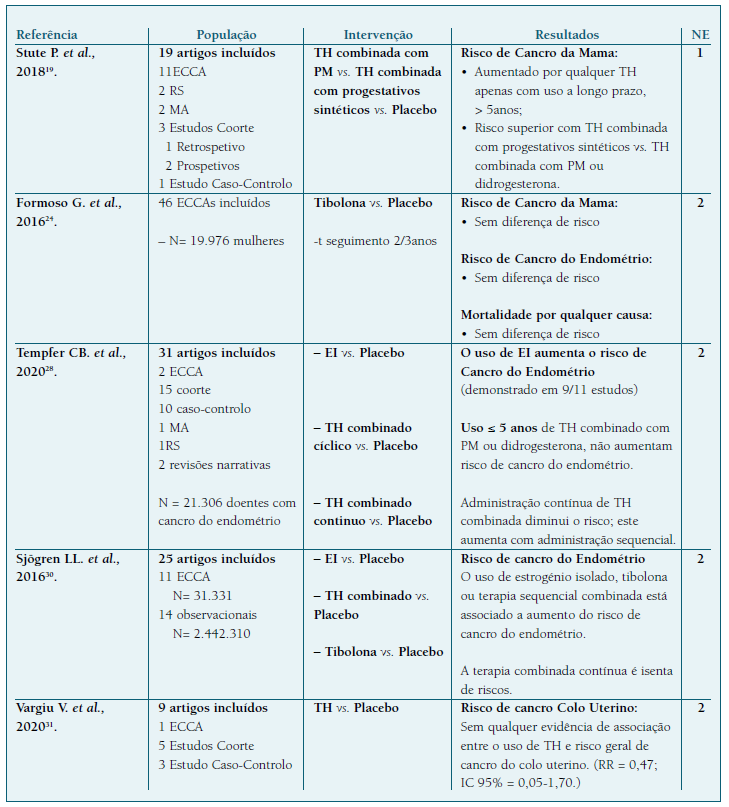
Legenda: NE - Nível de evidência; ECCA - Ensaio Clínico Controlado Aleatorizado; TH - Terapia Hormonal; RS - Revisões Sistemáticas; MA - Meta-Análises; PM - Progesterona Micronizada; EI - Estrogénio Isolado; EV - Estrogénio Vaginal; t - tempo.
Quadro V Estudos Originais: ECCA, Estudo de Coorte e Estudo Caso-Controlo.
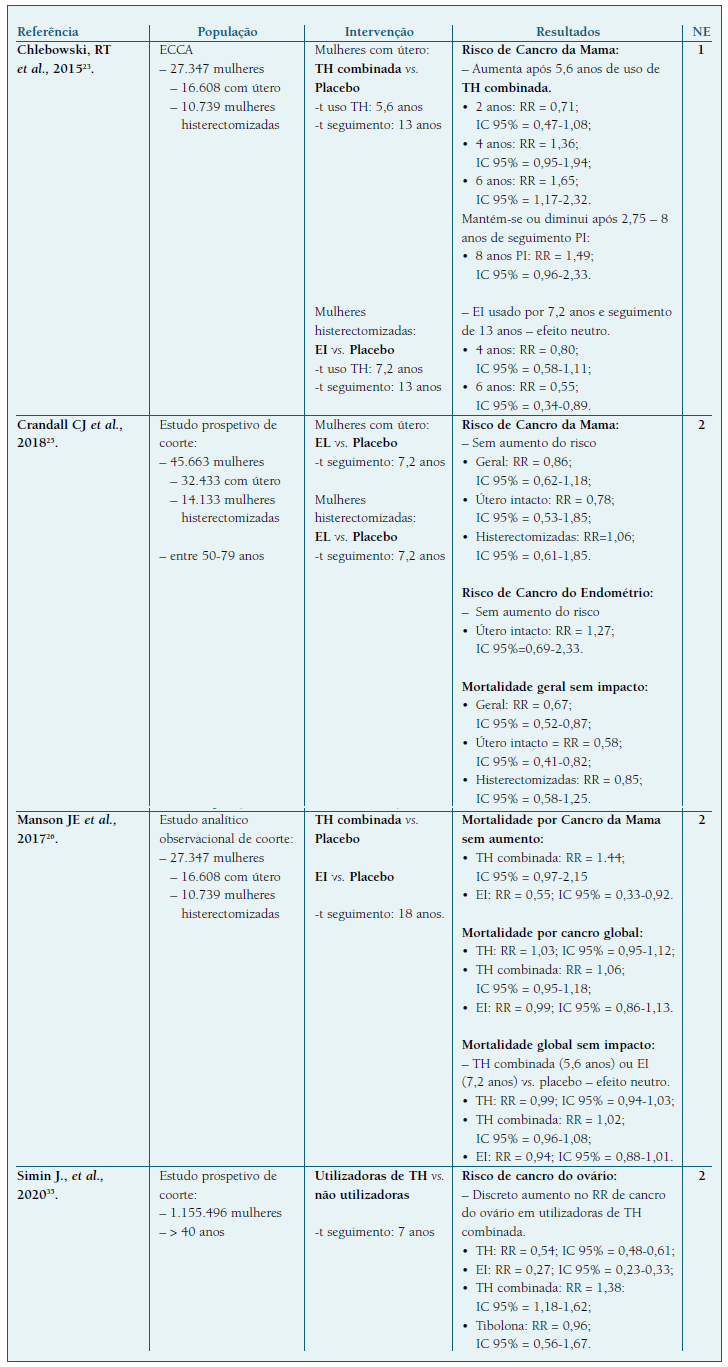
Legenda: NE - Nível de evidência; ECCA - Ensaio Clínico Controlado Aleatorizado; TH - Terapia Hormonal; EI - Estrogénio Isolado; EL - Estrogénio Local; PI - pós intervenção; t - tempo.
Segundo os documentos elaborados por comités de peritos, nas mulheres sintomáticas sem contraindicações para o uso de TH, os benefícios gerais do tratamento superam os riscos caso a terapia hormonal seja iniciada antes dos 60 anos ou nos primeiros 10 anos após o início da menopausa15,16,17.
Cancro da Mama
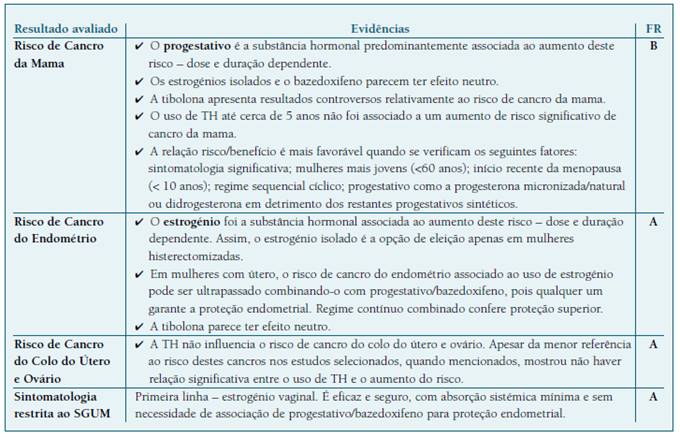
De acordo com a Liga Portuguesa contra o Cancro, o Cancro da Mama (CM) é a neoplasia mais comum entre as mulheres, e corresponde à segunda causa de morte por cancro, no sexo feminino. Importa por isso, compreender a contribuição do uso da TH no aumento de risco de CM, tema sobre o qual incidia a maioria dos trabalhos encontrados. As NOCs/Guidelines/Consensos, consideram que o aumento do risco de CM se associa ao uso de progestativo na TH combinada1,6,15,16,17,18, particularmente progestativos sintéticos como o AMP1,18, sendo dose e duração dependente1,6,15,16,18. Não foi demonstrado um aumento de risco de CM ou o aumento não foi significativo, com o uso de TH até 5 anos. O uso prolongado, acima dos 5 anos, parece aumentar o risco de CM1,6,15,17,18, mas esse risco deixa de ser significativo após a descontinuação da TH15. Segundo os mais recentes Consenso Nacional1 e Consenso Britânico15 sobre Menopausa, o risco de CM, atribuído ao uso de TH, é baixo, com uma incidência <1/1000 mulheres/ano de utilização, equiparável ou inferior ao risco associado a alguns fatores como o sedentarismo, a obesidade e o consumo de álcool (NE 3). Esta conclusão é sustentada pela RS de Stute P. et al.19.
Uma MA realizada pelo Collaborative Group on Hormonal Factors in Breast Cancer, publicada em 2019, mostrou a existência de aumento de risco de CM associado ao uso de TH20. Este trabalho incluía 58 estudos de coorte, sendo 24 prospetivos e 34 retrospetivos e contabilizava um número total (N) de 568.859 mulheres. Todos os tipos de TH, exceto os estrogénios vaginais mostraram uma associação com o risco de CM, sendo este risco maior nas utilizadoras de TH combinada - associação de EEC e AMP - (Risco Relativo (RR) = 1,6; Intervalo de Confiança (IC) 95% = 1,52-1,69) em relação aos estrogénios isolados (RR = 1,17; IC95% = 1,10-1,26). Este risco foi menor com o uso de PM ou didrogesterona na TH combinada, em relação aos restantes progestativos sintéticos20,21. Um trabalho conduzido por Asi N. et al. mostrou que o regime contínuo se associa a maior risco de CM do que o sequencial cíclico22.
O risco de CM parece aumentar com a duração de utilização20 e a Collaborative Group on Hormonal Factors in Breast Cancer definiu presença de risco a partir de 1 ano de utilização de TH20. Os autores definem que para utilizadoras acima de 5 anos, este risco podia duplicar. Contudo, este artigo tinha a limitação da amostra ser maioritariamente constituída por mulheres utilizadoras de TH com mais de 60 anos; relativamente às utilizadoras de TH por 5 anos, com início aos 45, 50 ou 55 anos, verificou-se pouca diferença na incidência de CM aos 70 anos comparativamente com as não utilizadoras20. Outra limitação foi o facto dos resultados obtidos entre os estudos retrospetivos e prospetivos, serem diferentes, baseando-se a discussão e conclusão apenas nos estudos prospetivos, que contemplavam 75% da população total (NE 2).
Ainda no que respeita ao impacto da duração da TH, a RS de Stute P. et al.19, incluiu um painel de peritos que selecionou 19 estudos com resultados consistentes e de maior qualidade de entre 143, incluindo RS, MA, Estudos Originais e Estudos de Coorte, pelo que lhe foi atribuído um NE 114. Os autores desta revisão concluíram que para qualquer TH combinada apenas foi encontrado um aumento do risco de CM para o uso superior a 5 anos, sendo este risco inferior com o uso de TH combinada com PM ou didrogesterona19.
Chlebowski RT. et al.23 observaram, através da realização de um ECCA em 27.347 mulheres, a influência a longo prazo do uso de TH no risco de CM, com um seguimento cumulativo de 13 anos. Concluíram que o uso de TH combinada causa um aumento significativo do risco apenas ao fim de 5,6 anos de uso. Em relação ao estrogénio isolado este não aumentou o risco ao fim de 7,2 anos de uso, nem ao longo dos 13 anos de seguimento cumulativo23. A este artigo foi atribuído um NE 1, pelo desenho do estudo, consistência dos resultados e tamanho de amostra utilizada14.
A revisão de Formoso G. et al.24, concluiu que não foram encontradas diferenças no risco de CM, nem na mortalidade por qualquer causa, com o uso de tibolona em comparação com o placebo21. Foi-lhe atribuído um NE 2, pela heterogeneidade e moderada qualidade dos estudos incluídos nesta RS14.
As formulações vaginais de estrogénio não parecem aumentar o risco de CM em mulheres com útero (RR = 0,78; IC 95% = 0,53-1,85) e histerectomizadas (RR = 1,06; IC 95% = 0,61-1,85), segundo um estudo de coorte prospetivo, com 45.663 mulheres25 (NE 2). A propósito da avaliação de desfechos finais, Manson J.E. et al.26, através de um estudo analítico observacional de coorte, NE 214, avaliaram o impacto do uso da TH na pós-menopausa, na mortalidade global e específica (mortalidade por doença cardiovascular ou por cancro), durante um seguimento de 18 anos. No que concerne à mortalidade por CM, o risco relativo durante o tempo de seguimento foi 1,44 (IC 95% = 0,97-2,15) nas utilizadoras de TH combinada e 0,55 (IC 95% = 0,33-0,92) naquelas que usaram apenas estrogénio isolado. Ainda sobre a mortalidade global e em particular por CM, uma MA realizada por Benkhadra K. et al., de 2015, mostrou que o uso de qualquer THS, por uma média de 4,6 anos, não se associou a um aumento da mortalidade21 (NE 2).
Byrne C., et al.27, através de um estudo caso-controlo, em 907 mulheres com idades entre 50 e 79 anos, concluiu que o aumento da densidade mamográfica após um ano sob TH combinada é um preditor de risco de CM, pelo que estas mulheres devem ter uma vigilância apertada ou deve-se ponderar a suspensão da terapêutica27.
Assim, tendo em consideração os estudos encontrados considera-se que a relação risco/benefício é mais favorável quando se verificam os seguintes fatores: sintomatologia significativa; mulheres mais jovens (< 60 anos); início recente da menopausa (< 10 anos); regime sequencial cíclico; progestativo como a PM ou didrogesterona em detrimento dos restantes progestativos sintéticos; estrogénio vaginal tópico para tratamento de SGUM.
Atribuímos a tais evidências uma Força de Recomendação B.
Cancro do Endométrio
O Cancro do Endométrio (CE) é a neoplasia maligna pélvica mais frequente nos países desenvolvidos e representa 6% dos cancros no sexo feminino28. Mais de 90% dos casos surge em mulheres com > 50 anos28. De acordo com os Consensos Nacionais de 2020, sobre Cancro ginecológico, a TH não está contraindicada28.
Analisando as 6 NOCs/Guidelines/Consensos, observa-se que o risco de CE, nas utilizadoras de TH, relaciona-se com o uso de estrogénio sistémico isolado1,15,16,17,18, sendo dose e duração dependente1. Esse risco pode ser ultrapassado combinando o estrogénio com progestativo ou bazedoxifeno, substâncias que conferem proteção endometrial1,15,16,17,18, sendo a proteção maior naquelas sob regime de progestativo contínuo, em vez do sequencial cíclico1,18. Em relação às mulheres histerectomizadas sintomáticas, é preferível o uso de estrogénios isolados16,17. Naquelas cuja sintomatologia se restringe ao SGUM, o estrogénio vaginal é uma opção vantajosa em relação à TH sistémica: é eficaz, seguro, a absorção sistémica é mínima e não é necessária a associação de progestativo para proteção endometrial16.
Formoso G. et al.24, através de dados compilados em 9 ECCA, que incluíam 8.504 mulheres, concluiu que não foram encontradas diferenças no risco de CE (OR = 20,4; IC 95% = 0,79-5,24), nem na mortalidade por qualquer causa, com o uso de tibolona em comparação com o placebo24. A maioria destes ensaios clínicos eram constituídos por um número reduzido de participantes, sendo classificados como ensaios de baixa qualidade. Por essa razão, pela heterogeneidade e qualidade dos estudos incluídos foi-lhe atribuído um nível de evidência 214.
Outra RS, de Tempfer CB. et al.29, publicada em 2020, procurou reunir a informação de 31 estudos, cuja população alvo consistia em mulheres diagnosticadas com CE. Este trabalho limitou-se a estudos mais recentes, dos últimos 20 anos, incluiu 12 artigos, com uma população de 10.241 mulheres com CE e 1.952.004 controlos, e reforçou o facto da TH com estrogénios isolados aumentar o risco de CE29. Os autores concluíram ainda que este risco reduz significativamente com a utilização TH combinada contínua, particularmente quando o progestativo é sintético (RR entre 0,24 e 0,71) 29. A RS de Sjögren LL. et al., de 2016 já havia apresentado resultados semelhantes, acrescentando que a TH com progestativos sintéticos administrados de forma contínua, teria efeitos protetores no surgimento de CE30. Nestes casos, o risco nas não utilizadoras seria maior que nas usuárias deste tipo de TH, e a sua utilização por períodos superiores a 10 anos não representaria aumento de risco30. Pelas limitações apresentadas, principalmente no que diz respeito ao pequeno número de mulheres incluídas nos ECCA, foi atribuído a estas RS um NE 2.
Por fim, o estudo observacional conduzido por Crandall CJ et al.25, que contou com uma população de 32.433 mulheres com útero, das quais 3.003 usaram estrogénio vaginal durante o seguimento, concluiu que este tipo de TH não evidenciou aumento de risco de CE (RR = 1,27; IC 95% = 0,69-2,33) 25 (NE 2).
Assim, em relação ao CE, o uso de estrogénio sistémico isolado associa-se a um aumento de risco dose e duração dependente, pelo que esta opção deve ser dirigida apenas a mulheres histerectomizadas. Em mulheres com útero, o risco de CE associado ao uso de estrogénio pode ser ultrapassado combinando-o com um progestativo (preferencialmente em regime contínuo e sintético) ou bazedoxifeno, pois qualquer um garante a proteção endometrial.
Classificamos estas evidências com uma Força de Recomendação A.
Cancro do Colo do Útero
O Cancro do Colo do Útero (CCU) é o sexto mais frequente nas mulheres europeias, apesar dos avanços significativos no rastreio, diagnóstico e tratamento das lesões pré-malignas. (28) Segundo o Consenso Nacional sobre a Menopausa, de 2021, da Sociedade Portuguesa de Ginecologia, a TH não parece influenciar o risco de CCU (1). As recomendações da Sociedade Britânica da Menopausa15 referem igualmente que não há associação entre a TH e este tipo de cancro e que os estudos da WHI não conseguiram mostrar evidencia nesta associação (RR = 1,44; IC 95% = 0,47-4,42). Segundo este documento, o uso de TH parece até estar associado a uma redução estatisticamente significativa no risco de cancro cervical invasivo (RR = 0,50; IC 95% = 0,40-0,80) 15 (NE 3).
Uma RS, conduzida por Vargiu V. et al.31, publicada em 2020, procurou compilar a informação existente sobre os riscos e benefícios da TH no CCU. Este grupo procurou saber se existe risco aumentado deste cancro ginecológico em utilizadores de TH e concluíram que não há evidência de associação entre o uso de TH e risco geral de cancro do colo do útero (RR = 0.47, IC 95% = 0.05-1.70). Os autores concluíram ainda que o uso de TH em mulheres com antecedentes de cancro do colo do útero em idades mais jovens, melhora a qualidade de vida e não aumenta o risco de recorrência deste tipo de tumor31 (NE 2).
Apesar da menor referência ao CCU, nos estudos selecionados, quando mencionados mostrou não haver relação significativa entre o uso de TH e o aumento deste risco.
Assim, atribuiu-se uma Força de Recomendação A.
Cancro do Ovário
O Cancro do Ovário (CO) é uma neoplasia maligna com baixa incidência, mas é dos cancros mais letais na mulher, com elevado rácio mortalidade/incidência. 28 Os dados existentes sobre TH e risco de CO são controversos e embora não exista evidência clara de associação entre os dois, o seu uso além dos 10 anos poderá constituir um fator de risco, mas ainda sem dados consistentes disponíveis. 1,7,15,16,17 (NE 3)
Uma MA de 2015, de Beral V. et al.32, que incluiu 52 estudos observacionais sobre risco de CO em mulheres sob TH, mostrou um aumento de 0,52 casos/1000 mulheres a iniciar TH aos 50 anos (RR = 1,43, IC 95% = 1,31-1,56) e o risco persistiu por 5 anos após cessação da terapêutica, com 0,37 casos/1000 mulheres, com idades entre 55 e 59 anos (RR = 1,37; IC 95% = 1,29-1,46). Numa carta ao editor publicada em 2015, por Gompel & Burger33, os autores contestavam os resultados observados por Beral V. et al.31, por considerarem que apenas foram escolhidos para análise os estudos prospetivos, tendo excluído os retrospetivos que geralmente fornecem muito mais informação. Além disso vários dos estudos em causa não contemplavam ajustes para importantes fatores de risco para cancro do ovário (NE 2).
Liu Y. et al.34, numa publicação de 2020, que contou com 36 estudos observacionais envolvendo um total de 4.229.061 participantes, mostrou igualmente uma associação entre uso de TH e aumento de risco de CO (RR = 1,29; IC 95% = 1,19-1,40), em particular dos grupos histológicos tipo seroso e endometrióide. Estes autores relataram limitações como a heterogeneidade das TH usadas, tempos de seguimento, idades das participantes, contraceção oral, entre outros, pelo que reconhecem a necessidade de confirmação dos resultados através da realização de outros estudos com mais qualidade34 (NE 2).
Um estudo prospetivo Sueco, de base populacional, observou todas as mulheres com idade ≥ 40 anos que utilizaram TH, entre 2005 e 2012 (288.950 utilizadoras) e 866.546 não utilizadoras35. Os resultados mostraram que as utilizadoras de TH tinham um risco reduzido de CO (OR = 0,47; IC 95% = 0,43-0,52). Analisando por subgrupos, o uso atual de TH combinada associou-se a um risco ligeiro de CO (OR = 1,38; IC 95% = 1,18-1,62), e nenhum risco foi encontrado nas ex-utilizadoras (OR = 1,00; IC 95% = 0,84-1,18); associações positivas não significativas foram observadas para regimes sequenciais (OR = 1,87; IC 95% = 0,70-5,08) 35 (NE 2).
Na MA de Benkhadra K. et al. 21, que concluiu que o uso de qualquer TH, por uma média de 4,6 anos, não foi associado ao aumento da mortalidade global, encontra-se um ECCA que mostra não haver associação entre uso de TH combinada e mortalidade por cancro do ovário (RR = 2,7; IC 95% = 0,73-9,99) 21.
Com base nos resultados expostos, não se encontra uma associação consistente entre o uso de TH e cancro do ovário, pelo que a sua utilização não está contraindicada.
Assim, atribuiu-se uma Força de Recomendação A.
Analisando o corpo de evidências dos estudos selecionados foram atribuídas as forças de recomendação apresentadas no Quadro VI.
Quadro VI. Forças de recomendação do corpo de evidências dos estudos selecionados.
Alguns estudos incluídos na presente revisão apresentam moderada qualidade e elevada heterogeneidade entre si, que resulta do facto de compilarem informação sobre estudos de diferentes tipologias. Isto é particularmente evidente nas RS e MA, que mesmo tentando ajustar os resultados para diferentes variáveis, continuam a ser heterogéneos em termos de sintomatologia da mulher, idade de início de utilização de TH, os anos decorridos após a menopausa, o tipo de composição da TH usada, a sua via de administração, a duração de uso e o tempo de seguimento. Outros dados, nem sempre esclarecidos, prendem-se com os fatores de risco particulares de cada participante, como uso prévio de contraceção oral, história familiar de cancro ginecológico, entre outros. Os estudos observacionais são particularmente sensíveis a estas variáveis, e a viés de esquecimento, mas permitem a obtenção de grande número de participantes. Os ECCA são mais controlados, mas o número de participantes fica muitas vezes aquém daqueles que permitem um bom tratamento estatístico. Assim, muitos dos resultados apresentados, devem ter presentes estas limitações.
Conclusões
A TH é uma opção segura e eficaz, sendo que os benefícios superam os riscos, se for iniciada em: mulheres menopáusicas sintomáticas, saudáveis e sem contraindicações, até 10 anos após o início da menopausa e com idade inferior a 60 anos. O risco de cancro do endométrio associado ao uso de estrogénio sistémico isolado, poderá ser ultrapassado combinando-o com um progestativo ou bazedoxifeno.
O principal receio na prescrição de TH é o risco de cancro da mama, consensualmente atribuído ao uso de progestativos. Contudo, este risco apenas é significativo com o uso de TH superior a 5 anos, e a maioria das mulheres obtém o controlo da sua sintomatologia com uma duração de tratamento de 3 a 5 anos. Assim, a TH deve ser usada na menor dose e menor duração total, necessárias para o controlo da sintomatologia da utente. O risco de cancro de mama atribuído ao progestativo em TH combinada é baixo, com uma incidência < 1 caso/1000 mulheres/ano de utilização, equiparável ou inferior ao risco atribuível a alguns fatores como o sedentarismo, obesidade ou consumo de álcool.
A TH deve ser adaptada à sintomatologia, risco individual e história familiar de cada mulher e os benefícios e riscos a curto e longo prazo devem ser discutidos individualmente; a decisão de manter ou suspender a TH deverá ser revista anualmente, através de uma decisão partilhada com a utente. A mulher sob TH também deve ser informada da importância em manter a periodicidade do rastreio do cancro da mama do colo do útero.
Contribuição dos autores
Ana Filipa Silva: conceptualização, revisão da literatura, redação do artigo e revisão do artigo. Andreia Castro: conceptualização, revisão da literatura, redação do artigo e revisão do artigo. Carlos Figueiredo: conceptualização, revisão da literatura, redação do artigo e revisão do artigo. Emília dos Santos: conceptualização, revisão da literatura, redação do artigo e revisão do artigo