Introdução
Embora se tenha assistido a uma alteração da prática clínica relativamente à prevenção e ao tratamento da trombose venosa, o embolismo pulmonar (EP), apesar de evitável, é ainda a causa mais frequente de morte hospitalar. A trombose venosa profunda (TVP) e o EP são um espectro de uma mesma doença: o tromboembolismo venoso (TEV), e ocorrem frequentemente em simultâneo. Dado que grande parte dos óbitos decorrentes de TEV ocorrem nas primeiras 2 horas após o evento agudo, antes mesmo de iniciada a terapêutica ou antes do seu efeito, a prevenção torna-se crucial na redução da sua morbimortalidade.
As adaptações fisiológicas da hemostase durante a gravidez favorecem, desde o seu início, um ambiente protrombótico, mesmo na ausência de outros fatores de risco, pelo que o TEV na gravidez é uma causa major de morbimortalidade, sendo responsável por cerca de 9% de todas as mortes maternas1,2. Na gravidez, verifica-se um aumento de 5 vezes do risco de tromboembolismo, correspondendo 80% a eventos venosos, com uma prevalência de 2/1000 grávidas3,4,5,6. Assim, sendo o TEV na gravidez a maior causa de morbimortalidade materna passível de prevenção, faz sentido uma tromboprofilaxia eficaz. De facto, desde a publicação das recomendações sobre a profilaxia do TEV na gravidez, parto e pós-parto, tem-se verificado uma diminuição significativa da mortalidade materna por TEV em vários países europeus7,8,9. Dado que grande parte desta mortalidade ocorre em mulheres com fatores de risco trombótico conhecidos, a necessidade de uma avaliação precoce dos mesmos na gravidez, e de uma reavaliação contínua do risco durante toda a gravidez e no pós-parto torna-se fundamental1.
Assim o objetivo desta Norma é uniformizar a tromboprofilaxia na gravidez, parto e pós-parto, estabelecendo orientações comuns que possam ser adaptadas e implementadas nos Serviços de Obstetrícia portugueses, de forma a aumentar a adesão às medidas de tromboprofilaxia, melhorar os resultados clínicos e diminuir os eventos tromboembólicos associados.
Foi efetuada uma pesquisa bibliográfica com os termos de pesquisa “pregnancy, delivery, postpartum, venous thrombosis, venous thromboembolism, deep venous thrombosis, pulmonary embolism, prophylaxis, recommendations” nas bases de dados Pubmed, Medline e Cochrane Library, limitadas aos últimos 20 anos, com termo em outubro de 2021. Foram também consultadas as normas e recomendações, nacionais e internacionais, sobre o assunto, nomeadamente as do Royal College of Obstetricians and Gynaecologists (RCOG) (7.
O grupo de trabalho sintetizou a evidência recente e elaborou esta Norma, propondo orientações segundo a metodologia Grading of Recommendations Assessment, Development and Evaluation (GRADE) (10.
Estratificação do risco tromboembólico
A gravidez, parto e pós-parto constituem um momento especial de risco de TEV. A coexistência de outras circunstâncias individuais com risco de TEV como existência de trombofilia, doença cardiovascular, coronariopatia, insuficiência cardíaca congestiva, acidente vascular cerebral, uso de estrogénios, existência de veias varicosas, doença pulmonar obstrutiva crónica, infeção aguda grave e doença inflamatória intestinal constituem outros fatores de risco adicionais11,12. Em Obstetrícia, os fatores de risco específicos relevantes a serem tidos em consideração para a prescrição de tromboprofilaxia no pós-parto são: trabalho de parto prolongado, infeção, hemorragia, necessidade transfusional, morte fetal e parto pré-termo (Nível de Evidência 2++, Grau de Recomendação B) (3,11,13,14. A história pessoal de TEV idiopático, além de ser um fator de risco isolado, aumenta o risco de recorrência destes episódios.
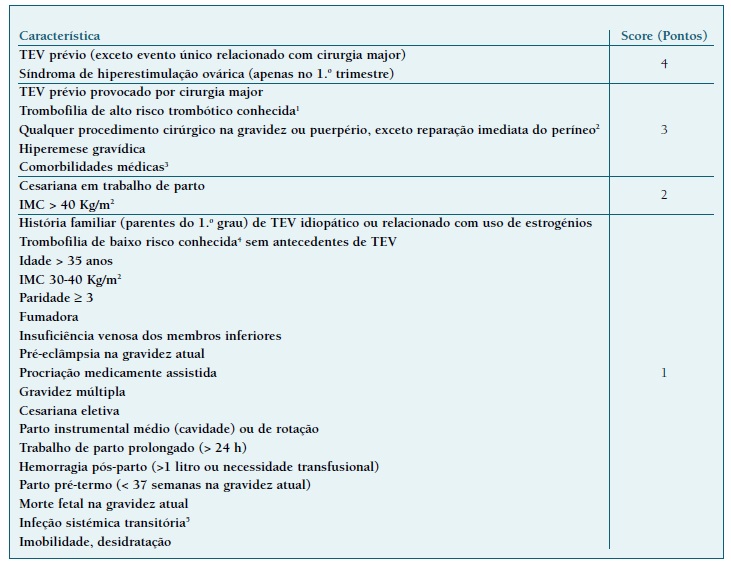
Para uma abordagem precoce e para uma decisão clínica mais consistente, preconiza-se a utilização de um score numérico de risco trombótico na avaliação das grávidas e puérperas - Quadro I (Nível de Evidência 3, Grau de Recomendação C) (15. A categorização do risco de TEV foi adotada do RCOG7,16, sendo que a maioria dos fatores de risco descritos e listados no Quadro I têm Nível de Evidência 2+ (variando entre 2- e 2++)7,17,18.
O índice de massa corporal (IMC) ≥ 30 Kg/m2, a idade > 35 anos e o parto por cesariana, devido à sua elevada e crescente prevalência, contribuem consideravelmente para aumentar as taxas de TEV (Nível de Evidência 2+)14,19,20.
Na gravidez, a avaliação e categorização destes fatores de risco (Quadro I) devem ser efetuadas idealmente nos seguintes momentos (Nível de Evidência 2+, Grau de Recomendação C) (7,16: no período pré-concecional ou na primeira consulta pré-natal; de uma forma contínua ao longo da gestação; na admissão ao internamento hospitalar; e após o parto1. Adicionalmente, sempre que surja um potencial evento de risco durante a gestação, deve ser efetuada uma reavaliação.
Recomendações
A tromboprofilaxia deve basear-se no equilíbrio entre o risco de TEV e o risco hemorrágico (Nível de Evidência A, Grau de Recomendação 1) e incluir as seguintes medidas11,21,22:
• Medidas gerais - mobilização e/ou deambulação precoces e hidratação adequada (Nível de Evidência C, Grau de Recomendação 1);
• Meios mecânicos - compressão elástica por meias ou ligaduras, ou compressão pneumática intermitente (efeitos benéficos no retorno venoso da compressão elástica graduada) (Nível de Evidência C, Grau de Recomendação 1) (23. As contraindicações ao seu uso incluem situações de doença arterial periférica, neuropatia diabética e infeção do membro inferior.
• Tromboprofilaxia farmacológica com heparina de baixo peso molecular (HBPM), exceto em casos de insuficiência renal ou hepática, risco aumentado de hemorragia, hipertensão não controlada ou intolerância à HBPM (Nível de Evidência B, Grau de Recomendação 1).
Não é apropriado adotar uma política universal de tromboprofilaxia na gravidez, sendo desejável avaliar e categorizar individualmente o risco trombótico, antes de decidir quando e durante quanto tempo esta é necessária.
Assim, durante a gravidez e pós-parto, de acordo com a avaliação e categorização individual do risco segundo o Quadro I, a tromboprofilaxia está indicada nas seguintes situações:
• Score ≥4 pontos (gravidez): iniciar profilaxia com HBPM no 1.o trimestre;
• Score = 3 pontos (gravidez): iniciar profilaxia com HBPM às 28 semanas;
• Score ≥2 pontos (pós-parto): fazer HBPM pelo menos durante 10 dias;
• Internamento (gravidez): considerar profilaxia com HBPM;
• Internamento prolongado (≥3 dias) ou reinternamento no pós-parto: considerar profilaxia com HBPM.
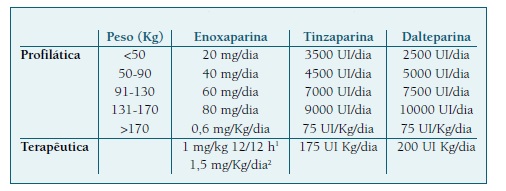
Na ausência de contraindicações, as HBPM são atualmente o método de eleição para a prevenção do TEV na gravidez e no pós-parto, devido às suas características farmacológicas (anticoagulantes com ação anti-trombótica e baixo risco hemorrágico; e não atravessam a barreira placentar) e pela sua facilidade de administração (Nível de Evidência 1+, Grau de Recomendação A) (7,16. Em relação à clássica heparina não fracionada (HNF), as HBPM têm como vantagens a maior biodisponibilidade, a maior semivida, a maior seletividade anti-Xa, o bom perfil de segurança, a fácil administração, a menor ligação às proteínas plasmáticas, o menor risco de trombocitopenia induzida (3 vezes inferior ao da HNF) e de osteoporose e, de uma forma geral, não necessitarem de monitorização laboratorial. Numa revisão sistemática que incluiu cerca de 2800 grávidas não se verificaram casos de trombocitopenia induzida pela heparina (Nível de Evidência 1++, Grau de Recomendação B) (24,25,26.
Dado que o TEV pode ocorrer no 1.o trimestre (i.e., antes das 15 semanas) em cerca de 40% das grávidas, a tromboprofilaxia quando indicada, deve ser iniciada precocemente (Nível de Evidência 1+, Grau de Recomendação B) (27,28.
Nas grávidas com antecedentes de TEV confirmado, deve ser efetuada tromboprofilaxia farmacológica com HBPM precocemente desde o 1.o trimestre (Nível de Evidência 2++, Grau de Recomendação B), bem como no pós-parto [tromboprofilaxia farmacológica com HBPM (Nível de Evidência 2++, Grau de Recomendação A) ou, em alternativa, dicumarínico, durante pelo menos 6 semanas, independentemente do tipo de parto], uma vez que o risco de TEV é maior no puerpério do que na gravidez (Nível de Evidência 2++, Grau de Recomendação B) (7. As mulheres com TEV recorrente ou sob anticoagulação crónica devem manter a HBPM em dose terapêutica até reiniciar anticoagulação oral (Nível de Evidência 2++, Grau de Recomendação B) (14,29, podendo esta ser recomeçada ainda antes da alta hospitalar.
Nas mulheres com 2 ou mais fatores de risco trombótico persistentes deve ser efetuada tromboprofilaxia farmacológica com HBPM em doses apropriadas ao seu peso durante 10 dias no pós-parto (Nível de Evidência 2++, Grau de Recomendação B) (7.
As grávidas com antecedentes de TEV associado a défice de antitrombina ou síndroma de anticorpos anti-fosfolípidos devem fazer tromboprofilaxia com doses mais elevadas de HBPM (50, 75 ou 100% da dose terapêutica) durante a gravidez e durante 6 semanas no pós-parto, ou até retornarem à anticoagulação oral.
Em mulheres com próteses valvulares cardíacas mecânicas, a terapêutica anticoagulante com dicumarínico é a mais adequada, apesar de doses diárias superiores a 5 mg estarem associadas a embriopatia fetal30. Contudo, a sua substituição por HBPM entre a 6.a e a 12.a semanas de gestação, apesar de reduzir o risco de embriopatia, pode aumentar o risco de complicações tromboembólicas (Nível de Evidência 2++, Grau de Recomendação B) (31. Assim, nas grávidas com válvulas cardíacas mecânicas e de acordo com a estratificação do risco, em alternativa à administração de HPBM, deve ser discutida e ponderada a manutenção de dicumarínicos no primeiro trimestre para prevenção de complicações tromboembólicas valvulares, apesar do risco de embriopatia fetal (Nível de Evidência 2++, Grau de Recomendação B) (7,30.
Numa revisão sistemática sobre o uso de HBPM na gravidez, os autores confirmaram a sua segurança e eficácia no tratamento e prevenção da trombose na gravidez (nível de Evidência 1++,Grau de Recomendação A) (24. Foi também demonstrada a segurança materno-fetal do uso de enoxaparina, dalteparina e tinzaparina25,26, pelo que na gravidez e pós-parto, não há diferença significativa entre a eficácia e segurança das várias HPBM na profilaxia e tratamento do TEV (Nível de Evidência 1+, Grau de Recomendação A) (11,22,32,33,34,35.
Durante a gravidez, as doses de HBPM utilizadas devem ser baseadas no peso (Quadro II). Excecionalmente quando se utilizam doses terapêuticas de HBPM na gravidez, está recomendado a monitorização da anticoagulação através da determinação da atividade anti-Xa36. Em situações em que não houve exposição prévia à HNF, não há necessidade de monitorizar a contagem de plaquetas (Nível de Evidência2++, Grau de Recomendação B) (7.
Tromboprofilaxia durante o trabalho de parto e parto
O uso de tromboprofilaxia com HBPM deve obedecer a regras específicas de forma a evitar o risco de complicações hemorrágicas no parto e analgesia (como a ocorrência de hematoma epidural). Assim, deve ser tida em conta a farmacocinética do fármaco, aquando da sua prescrição: as HBPM atingem o pico de concentração plasmática 2-4 horas após administração subcutânea e têm uma semivida de eliminação, predominantemente renal, de 3-6 horas (50% da atividade às 12 horas) (36,37. Assim, a grávida deve ser alertada para suspender a administração da HBPM e dirigir-se ao hospital para ser reavaliada caso tenha uma hemorragia ou entre em trabalho de parto. A HBPM deve ser suspensa 24 horas antes de procedimentos invasivos e da indução do trabalho de parto, bem como se deve adiar a colocação do cateter epidural 12 ou 24 horas (consoante se trate de dose profilática ou terapêutica, respetivamente) após a última injeção subcutânea de HBPM. A remoção de cateteres epidurais deve ocorrer pelo menos 6 horas antes da administração de HBPM no pós-parto. Se houver suspeita de punção traumática do neuroeixo é sugerido que a HBPM seja adiada 24 horas após o procedimento21.
Tromboprofilaxia no pós-parto
Após o parto, o risco trombótico deve ser reavaliado e, se necessário, a tromboprofilaxia deve ser ajustada. Em mulheres de alto risco, a tromboprofilaxia deve ser efetuada durante 6 semanas, enquanto em mulheres com risco intermédio, a tromboprofilaxia deve ser efetuada durante 10 dias.
Quando indicada, a administração de HBPM deve ser retomada 12 horas após o parto (em casos com maior risco trombótico, ponderar iniciar HBPM mais precocemente), devendo ser mantida durante o pós-parto de acordo com a avaliação e estratificação individual do risco tromboembólico.
As heparinas, tal como os dicumarínicos, não passam para o leite materno e não induzem um efeito anticoagulante no lactente, pelo que podem ser usadas com segurança no pós-parto e na amamentação (Nível de Evidência 1++, Grau de Recomendação A) (24.
Deve evitar-se a potenciação do risco hemorrágico pelo uso concomitante de mais do que uma tromboprofilaxia farmacológica ou uso simultâneo de anti-inflamatórios não esteróides.
Situações particulares
Obesidade de classe III ou mórbida (IMC >40)
Em todas as grávidas com IMC >40 deve ser ponderada a tromboprofilaxia com HBPM em doses profiláticas adequadas ao seu peso nos 10 dias após o parto (Quadro II).
Infeção por COVID-19
Existe evidência crescente a sugerir um elevado risco de TEV em grávidas com COVID-1938. Numa série de 1219 grávidas infetadas com SARS-CoV-2, a incidência de TEV foi de 6%, 0,2% e 0% em casos de infeção grave, moderada ou assintomática, respetivamente39. Com base nos estudos disponíveis à data (Nível de Evidência baixo), dada a possibilidade de risco aumentado de TEV e coagulopatia devido à infeção por COVID-19, e de forma idêntica à população não-grávida, a tromboprofilaxia com HBPM ajustada ao peso deve ser considerada em todas as mulheres grávidas e no pós-parto, internadas com COVID-19, desde que excluída hemorragia ativa, tenham contagem de plaquetas > 30x109/L, não estejam em trabalho de parto ativo ou tenham tido parto há mais de 24 horas. Se a tromboprofilaxia farmacológica estiver contraindicada, deve ser considerada a tromboprofilaxia mecânica. Após a alta hospitalar, a duração e dose da tromboprofilaxia dependem de fatores como a gravidade da doença, a idade gestacional e/ou pós-parto, o tipo de parto e o tempo de internamento. Na grande maioria dos casos, as grávidas infetadas com COVID-19 são tratadas em ambulatório. Neste caso e nas mulheres de baixo risco, devem ser encorajadas a hidratação, a mobilização, o controlo da febre e o uso de meias de contenção elástica. A tromboprofilaxia com HBPM deve ser considerada em casos de imobilização, febre elevada, desidratação ou fatores de risco tromboembólico adicionais40,41,42,43,44.
Recentemente, após vacinação contra a COVID-19, foi descrito uma síndroma rara e com elevada mortalidade, caracterizada por uma associação entre trombocitopenia e trombose45. Apesar desta nova entidade, não está indicada profilaxia de rotina com anticoagulantes ou antiplaquetários na prevenção de tromboses atípicas associadas à vacinação contra a COVID-1946.
Conclusões
O TEV é uma causa relevante e passível de prevenção da morbilidade e mortalidade obstétrica. Todas as mulheres devem ser submetidas a uma avaliação criteriosa e estratificada dos fatores de risco trombótico, de forma a estabelecer quais são as que necessitam de tromboprofilaxia. Essa avaliação de risco deverá ser efetuada preferencialmente no período pré-concecional ou no início da gravidez, repetida e continuada no internamento hospitalar e sempre que surjam outras intercorrências na gravidez e no parto.
Contribuição de cada autor
Jorge Lima: coordenação da norma de orientação clínica; Jorge Lima e Ana Patrícia Domingues: redação; Jorge Lima, Ana Patrícia Domingues, Ana Cristina Amaral, Augusta Borges, Cristina Nogueira-Silva, Fátima Serrano, Inês Marques, Luísa Pinto e Mariana Guimarães: revisão e aprovação da versão final do manuscrito para publicação.