Introdução
Globalmente, o cancro de mama (CaM) é o segundo tipo de cancro mais frequentemente diagnosticado e a principal causa de morte por cancro no sexo feminino1. É, igualmente, a principal causa de morte em mulheres entre os 40-49 anos2.
Em Portugal, o cancro de mama é o tipo de cancro mais diagnosticado no sexo feminino, com uma taxa de incidência de cerca 118/100000 habitantes e uma taxa de mortalidade de 18,2/100000 habitantes. (3), (4
Nos países desenvolvidos, os enormes avanços no diagnóstico e tratamento do CaM permitiram alcançar taxas de sobrevida aos 5 anos superiores a 80%5.
A mamografia permanece a única ferramenta diagnóstica para o rastreio populacional generalizado, com demonstrada efetividade na redução de mortalidade, uma vez que a deteção precoce de CaM facilita o tratamento conservador, com diminuição dos custos associados e melhoria do prognóstico6), (7.
A mamografia de rastreio, realizada periodicamente a mulheres assintomáticas em faixas etárias pré-determinadas, inclui a aquisição de duas imagens de cada mama em incidências complementares, com leitura realizada por dois médicos radiologistas em dupla ocultação, método que comprovadamente aumenta a sensibilidade e especificidade da avaliação. A sua realização pressupõe, caso necessário, a acessibilidade a métodos completares de diagnóstico, com eventual encaminhamento hospitalar especializado6.
A ampla difusão e implementação do rastreio mamográfico tem mobilizado a comunidade médico-científica, bem como decisores políticos e sociedade civil, em torno de um objetivo de saúde pública partilhado. De igual forma, contribuiu significativamente para a consciencialização da população feminina para o cancro de mama e para a organização de serviços especializados no tratamento desta patologia7.
Contudo, apesar de múltiplos estudos afirmarem o benefício do rastreio mamográfico na deteção precoce e redução da mortalidade por CaM8), (9, este impacto não é consensual, com resultados díspares em outras análises10.
O debate sobre o rastreio mamográfico acentuou-se em 2000, quando o grupo de investigadores dinamarqueses da Cochrane levantou questões sobre a qualidade metodológica dos estudos aleatorizados dos anos 80-90, em que se baseia a evidência que defende o rastreio11.
A questão do sobrediagnóstico, isto é, a deteção através do rastreio de tumores que, de outro modo, em teoria, não se tornariam clinicamente detetáveis e não poriam em risco a vida da mulher, veio reforçar a controvérsia.
Com o crescente conhecimento dos fatores de risco associados ao CaM, a investigação científica nesta área tem vindo a procurar formas de rever o atual paradigma do rastreio de cancro de mama, na perspetiva de implementar uma metodologia personalizada baseada no risco individual de desenvolver cancro12.
Com esta revisão narrativa, pretendemos reunir a evidência mais atual sobre os benefícios e riscos associados ao rastreio de cancro de mama, assim como as controvérsias associadas à sua metodologia e implementação, fornecendo uma perspetiva do que poderá ser a evolução do rastreio para um modelo centrado na utente.
Benefícios do rastreio
Redução da Morbimortalidade por Cancro de Mama
Mesmo na era atual de tratamento sistémico extremamente eficaz, o estádio tumoral no momento do diagnóstico ainda tem um impacto significativo na sobrevivência geral. Por conseguinte, o diagnóstico precoce permanece crucial6.
O objetivo primário de qualquer rastreio de cancro é reduzir a mortalidade através da deteção de lesões assintomáticas numa fase inicial, mais facilmente tratável, antecedendo a invasão ganglionar ou metastização à distância7.
Ao antecipar o timing de diagnóstico, o rastreio confere melhoria do prognóstico ao permitir uma intervenção mais precoce13, com tratamentos menos mutilantes e melhor resultado estético.
Entre a década de 60 e a década de 90, 8 grandes estudos aleatorizados controlados avaliaram a mortalidade por CaM associada ao rastreio, incluindo cerca de 600000 mulheres em estudo. Meta-análises destes estudos demonstram uma redução de cerca de 15-20% no risco relativo de mortalidade por CaM10), (14.
Desde então, têm surgido algumas preocupações na análise aprofundada destes estudos, no que se refere a aleatorização das amostras, contaminação dos dados e determinação da mortalidade por cancro de mama14.
Alguns investigadores argumentam que os estudos aleatorizados previamente referidos não se aplicam à população que é, atualmente, submetida a rastreio de CaM, pelo fato de terem utilizado mamografias com menor resolução e com maior limiar para a deteção de carcinoma ductal in situ e por precederem os enormes avanços no tratamento dos últimos anos14), (15.
O grupo IARC (International Agency for Research on Cancer) analisou todos os estudos observacionais cohort e caso-controlo publicados entre 1989 e 2014, concluindo que, nas mulheres entre os 50-69 anos convidadas para rastreio, ocorreu uma redução de 23% no risco de morte por CaM e que, nas mulheres que, tendo sido convidadas, efetivamente realizaram rastreio mamográfico, ocorreu uma redução superior a 40%9.
Estudos observacionais europeus, baseados no rastreio organizado implementado, verificaram reduções na mortalidade de cerca de 38% nas mulheres que, recebendo a chamada para rastreio, o realizaram16.
Contrariamente ao esperado, os dados epidemiológicos cumulativos têm demonstrado que, nas populações em que o rastreio mamográfico foi amplamente implementado, o declínio na incidência de cancros avançados foi modesto7. Na Holanda, apesar de uma elevada participação no rastreio organizado (aproximadamente 80% da população feminina entre os 50 e 75 anos) durante um período de 23 anos, a incidência de CaM estádio II-IV variou entre 168/100000 em 1989 e 166/100000 em 201217.
De salientar que, as reduções na mortalidade por CaM parecem ser semelhantes em áreas com introdução precoce e elevada penetrância do rastreio e em áreas com implementação tardia e penetrância baixa do mesmo7.
Relativamente à influência no tratamento, Gotzsche et al. reportaram numa revisão sistemática da Cochrane em que analisaram apenas a evidência dos estudos aleatorizados, que o rastreio mamográfico resultou num aumento estatisticamente significativo das cirurgias mamárias nos grupos de intervenção versus grupos de controlo. (10
Riscos do rastreio
Falsos positivos
Um falso positivo define-se como a necessidade de investigação adicional após uma mamografia alterada, em que a avaliação subsequente determina que o achado inicial não é cancro. A maioria dos casos será resolvido com novos exames de imagem não-invasivos, no entanto, uma percentagem das utentes rastreadas necessitará de biópsia1.
Atualmente, considera-se que a especificidade da mamografia ronda os 90%18), (19. Alguns estudos consideram que o risco cumulativo de um falso positivo após mamografia varia entre os 20% e os 60%10. Esta variabilidade resulta de fatores como o uso de terapêutica hormonal, densidade mamária, falta de mamografias prévias para comparação, intervalos longos entre rondas e diferenças na experiência e método de trabalho dos radiologistas leitores1.
O grupo IARC considera que o risco cumulativo de um falso positivo é cerca de 20% para mulheres entre os 50-69 anos que realizaram 10 exames em 20 anos, com uma taxa de necessidade de biópsia por resultado falso-positivo menor que 1% por ronda8.
Entre as mulheres submetidas a biópsia mamária neste contexto, a taxa esperada de achados malignos está entre 30-50%1.
Um resultado falso positivo leva, invariavelmente, a um período de ansiedade considerável até esclarecimento do resultado.
Brodersen et al. concluíram que o impacto psicológico de um falso positivo é equiparável, nos primeiros 6 meses, ao impacto de um diagnóstico de CaM, podendo levar até 3 anos de consequências psicológicas e reduzir a adesão a rastreio subsequente em até 37% dos casos20.
Falsos negativos
Cerca de 20% dos casos de cancro de mama não são detetados pela mamografia, acabando por manifestar-se clinicamente através de massa palpável ou secreção mamilar suspeita. Os falsos negativos são mais comuns em alguns tipos de cancro de mama, como os carcinomas lobulares e em utentes com elevada densidade mamária1.
Um falso resultado negativo no rastreio mamográfico provoca uma falsa sensação de tranquilidade, levando a utente a protelar a procura de ajuda após o início de sintomas, o que pode levar a atrasos diagnósticos.
As mulheres que experienciam diagnóstico de cancro de mama no intervalo entre chamadas para rastreio têm menor confiança no rastreio mamográfico8.
Alguns autores sugerem a associação da tomossíntese mamária (TM) à mamografia de rastreio como estratégia para elevar a sensibilidade do rastreio organizado21), (22. Num estudo prospetivo de 2013, a sua combinação resultou em aumentos estatisticamente significativos da taxa de deteção de cancro (cerca de 27%) e de cancro invasivo (cerca de 40%) em comparação com a mamografia isolada21.
Sobrediagnóstico
O sobrediagnóstico refere-se à existência de tumores que, se não fossem detetados no rastreio, não se tornariam clinicamente detetáveis e não comprometeriam a vida da mulher. Em teoria, a intervenção terapêutica nestes tumores indolentes não teria benefício clínico ou impacto na sobrevida.
A mamografia de rastreio identifica, tendencialmente, tumores de crescimento lento e biologicamente menos agressivos, o que potencia uma maior sobrevivência das mulheres com tumores detetados em rastreio10. Alguns autores defendem que, para tumores no mesmo estádio, a sobrevivência é maior em cancros detetados em rastreio que em cancros detetados clinicamente23.
O sobrediagnóstico pode ser estimado em estudos aleatorizados de rastreio, comparando a incidência de CaM em mulheres rastreadas versus não rastreadas (diagnosticadas clinicamente), em que o período de seguimento seja suficientemente longo após o fim da intervenção, o que permitiria que todos os tumores se tornassem clinicamente aparentes em ambos os braços do estudo13), (24.
Embora exista consenso no conceito de sobrediagnóstico, existe uma larga divergência na forma de o calcular, com inúmeras análises a estimarem que cerca de 20 a 50% de cancros detetados no rastreio poderão corresponder a sobrediagnóstico, com base na idade, esperança de vida e tipo de tumor, sobretudo no que se refere a carcinomas in situ10), (13), (25), (26.
O sobrediagnóstico tem como consequência o sobretratamento de mulheres diagnosticadas, com as toxicidades e sequelas associadas, prejuízo da qualidade de vida e da saúde mental da doente.
À luz do conhecimento atual, ainda não é possível distinguir quais as neoplasias que, permanecendo sem tratamento, não levariam a morte da doente, não sendo possível dizer se um tumor detetado em rastreio se trata ou não de um caso de sobrediagnóstico.
O caso particular do carcinoma ductal in situ, maioritariamente diagnosticado aquando do rastreio, não é sinónimo de sobrediagnóstico, uma vez que, em cerca de 10% dos casos, a excisão local destes tumores está associada ao desenvolvimento subsequente de cancros de mama invasivos nos 10 anos seguintes13.
Metodologia de rastreio
Limites de idade do rastreio
Nos países desenvolvidos, aproximadamente 75% dos cancros de mama são diagnosticados em mulheres pós-menopáusicas e 5-7% são diagnosticados em mulheres com idade inferior a 40 anos27.
O rastreio mamográfico em idades mais jovens é um desafio radiológico, uma vez que a composição mamária é tipicamente mais densa, com redução da sensibilidade da mamografia28.
Levanta questões de custo-benefício, tendo em conta que a incidência é menor em mulheres mais jovens do que em mulheres com idade superior a 50 anos, logo, o potencial benefício absoluto do rastreio na faixa etária 40-49 é menor8.
De salientar que os tumores diagnosticados nesta faixa etária geralmente apresentam uma progressão mais rápida, com maior probabilidade de serem recetor de estrogénios negativos e terem um grau histológico mais desfavorável, com pior prognóstico. Quadro I
Quadro I Recomendações internacionais e nacionais para rastreio organizado de cancro de mama
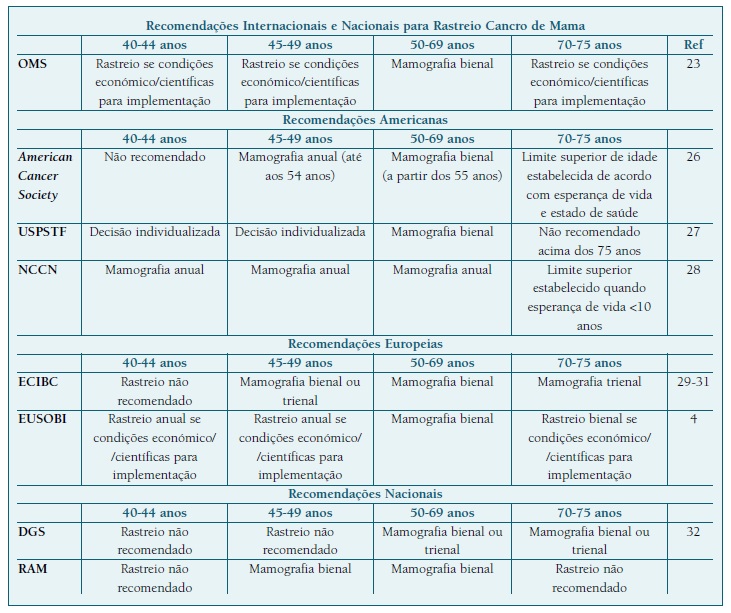
OMS - Organização Mundial de Saúde; USPSTF - United States Preventive Services Task Force; NCCN - National Comprehensive Cancer Network; ECIBC - European Commission Initiative on Breast Cancer; EUSOBI - European Society of Breast Imaging; DGS - Direção Geral de Saúde; RAM - Região Autónoma da Madeira.
O Uk Age Trial reportou que a mamografia anual com início aos 40 anos se associou à redução significativa da mortalidade por CaM, nos primeiros 10 anos de seguimento, recomendando assim a redução do limite inferior de idade do rastreio dos 50 para os 40 anos29.
Em contraste, Miller et al., no seu estudo prospetivo com um follow-up de 25 anos, concluiu que a mamografia anual, em mulheres entre os 40 e os 59 anos, não reduziu a mortalidade por CaM, além do seguimento clínico usual, quando terapêuticas adjuvantes estão amplamente disponíveis24.
O risco de falsos positivos também parece aumentar com o começo precoce do rastreio e com frequência anual30), (31. Esta evidência foi fulcral para, em 2009, a US Preventive Services Task Force ter optado por reverter a sua recomendação prévia de rastreio mamográfico com início aos 40 anos, passando a recomendar rastreio a partir dos 50 anos e de 2 em 2 anos, em sintonia com a maioria dos países europeus mas em contraste com as recomendações de outras organizações norte-americanas14.
Relativamente à faixa etária entre os 70 e os 75 anos, ainda existe atualmente uma escassez de evidência clínica. Os dados disponíveis parecem indicar benefício comparável à faixa etária 50-69 anos, no entanto, o sobrediagnóstico e sobretratamento parecem ser bastante elevados nestas idades32.
Frequência de rastreio
Não existe consenso internacional, nem evidência robusta que permita consubstanciar a frequência ideal de realização de rastreio. No entanto, a maioria dos países europeus optou pela sua realização de dois em dois anos no grupo dos 50-69 anos.
Quando a faixa etária 40-49 anos é convidada para rastreio, o intervalo anual parece ser geralmente adotado, tendo em consideração a potencial maior velocidade de crescimento dos tumores e menor sensibilidade da mamografia nesta faixa etária6.
Exame de rastreio
A mamografia permanece o exame gold-standard do rastreio de CaM e a mamografia digital deve ser privilegiada6.
No entanto, esta técnica tem limitações conhecidas, com possível sobreposição de tecido mamário denso, o que pode ocultar tumores ou levantar suspeição sobre estruturas normais. Esta dificuldade reduz a sensibilidade da mamografia e aumenta a taxa de falsos positivos do rastreio33.
A TM, ao utilizar uma série de projeções de raios X de baixa dose, posteriormente reunidas numa reconstrução 3D da mama, permite reduzir a sobreposição de tecido mamário denso radiopaco.
Skaane et al. defendem que a combinação de leitura da mamografia 2D e TM melhora significativamente a taxa de deteção CaM no rastreio mamográfico, tendo obtido diferenças estatisticamente significativas na taxa de falsos positivos (8,5% com técnica 2D+3D vs 10,3% com técnica 2D) e na deteção de cancro (9,4 vs 7,1/1000 exames), com 27 diagnósticos adicionais de cancro invasivo com a técnica 2D+3D21.
A Sociedade Europeia de Imagiologia Mamária (EUSOBI), considera que a TM poderá tornar-se no exame gold-standard de rastreio de CaM num futuro próximo6.
A EUSOBI desencoraja a ecografia como ferramenta primária de rastreio em mulheres assintomáticas com risco médio de CaM, podendo ter um papel complementar em mamas com elevada densidade6.
Para mulheres com elevado risco de CaM, como portadoras de mutações genéticas (BRCA1 ou BRCA2), ou mulheres com lifetime risk superior a 5% (estimado através de ferramentas de cálculo do risco individual), a vigilância deve ser personalizada, estando recomendada a disponibilização de ressonância magnética como exame de rastreio6), (7.
Perspetivas futuras
No modelo atual de Rastreio Organizado, a idade é o fator chave na definição da população-alvo, em que uma única metodologia é aplicada a todas as mulheres convidadas para rastreio, segundo uma abordagem “one size fits all”, que não tem em consideração a heterogeneidade dos subtipos de CaM e o risco variável da população41.
As últimas três décadas de implementação do rastreio mamográfico trouxeram um aumento na incidência de cancros detetados em estádios precoces, com aumento da deteção de doença in situ, sem se verificar uma diminuição proporcional na incidência de doença avançada27.
Esta realidade veio questionar a metodologia atual, levando à busca de um novo modelo, centrado na utente, que possibilite uma melhor estimativa do risco individual (através da combinação do estudo genético da utente com dados pessoais e familiares) e um melhor equilíbrio do risco-benefício associado ao rastreio.
A abordagem personalizada poderá significar que algumas utentes iniciariam o rastreio em idade mais precoce, teriam frequências de rastreio diferentes ou seriam avaliadas com exames adicionais, como ressonância magnética. Face à determinação de alto risco de CaM, seria igualmente possível disponibilizar tratamento profilático27.
O estudo Wisdom (Estados Unidos da América) compara uma abordagem personalizada baseada no risco individual com a metodologia de rastreio de CaM anual tradicional, em mulheres entre os 40 e os 74 anos. Tem como endpoint primário a não inferioridade desta abordagem personalizada relativamente ao número de deteções de cancros em estádios avançados. Contempla a participação de 100000 mulheres e está atualmente a decorrer19.
O estudo MyPebs, a realizar-se na Bélgica, França, Israel, Itália e Reino Unido, procura comprovar a não inferioridade da estratégia personalizada de rastreio, na deteção de cancros em estádio 2 ou mais avançado, comparativamente com o rastreio populacional estabelecido em cada país. Prevê a participação de 85000 mulheres entre os 40 e os 70 anos. Encontra-se atualmente suspenso devido à pandemia COVID-1942.
Em ambos os estudos, as participantes do braço de intervenção são divididas em quatro grupos, de acordo com a sua avaliação individual do risco de CaM a 5 anos (calculado através das ferramentas Mammorisk™ e Tyrer-Cuzick™ risk score).
No estudo MyPebs, o grupo de baixo risco contempla mamografia de 4 em 4 anos, o de risco intermédio define rastreio mamográfico a cada 2 anos, o grupo de risco elevado contempla mamografia anual e, finalmente, o grupo de risco muito elevado prevê rastreio com mamografia e ressonância magnética anuais. No estudo Wisdom, o grupo de baixo risco iniciará o rastreio mamográfico de 2 em 2 anos aos 50 anos. Os restantes grupos iniciam rastreio aos 40 anos, com o grupo de risco intermédio a realizar mamografia de 2 em 2 anos, o grupo de risco elevado mamografia anual e o de risco muito elevado rastreio com mamografia e ressonância magnética anuais19), (42), (43.
A implementação de um programa de rastreio personalizado nestes moldes trará novos desafios no que se refere a consentimento informado, recolha e proteção de dados pessoais, questões éticas e legais relacionadas com a realização de testes genéticos, assim como a escolha de ferramentas de avaliação de risco validadas e uniformizadas, determinação dos grupos de risco e cut-offs utilizados44.
Conclusão
Apesar da enorme evolução tecnológica e científica dos últimos anos na abordagem ao diagnóstico e tratamento de CaM, o rastreio populacional organizado permanece um tópico controverso, não existindo consenso internacional sobre a melhor forma para a sua implementação.
O futuro passará pelo estudo e implementação de modelos centrados na doente, de acordo com as suas características clínicas e genéticas, permitindo definir recomendações individualizadas para quando começar, em que idade suspender e com que frequência realizar o rastreio, de acordo com o risco individual determinado.
Assim, a evolução para um modelo centrado na utente poderá colmatar as limitações do rastreio atual, permitindo uma melhor estratificação de risco e um melhor equilíbrio do risco-benefício associado ao rastreio de cancro de mama que, idealmente, levaria ao aumento da deteção precoce de CaM e redução do risco de mortalidade, assim como redução das taxas de falsos positivos e sobrediagnóstico.
Contribuição individual de cada autor
Ana Calhau - Conceção e estruturação do trabalho, recolha de dados e pesquisa bibliográfica, seleção dos dados e evidência científica, composição do artigo.
Sara Câmara - Conceção e estruturação do artigo, revisão crítica do artigo
Filipe Bacelar - Conceção e estruturação do artigo, revisão crítica do artigo
Tânia Freitas - Conceção e estruturação do artigo, revisão crítica do artigo
Mónica Armas - Recolha de dados e pesquisa bibliográfica, revisão crítica do artigo














