Introdução
O estetrol (E4) é um estrogénio natural, produzido exclusivamente pelo feto durante a gravidez. Este composto atravessa a placenta até à circulação materna, circulando em concentrações elevadas (0,5 - 1,2 nmol/L) (1, tendo sido identificado pela primeira vez em 1965 em amostras de urina de mulheres grávidas. (2 Embora a função biológica do E4 seja desconhecida, a produção é atribuída exclusivamente ao fígado fetal por atividade da enzima 15α-hidroxilase. (3 Esta enzima acopla ao estriol (E3) um grupo hidroxilo, que lhe confere a nomenclatura de E4 e um perfil farmacodinâmico e farmacocinético distinto. (4
O E4 apresenta reduzida atividade estrogénica e baixa afinidade para os recetores de estrogénio (RE), sendo a respetiva potência biológica 100 vezes inferior à do estradiol (E2). (5 O E4 partilha com o E2 diferentes funções estrogénicas, demonstradas em modelos animais, tais como proliferação do endométrio e do epitélio vaginal, (5), (6 prevenção da desmineralização óssea, (7 inibição da ovulação8 e prevenção de sintomas vasomotores. (9 Por outro lado, foi já demonstrado em modelos in vitro humano e in vivo murino que, comparativamente com o E2, é 100 vezes menos ativo na proliferação de células epiteliais da mama. (10 Simultaneamente, tanto o estriol (E3) como o E4 poderão atenuar a atividade de E2 em tecidos sensíveis ao estrogénio, sendo disto exemplo a ação antagonista no efeito proliferativo do E2 na mama quando E4 é administrado em simultâneo. (10), (11 Estes dados apoiam o E4 como um estrogénio de impacto reduzido sobre a proliferação da glândula mamária10 e sem estimulação estrogénica dos tecidos hepáticos, características comuns e indesejadas dos respetivos análogos. (12
Apesar da descoberta do estetrol não ter inicialmente despertado interesse na indústria farmacêutica, evidências pré-clínicas recentes destacam-no como um potencial agente farmacológico na contraceção, na terapia hormonal da menopausa e no cancro da mama. Em 2020, a Agência Europeia do Medicamento (EMA na sigla em inglês) aprovou a comercialização do E4 em combinação com a drospirenona (DRSP) como contracetivo oral combinado (COC). Atualmente, o E4 continua a ser testado como terapia hormonal da menopausa e como tratamento do cancro da mama e da próstata. (13
Farmacologia e mecanismo de ação
Os efeitos biológicos dos estrogénios são mediados pela ligação a dois RE, Raα e Rb. Esta interação provoca alterações conformacionais, dimerização e recrutamento de cofatores para o núcleo, modelando a transcrição de genes-alvo. Os estrogénios também podem atuar de uma forma rápida por ativação de vários RE localizados na membrana plasmática, modulando igualmente a transcrição. (14
O E4 é um estrogénio mais fraco quando comparado com o E2, sendo necessárias doses 100 vezes superior para induzir a modulação seletiva dos RE e a respetiva atividade transcricional. (15), (16 O E4 é dotado de uma capacidade única, promovendo, simultaneamente, a ativação do REα nuclear para induzir a transcrição genómica e o bloqueio do REα membranar responsável por despoletar uma mensagem de transdução rápida no citoplasma (Figura 1). (17 Postula-se que esta dualidade seja a base da ação específica do E4 nos tecidos.
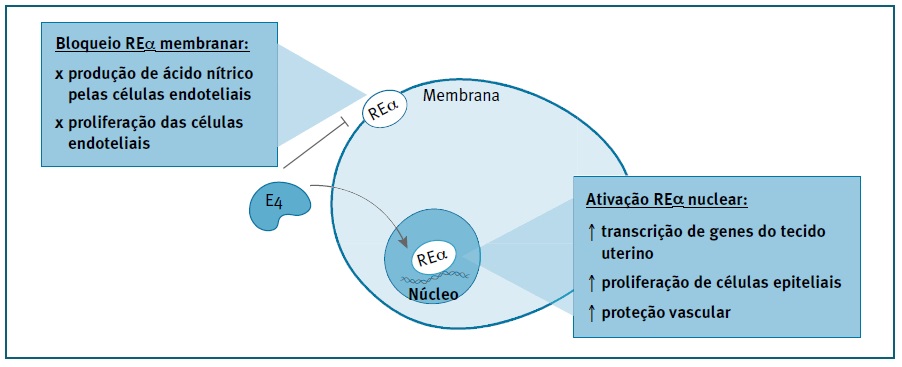
FIGURA 1 Mecanismo de ação do estetrol. O E4 promove simultaneamente a ativação dos recetores de estrogénio (RE) α nucleares e o bloqueio dos mesmos ao nível da membrana. Este mecanismo dual é responsável por uma ação única e seletiva nos tecidos. A ativação nuclear dos REα estimula a transcrição de genes no tecido uterino, a proliferação de células epiteliais e ainda promove a proteção vascular. Por outro lado, o bloqueio dos REα da membrana inibe a cascata de sinalização por ela desencadeada, não ativando a produção de acido nítrico nem a proliferação das células endoteliais.
As doses elevadas de E4 estimulam a transcrição de genes no tecido uterino e a proliferação de células epiteliais, duas ações conhecidas do REα nuclear. (15), (18), (19Montt-Guevera et al e Guivarc’h et al demonstraram in vivo a proteção vascular mediada por REα nuclear através da ativação pelo E4, repondo a remodelação arterial, controlando o sistema fibrinolítico e a migração de células endoteliais. (18), (20 O E4 medeia ainda a proteção contra fenómenos de tromboembolismo venoso, confirmando a sua ação como agonista do REα nuclear. (21 Em contraste, o E4 não promove a produção de ácido nítrico nas células endoteliais, nem acelera a proliferação das mesmas, sendo estes mecanismos mediados pela sinalização estrogénica membranar. (22In vitro, o E4 é capaz de exercer atividade antitumoral através da indução da apoptose. (23), (24
Em comparação com os estrogénios análogos, o E4 possui uma semivida mais longa que o estradiol de 20-28 horas e elevada biodisponibilidade por via oral. (25 O metabolismo de E4 nas células hepáticas humanas é lento, apresentando apenas metabolitos residuais e inativos. (16 Os metabolitos de degradação hepática apresentam-se sob a forma de sulfato ou glucorono conjugados, não sendo reconvertido em E2 ou E3. (26In vitro, o E4 não estimula a síntese nem interage com a globulina transportadora de hormonas sexuais (SHBG) (25 e não inibe as enzimas do sistema do citocromo P450, exibindo baixa probabilidade de interação medicamentosa. (16
A elevada seletividade para o REα, assim como o baixo impacto no metabolismo hepático, parece conferir ao E4 um baixo risco de indução de efeitos adversos. Contudo, desconhece-se a sua toxicidade específica, apenas tendo sido demonstrados efeitos tóxicos em doses muito elevadas derivados da ação estrogénica. (1
Uma nova geração de contracetivos orais combinados (COC)
Os COC contêm, por definição, um estrogénio e um progestativo. Os estrogénios estabilizam o endométrio, regulando a hemorragia uterina, reduzindo o desenvolvimento do folículo e a secreção da hormona folículo-estimulante (FSH). O etinilestradiol (EE) é o estrogénio mais utilizado nos COC e, apesar de estar associado a um padrão menstrual satisfatório, reconhece-se os riscos associados ao seu uso, nomeadamente o aumento de trombose venosa. Uma revisão sistemática da literatura associa todos os COC a um risco ligeiramente aumentado destes eventos (risco relativo de 3,5 face a mulheres que não tomam COC). (27 Dado que os COC são um dos métodos contracetivos mais utilizados, torna-se imperativo o desenvolvimento de COCs mais seguros.
O E4 parece ser uma estratégia eficaz, tolerável e segura a ser incorporada nos COC. De facto, a combinação 15 mg de E4/3mg de DRSP teve parecer positivo por parte da EMA para comercialização na Europa. Os ensaios clínicos publicados que sustentaram esta aprovação encontram-se resumidos no Quadro I. A eficácia contracetiva clínica da DRSP em combinação com EE foi previamente demonstrada e a sua associação com E4 foi avaliada em dois estudos multicêntricos de fase III. (28 O índice de Pearl obtido no estudo europeu (NCT02817828) foi de 0,41 (IC de 95%: 0,13-0,96) para a população geral (18 a 50 anos de idade) (29 enquanto que no estudo realizado na América do Norte (NCT02817841) o valor foi superior (2,52; IC de 95%:1,68-3,64). (30), (31 A diferença observada é transversal a outros estudos de contraceção. (32
quadro I Estudos clínicos que suportam o uso de e4 como contracetivo oral.
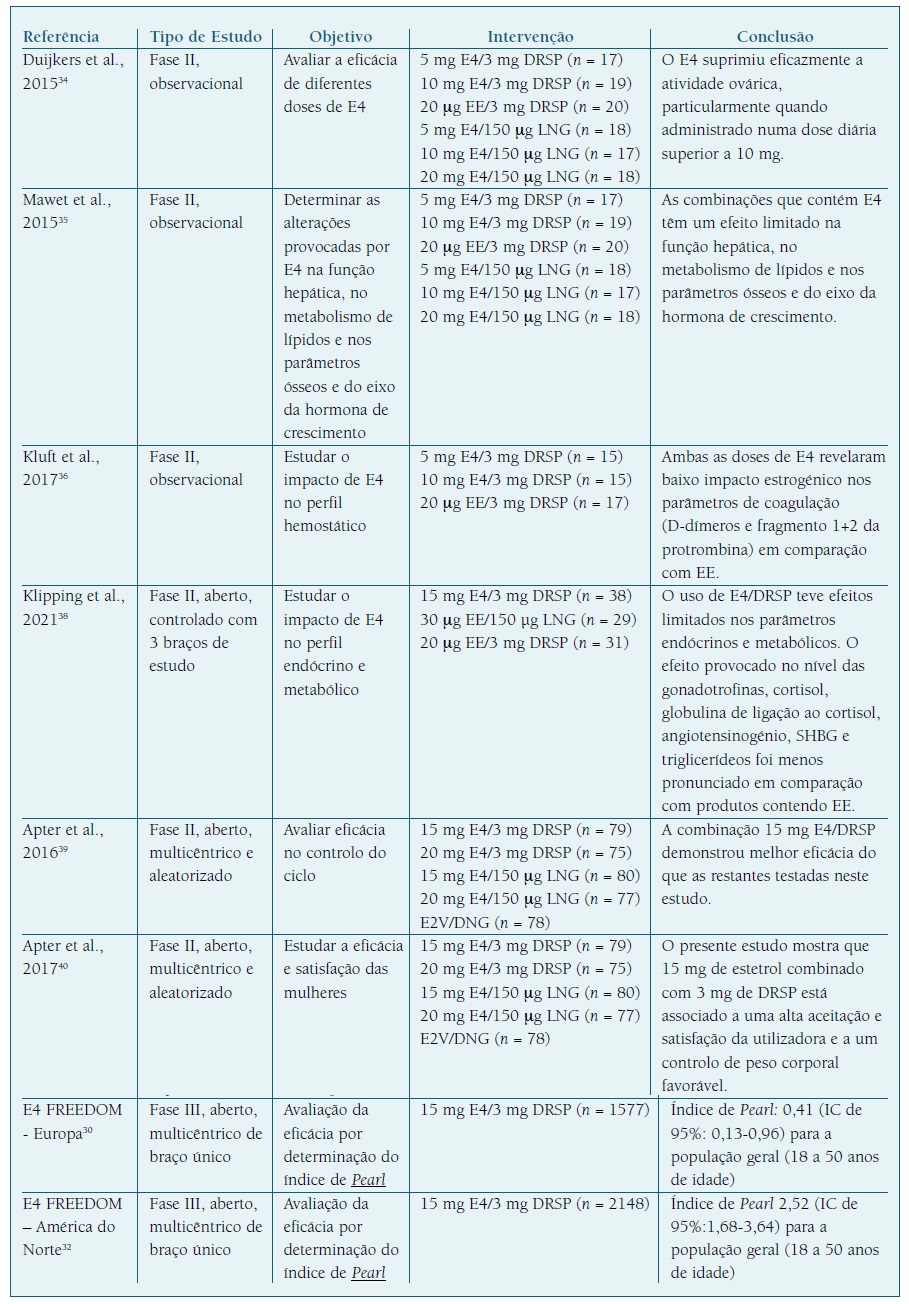
DRSP: Drospirenona, E4: Estetrol, EE: Etinilestradiol, IC: Intervalo de Confiança, LNG: Levonorgestrel, SHBG: Globulina Transportadora de Hormonas Sexuais.
O primeiro estudo de exposição humana ao E4 por via oral publicado por Visser et al mostrou uma supressão significativa da secreção de FSH e da hormona luteinizante (LH), fator fundamental para a função contracetiva. (26 No seguimento destes resultados, diferentes doses de E4 (5, 10 ou 20 mg), em combinação com um progestativo [DRSP ou levonorgestrel (LNG)], foram estudadas num ensaio clínico de fase II. (33 O E4 em combinação com DRSP ou LNG inibiu efetivamente a ovulação, não se observando diferenças entre os dois progestativos. A supressão da atividade ovárica e da secreção de gonadotrofinas foi mais pronunciada na dose mais alta administrada de E4 (20 mg). Todos os indivíduos tratados tiveram restauração da ovulação entre 17 e 21 dias após conclusão do tratamento. A espessura endometrial foi comparável entre todos os grupos de tratamento, produzindo um efeito semelhante ao de EE/DRSP.
O E4, ao atuar como um estrogénio de baixa potência, tem efeitos minor na função hepática, no metabolismo lipídico, nos parâmetros ósseos e no eixo da hormona de crescimento. (34 Quando comparado com EE/DRSP, as diferentes combinações de E4 com um progestativo DRSP ou LNG apresentaram um menor aumento nos níveis séricos de SHBG (E4/LNG: -69,0% a -44,2%, E4/DRSP: 7,9% a +44,5% e EE/DRSP +306,3±117,7%).34 De salientar que, embora EE/DRSP induza um aumento significativo nos níveis de SBHG e angiotensinogénio (381% e 256%, respetivamente, face ao valor basal), as concentrações de E4 testadas (5 e 10 mg) combinadas com DRSP aumentaram apenas em 25 a 43% estes compostos. (35 Não obstante, estas doses testadas reduziram os níveis de D-dímeros e do fragmento 1+2 da protrombina, marcadores moleculares de atividade da coagulação. (35
O estudo FIESTA avaliou o padrão hemorrágico, o controlo do ciclo e a satisfação das utilizadoras com quatro combinações diferentes (15 e 20 mg de E4 combinadas com DRSP ou LNG), usando como referência o valerato de estradiol e dienogest (E2V/DNG). (36), (37 A menor dose testada de E4 combinada com DRSP demonstrou ser a mais promissora em termos de padrão hemorrágico e controlo do ciclo menstrual. Imediatamente após o sexto ciclo de toma, a frequência de perda hemática não programada tipo spotting e ausência de hemorragia de privação previsível foram as mais baixas neste grupo de tratamento (E4/DRSP) em comparação com o grupo controlo tratado com E2V/DNG (33,8% vs. 47,8% e 3,5% vs. 27,1%, respetivamente). (36 A satisfação global mostrou-se maior com a combinação 15 mg E4/DRSP e menor com 15 mg E4/LNG. Igualmente, o bem-estar com a combinação E4/DRSP revelou-se significativamente melhor do que com a combinação E4/LNG e comparável com E2V/DNG. A elevada percentagem de mulheres que reportou a perda de 2 kg ou mais após o terceiro ciclo de toma de 15 mg E4/DRSP foi apontado como um fator preponderante nesta melhoria, evidenciando que o ganho ponderal é um fator comum para a descontinuação da COC. (37
Em paralelo, mais recentemente, dois outros estudos avaliaram o efeito da associação 15 mg E4/DRSP nos parâmetros hemostáticos e endócrinos e comparam-no com as associações de EE/LNG (30 µg EE/150 µg LNG) e EE/DRSP (20 µg EE/3 mg DRSP) por 6 ciclos de 28 dias. (38), (39 Os dados reforçam o impacto neutro da combinação E4/DRSP em diferentes parâmetros metabólicos, comparativamente às combinações contendo EE. Após o sexto ciclo de tratamento, o efeito sobre as gonadotrofinas foi menor com E4/DRSP (FSH: +30,5% e LH: -7,5%) em comparação com o EE/LNG (FSH: -84,0% e LH: -92,0%) ou mesmo com EE/DRSP (FSH: -64,0% e LH: -90,0%). Adicionalmente, o aumento nos níveis de cortisol total (CT) e na globulina de ligação ao cortisol (CLC) foram menores com E4/DRSP (+26,0% e +40,0%, respetivamente) em comparação com EE/LNG (CT: +109,0%, CBG +152,0%) e EE/DRSP (CT: + 107,0%, CBG + 140,0%). A nível hepático, o efeito provocado por E4/DRSP foi menos pronunciado nos níveis de angiotensinogénio (+75,0%) em comparação com EE/LNG (+ 170,0%) e EE/DRSP (+206,5%) e da SHBG (+55,0%), em comparação com EE/ LNG (+74,0%) e EE/DRSP (+251,0%). O E4/DRSP não influenciou o metabolismo dos carboidratos e teve um efeito mínimo nos parâmetros lipídicos, destacando-se o aumento dos níveis de triglicerídeos em 24,0% ainda assim menor em comparação com 28,0% e 65,5% provocado, respetivamente, por EE/LNG e EE/DRSP.
A toma de até 20 mg/dia de E4 não provocou alterações significativas nos marcadores de função hepática ou nos parâmetros hemostáticos nos estudos realizados, sugerindo que mesmo doses mais elevadas de E4 não parecem estar associadas a uma maior incidência de eventos tromboembólicos, que são efeitos indesejáveis do E2 e sobretudo do EE. Contudo, são necessários mais estudos para avaliar com rigor a incidência do risco de trombose venosa entre as mulheres que utilizam COC com E4/DRSP.
Potencial efeito no tratamento de sintomas associados à menopausa
Os sintomas da menopausa têm um efeito depreciativo na qualidade de vida das mulheres. De forma a garantir maior adesão à terapêutica da menopausa, o desenvolvimento de novas terapias eficazes e com melhor perfil de segurança é crucial.
Várias evidências suportam o uso do E4 como terapêutica hormonal da menopausa. A administração oral de E4 em dose única mostrou uma inibição dos níveis plasmáticos de LH dependente da dose (1 a 100 mg de E4). (26 Foi também verificada a redução sustentada de FSH por 168 horas no grupo de 100mg de E4 e(não se avaliou FSH nos outros grupos de dose. O E4 revelou-se bem tolerado em todas as dosagens e sem questões de segurança.
Num estudo interventivo de 28 dias reportado por Coelingh Bennink et al, incluíram-se 49 mulheres na pós-menopausa, e mesmo as doses mais baixas de E4 (2 e 10 mg) melhoraram os sintomas vasomotores e o índice citológico de maturação vaginal. (40 Todavia, foram verificadas alterações dose-dependentes em parâmetros endócrinos (FSH e LH), nos marcadores de remodelação óssea e em níveis de lípidos e de lipoproteínas. (41 O impacto no perfil lipídico e hemostático foi reduzido. Relativamente à eficácia, os efeitos de 10 mg de E4 foram semelhantes aos do grupo controlo (2 mg de E2V). A proliferação do endométrio provocada por 10 mg de E4 foi significativamente superior às 2 mg de E4 e na mesma extensão das mulheres tratadas com 2 mg de E2V. (40 Desta forma, doses de 10 mg ou superiores de E4 devem ser administradas com recurso a um progestativo para conferir proteção endometrial. Por oposição, a terapêutica isolada com E4 (sem oposição progestativa) em baixas doses (menores que 2 mg) pode ser considerada segura em mulheres não histerectomizadas para contrariar a atrofia vaginal, sintoma comum na menopausa. (42
Estes resultados promissores impulsionaram a elaboração de um estudo multicêntrico de fase IIb, com o objetivo de determinar a dose oral mínima de E4 capaz de aliviar os sintomas vasomotores em mulheres na pós-menopausa. Um total de 257 mulheres com idades compreendidas entre os 40 e os 65 anos foram recrutadas, em seis países europeus, e alocadas aleatoriamente a receber placebo ou uma das doses de E4 (2,5, 5, 10 ou 15 mg). (43 Contrariamente ao esperado, apenas a dose mais elevada testada (15 mg) provocou uma diminuição significativa na frequência semanal e na gravidade dos sintomas vasomotores associados à menopausa. Após 4 e 12 semanas de tratamento, a frequência semanal de afrontamentos e suores noturnos reduziu significativamente face ao placebo (-66% vs. -49%, p=0,032 e -82% vs. -65%, p=0,022, respetivamente) assim como a sua gravidade (-0,59 vs. -0,33, p= 0,049 e -1,04 vs. -0,66, P = 0,049, respetivamente). Conforme descrito previamente, esta dose de E4 induziu um aumento da espessura do endométrio, o que condicionou a realização de biópsia em 13% das participantes embora, não se tenha verificado nenhum caso de hiperplasia endometrial. Apesar dos resultados aparentemente desanimadores com as doses mais baixas de E4, os autores referem o elevado efeito do ramo placebo no estudo. O tratamento com placebo provocou um declínio percentual médio da frequência de calores e afrontamentos de 65% face ao valor basal, após 12 semanas de tratamento. A eficácia do placebo nos sintomas da menopausa foi estudada por vários autores, sendo dependente das populações e dos anos desde a menopausa. Freemann et al demonstra a eficácia do placebo no controlo de sintomas associados à menopausa e uma meta-análise de 85 estudos demonstra que os placebos em estudos que incluem terapêuticas hormonais como comparador são eficazes. (44), (45 Sendo assim, é provável que doses mais baixas de E4 produzam o efeito desejado no controlo dos sintomas da menopausa.
Não obstante, este estudo mostrou que nenhuma das doses administradas modificou significativamente os níveis dos fatores da coagulação em relação à linha de base, mantendo a sensibilidade para a proteína C ativada. (46 Desta forma, o E4 poderá estar associado a um menor risco de trombose venosa, fortalecendo a sua posição como uma alternativa promissora de tratamento para mulheres na pós-menopausa.
Para definir com rigor o equilíbrio entre a eficácia e a segurança de E4, devem ser considerados estudos de fase III com as doses mais elevadas (15 e 20 mg). (13), (17
Aplicações clínicas adicionais
As características inovadoras do E4 aumentam as expetativas para a sua aplicação em diferentes áreas terapêuticas. Anteriormente, a administração de estrogénios foi substituída por agonistas da hormona de libertação da hormona luteinizante (LHRH) no tratamento endócrino do cancro da próstata, devido a efeitos nefastos no sistema cardiovascular. (47 Após o tratamento com doses crescentes de E4 (20 a 60 mg/dia) durante 4 semanas (NCT02718378), os voluntários do sexo masculino saudáveis apresentam uma diminuição significativa na quantidade de testosterona total e livre. Acrescenta-se que o impacto do E4 nos parâmetros hemostáticos, lipídicos e de remodelação óssea foi reduzido e dependente da dose. Neste artigo, os autores ressalvam que o efeito, apesar de seguro, pode ser insuficiente na redução dos níveis de testosterona, devendo ser implementado em combinação com análogos de LHRH. (48
Adicionalmente, Visser et al e Bennink et al sugerem que o tratamento com E4 previne e trata neoplasias mamárias em função da dose usada em modelo de rato com tumor mamário induzido quimicamente. (49), (50 Na maior dose testada (10 mg/Kg), o E4 mostrou eficácia comparável à da ooforectomia, sendo a citotoxicidade induzida por E4, a justificação mais provável para o efeito observado. Comparativamente a outros estrogénios com atividade mitogénica neste tecido, o E4 possui uma potência de indução de proliferação celular 100 vezes menor do que o E2, e atua como antagonista na presença do E2, atenuando a proliferação e migração induzida pelo E2 em células mamárias. (15), (51),(52)-(53 A grande diferença com outros estrogénios é novamente a elevada taxa de tolerabilidade, permitindo o uso clínico de E4 em doses elevadas. Os dados pré-clínicos foram confirmados por Singer et al num estudo interventivo realizado (NCT00464516) em 15 mulheres na pré e 15 pós-menopausa com cancro da mama positivo para RE. (54 O E4 teve um efeito pró-apoptótico significativo no tecido tumoral, todavia não foi verificada nenhuma alteração da expressão do marcador de proliferação celular Ki67. Os níveis de FSH diminuíram nas mulheres pós-menopáusicas, enquanto não se verificou efeito nos níveis de LH. O tratamento com E4 diminui significativamente a expressão de REα, que intrinsecamente promove a proliferação celular, e apresentou uma tendência para aumento dos níveis do REβ, cujo efeito é antagónico.
Um estudo com doses crescentes (NCT02718144) mostrou que doses altas de E4 (20, 40 e 60 mg) parecem ser seguras e bem toleradas durante 12 semanas de tratamento, sem toxicidade limitante da dose e com efeitos antitumorais em 5 de 9 doentes com cancro da mama avançado em progressão e resistente a terapêuticas anti-estrogénicas. (55
Conclusão
O E4 possui um perfil farmacológico e farmacocinético distinto dos outros compostos pertencentes à classe dos estrogénios. A sua administração tem-se mostrado eficaz e segura nas diversas aplicações clínicas testadas, com particular destaque para a sua ação contracetiva quando associado à drospirenona (molécula já aprovada para esta indicação terapêutica). A baixa estimulação do tecido mamário, o diminuto impacto carcinogénico e a modesta modelação dos parâmetros lipídicos e hemostáticos, criam um perfil de segurança exclusivo que aumenta a aplicação clínica do E4 oral. No entanto, são necessários estudos clínicos adicionais, de longa duração e com amostras de maiores dimensões, para validar a segurança do E4 e a sua utilidade na terapêutica hormonal da menopausa em doses de 10 a 15 mg por dia com a necessária proteção endometrial nas mulheres com útero, bem como no tratamento oncológico.