Introdução
Nos últimos anos, tem sido dada especial atenção à associação entre translucência da nuca (TN) fetal aumentada e ocorrência de desfechos gestacionais e perinatais adversos, em fetos com cariótipo normal. (1), (2), (3), (4 Este achado ecográfico é frequente, podendo ser observado em cerca de 5% dos fetos euploides, (5 mas tem vindo a ser associado a inúmeros defeitos estruturais congénitos major (particularmente do foro cardíaco), bem como a síndromes genéticos específicos. (6), (7), (8), (9 Vários estudos reportam risco aumentado de complicações obstétricas, tais como abortamento, morte fetal intrauterina ou neonatal, restrição de crescimento fetal e parto pré-termo. (2), (4), (10) (11), (12), (13), (14
Todavia, apesar de a associação entre TN aumentada e os desfechos previamente descritos se encontrar bem estabelecida, pouco se sabe acerca do neurodesenvolvimento a longo prazo das crianças euploides com TN aumentada no rastreio combinado de primeiro trimestre (RCPT), saudáveis ao nascimento. Nestes casos a literatura é controversa. Alguns autores descrevem risco de atraso no neurodesenvolvimento semelhante ao das crianças com TN normal para a idade gestacional (IG). (15), (16 Uma revisão sistemática conduzida em 2012 concluiu também que, perante um cariótipo normal e na ausência de malformações anatómicas, o neurodesenvolvimento das crianças com TN aumentada não parece diferir do da população geral. (17 Contudo, outros estudos apontam para um risco superior a 7% de atraso no neurodesenvolvimento em crianças euploides, com TN aumentada, (18), (19 bem como de défice intelectual e transtorno do espectro do autismo. (20), (21
Assim, dada a discrepância vigente na literatura, torna-se premente clarificar a relação entre o aumento da TN e as alterações do neurodesenvolvimento infantil, por forma a fornecer aos pais a melhor informação. Desta forma, a presente investigação pretende avaliar os desfechos gestacionais e perinatais, bem como o neurodesenvolvimento a longo prazo, das gestações com TN aumentada (TN≥percentil (P) 95-99 e TN≥P99) no RCPT, na ausência de anomalias cromossómicas, genéticas ou síndromes genéticos reconhecidos.
Métodos
Este estudo foi aprovado pelo coordenador do Centro Académico e Comissão de Ética para a Saúde (Ref. 43/2017). Todas as participantes forneceram consentimento verbal, telefonicamente, para participar no estudo. As variáveis foram incluídas numa base de dados apenas acessível aos investigadores responsáveis, codificando-se os dados pessoais recolhidos por forma a assegurar a sua confidencialidade.
Foram incluídas no estudo todas as gestações com RCPT realizado em Hospital de Apoio Perinatal Diferenciado, entre 1 de dezembro de 2014 e 1 de dezembro de 2015, com comprimento craniocaudal fetal entre 45-84 mm. A avaliação da TN faz parte do RCPT, sendo realizada entre as 11 e as 13 semanas e 6 dias de gestação, (22 por obstetras certificados, de acordo com as recomendações da Fetal Medicine Foundation (FMF). A medição ecográfica da TN fetal foi considerada aumentada quando superior ou igual ao P95 ajustado para a IG, segundo as curvas de Snijders et al., 1998, (23 adotadas pela FMF.
Excluíram-se do estudo casos com registo incompleto de dados no processo clínico, parto não ocorrido no Hospital onde foi realizado o RCPT e casos com anomalias cromossómicas, genéticas ou malformações congénitas confirmadas antes ou após o nascimento. De notar que foi oferecida a possibilidade de amniocentese ou biópsia das vilosidades coriónicas, para cariótipo fetal ou array-CGH, às grávidas com risco aumentado para trissomia 21 (>1/300), trissomia 13 ou 18 (>1/150) no RCPT, sempre que detetada alguma malformação ecográfica e nos casos de TN≥P95. Casos sem análise cromossómica ou genética pré ou pós-natal foram considerados como euploides, na ausência de anomalias estruturais ou síndromes genéticos reconhecidos.
Assim, foram definidos três grupos de análise: fetos com TN<P95 para a IG (grupo 1), fetos com TN≥P95-99 para a IG (grupo 2) e fetos com TN≥P99 para a IG (grupo 3). O grupo 1 foi selecionado aleatoriamente recorrendo à ferramenta online Random®, na proporção 2:1 em relação aos casos com TN aumentada.
Recorrendo ao programa informático Astraia® (Astraia Software GmbH; Alemanha), foram recolhidos dados sociodemográficos e antropométricos das grávidas (idade da grávida no RCPT, IMC pré-gestacional, estado tabágico, informação de anomalias cromossómicas/genéticas), bem como variáveis relacionadas com o RCPT (TN e risco ajustado de trissomia 21). Utilizando as aplicações informáticas SClínico Hospitalar® (Serviços Partilhados do Ministério da Saúde, EPE; Portugal) e Obscare® (VirtualCare; Portugal), foram também recolhidos dados relativos aos principais desfechos gestacionais, fetais e neonatais (abortamento tardio ou morte fetal - <24 semanas de gestação e ≥24 semanas respetivamente, IG no parto, sexo, última estimativa de peso fetal - restrição de crescimento se peso <P5 e leve para IG se peso ≥P5-P10 e peso ao nascimento).
Para a avaliação do neurodesenvolvimento infantil foi utilizado o questionário Parent Report of Children’s Abilities (PARCA), (24 ministrado por contacto telefónico com a mãe/cuidador principal (após obtenção de consentimento informado verbal). Esta escala destina-se à avaliação da capacidade cognitiva de crianças com idades compreendidas entre 18 meses e 4 anos e possui uma consistência interna de 0,74. (24 O PARCA foi validado para português no âmbito do projeto europeu EPICE (Effective Perinatal Intensive Care in Europe) (25. O referido questionário engloba 34 parâmetros, com 3 opções de resposta cada. A cada resposta “Sim” é atribuída a pontuação 1, sendo as opções “Não” e “Não sei” classificadas com 0 pontos. Uma pontuação na escala inferior a 22 foi o ponto de corte utilizado para definir rastreio positivo para atraso no neurodesenvolvimento. (25
A análise estatística foi efetuada recorrendo ao software Statistical Package for the Social Sciences ® (SPSS), versão 24.0. A média e desvio-padrão foram calculados para variáveis contínuas com distribuição normal, tendo sido utilizado o teste t de Student para amostras independentes (teste paramétrico), para testar a diferença de médias entre grupos. Relativamente às variáveis com distribuição não-normal, optou-se pela aplicação do teste de Mann-Whitney, sendo a mediana utilizada como medida de tendência central e a amplitude interquartil com medida de dispersão. Para variáveis categóricas, a comparação entre grupos utilizou-se o teste Chi-quadrado. Foi efetuada uma regressão logística considerando o resultado na escala PARCA como variável dependente e a TN aumentada - ≥P95-99 ou ≥99 - como possíveis variáveis explicativas, sendo os resultados controlados para o género da criança. Todos os valores de p<0,05 foram considerados estatisticamente significativos.
Resultados
1910 grávidas realizaram o RCPT durante o período considerado, preenchendo os critérios de inclusão. O desfecho da gestação foi desconhecido em 73 casos (3,8%) e 135 (7,1%) apresentavam registos clínicos incompletos. 54 (2,8%) recém-nascidos apresentaram anomalias cromossómicas ou genéticas ou malformações congénitas confirmadas antes ou após o nascimento. Assim, tendo em conta esta população e os critérios de exclusão definidos, obteve-se um total de 1648 gestações, das quais 105 (6,4%) apresentaram TN aumentada, 89 (5,4%) com P≥95-99 (grupo 2) e 16 (1,0%) com P≥99 (grupo 3). Dos casos com TN aumentada, 36,2% (38/105) realizaram cariótipo fetal ou array-CGH (30,3% (27/89) TN ≥P95-99 e 68,8% (11/16) TN≥P99), não sendo identificadas alterações cromossómicas ou genéticas. Selecionaram-se aleatoriamente, de entre os restantes 1543 casos, 212 com TN<P95 (grupo 1) - proporção aproximada de 2:1 em relação aos casos com TN aumentada. Assumiu-se a população como euploide, na ausência de anomalias cromossómicas, estruturais ou síndromes genéticos reconhecidos no período pré ou pós-natal (Figura 1).
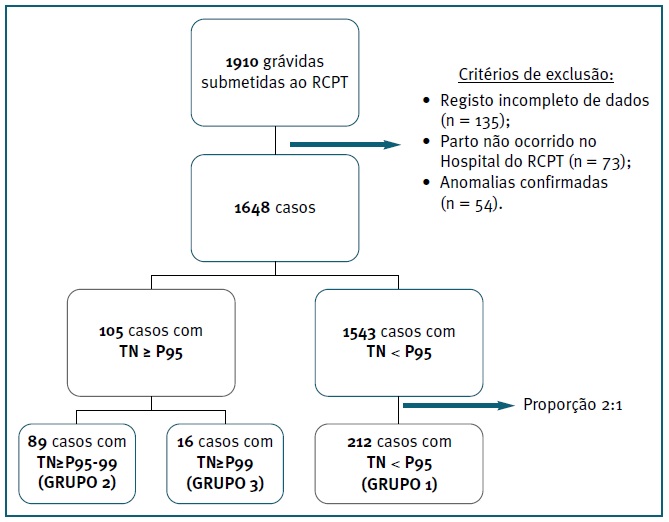
FIGURA 1 Fluxograma representativo do processo de seleção de participantes e definição dos grupos. Legenda: RCPT - Rastreio combinado de primeiro trimestre; TN - Translucência da Nuca; P - Percentil
O Quadro I representa a caracterização das grávidas, gestação e recém-nascidos dos três grupos.
QUADRO I Caracterização dos três grupos definidos.
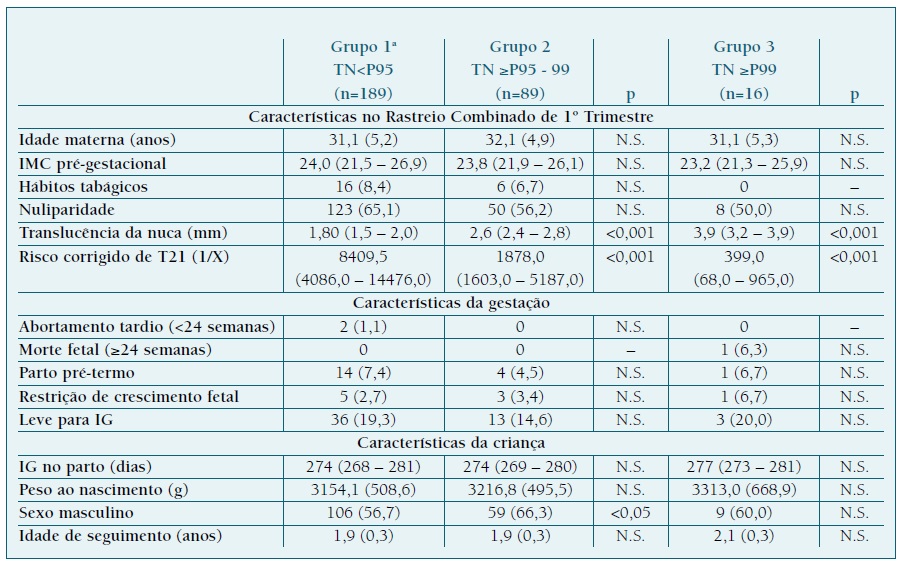
a - Grupo controlo | IMC: Índice de massa corporal | N.S.: Estatisticamente não significativo, p>0,05 | Resultados expressos em n (%) ou M (P25-75)
Não foram verificadas diferenças estatisticamente significativas quanto às características maternas entre os três grupos. O mesmo aconteceu para os desfechos gestacionais, fetais e neonatais examinados, à exceção da medida da TN, risco de trissomia 21 e sexo fetal. A mediana da TN foi de 1,80 (1,5-2,0), 2,6 (2,4-2,8) e 3,9 (3,2-3,9), para os grupos 1, 2 e 3, respetivamente. Os grupos 2 e 3 apresentaram risco de trissomia 21 significativamente superior em relação ao grupo 1. A prevalência de fetos do sexo masculino foi significativamente superior no grupo 2 em comparação com o grupo 1.
Após exclusão das gestações em que ocorreu abortamento (n=2) ou morte fetal intrauterina (n=1), foram obtidos 314 casos aptos para a aplicação da escala PARCA. Foi impossível estabelecer contacto telefónico com 20 mães/cuidadores principais (6,4%) e 8 (2,5%) rejeitaram responder ao questionário. Destas 28, 8 (7,6%) faziam parte do grupo com TN aumentada para a IG, 6 (6,7%) do grupo 2 (TN≥P95-99) e 2 (12,5%) do grupo 3 (TN≥P99).
O questionário foi aplicado a 286 mães/cuidadores principais, constituindo 91,1% de respostas válidas. Destas, 83 (29,0%) faziam parte do grupo 2 (TN≥P95-99) e 14 (4,9%) do grupo 3 (TN≥P99). A média de seguimento dos recém-nascidos foi de 2 anos, sem diferenças significativas entre os grupos. Todas as crianças às quais foi aplicada a escala PARCA tinham idades compreendidas entre 18 meses e 2 anos.
19 (6,6%) crianças apresentaram um rastreio positivo para atraso no neurodesenvolvimento infantil. Destas, a maioria (n=12; 63,2%) apresentavam TN≥P95, pertencendo 9 (10,8% - 9/83) ao grupo 2 (TN≥P95-99) e 3 (21,4% - 3/14) ao grupo 3 (TN≥P99). A prevalência de rastreio positivo para atraso no neurodesenvolvimento foi significativamente superior nos grupos 2 e 3 em comparação com o grupo 1 (Quadro II).
QUADRO II Resultado na escala parca nos três grupos definidos.
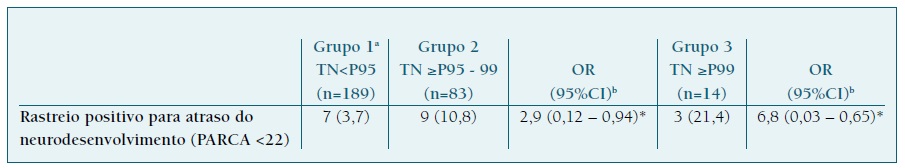
a - Grupo controlo | b - Resultado controlado para género | *Estatisticamente significativo, p<0,05 | Resultados expressos em n (%) | R2 = 0,049, (Cox&Snell); R2 = 0,061 (Nagelkerke); Modelo: χ 2 = 14,25, p = 0,007*.
Fetos com TN≥P99 apresentaram cerca de 7 vezes maior risco de rastreio positivo para atraso no neurodesenvolvimento, em comparação com fetos com TN<P95 (OR 6,80, 95% CI 0,03-0,65). Por outro lado, uma TN≥P95-99 associou-se a um risco cerca de 3 vezes superior (OR 2,9, 95% CI 0,12-0,94), quando comparado com TN normal. Estes resultados, controlados para o sexo fetal, encontram-se sintetizados no Quadro II.
Discussão
Numa recente revisão conduzida por Bilardo et al., encontra-se patente a complexidade inerente ao aconselhamento parental aquando da deteção de valores aumentados de TN em fetos euploides. (26 Desta forma, a presente investigação proporciona uma visão acerca do impacto a curto (desfechos gestacionais e materno-fetais) e a longo prazo (neurodesenvolvimento) da TN fetal aumentada, na ausência de anomalias cromossómicas, estruturais ou síndromes genéticos reconhecidos.
Reportamos uma prevalência de TN≥P95 para a IG de 6,4% (105/1648). Esta percentagem é superior à descrita na literatura disponível. No entanto, verificam-se disparidades consideráveis nos diversos estudos, variando a prevalência de TN aumentada entre 0,6 e 3,8%.2), (15), (19), (27), (28 Tais discrepâncias podem ser explicadas, essencialmente, pelos diferentes critérios utilizados para definir TN fetal aumentada. (13 Também as diferentes IG estudadas, bem como as distintas populações analisadas, podem contribuir para a discordância verificada.
No que diz respeito à avaliação do neurodesenvolvimento infantil, realizada através da escala de rastreio PARCA, obtivemos uma probabilidade de rastreio positivo para atraso do neurodesenvolvimento de cerca de 12% (12/97) para TN≥P95. Este resultado é concordante com a literatura, que reporta taxas de rastreio positivo entre 0 e 13%.15), (21), (29), (30), (31 Esta prevalência foi superior nos fetos com TN≥P99, atingindo os 21,4% (3/14). Concluímos ainda que fetos com TN≥P99 apresentam cerca de 7 vezes maior risco de rastreio positivo para atraso no neurodesenvolvimento infantil, em comparação com fetos com TN normal. Este risco é menos marcado para fetos com TN fetal≥P95-99, sendo cerca de 3 vezes superior. Os resultados vão de encontro aos relatados por Hellmuth et al. e Senat et al. (20), (21 apesar de considerarem diferentes períodos de seguimento e de serem utilizadas escalas de avaliação distintas. Não podemos deixar de referir que vários outros estudos apontam para a inexistência de relação entre o aumento da TN fetal e atraso no neurodesenvolvimento. (15), (26), (27 De facto, torna-se complexo o estabelecimento de um paralelismo entre as várias investigações sobre neurodesenvolvimento infantil, na medida em que estas diferem nos desenhos de estudo adotados, procedendo à avaliação das crianças através de estratégias distintas e nem sempre compreendendo a mesma faixa etária. Além disso, dado que algumas alterações do neurodesenvolvimento infantil se podem manifestar apenas em idades mais avançadas, estas podem não ser devidamente detetadas, condicionando uma subestimação dos resultados. Em contraponto, a ansiedade paternal pode assumir um papel importante na sobrestimação dos resultados. De facto, os pais poderão ser mais críticos na observação do desenvolvimento pós-natal nos casos de TN aumentada. Adicionalmente, não pode ser negligenciável a ausência de grupo de controlo e o reduzido número amostral de alguns estudos. (5), (28), (29
De notar ainda que, no grupo de controlo, foi observada uma prevalência de rastreio positivo para atraso no neurodesenvolvimento infantil de 3,7%, sendo a prevalência de atraso global no neurodesenvolvimento infantil de 1 a 3%, na população ocidental. (32
Curiosamente, alguns autores demostraram diferenças significativas entre a espessura da TN e o género33), (34), (35), (36 Neste estudo, verificámos que a prevalência de fetos com TN aumentada (TN≥P95-99), euploides e sem anomalias estruturais detetadas, é superior no sexo masculino. Esta diferença entre sexos não foi verificada para valores de TN≥P99. A literatura aponta como possível explicação para aumentos ligeiros da TN (≥P95-99) o crescimento fetal acelerado ou, alternativamente, um atraso na maturidade do sistema cardiovascular, mais comum em fetos do sexo masculino. (37), (38 Estes fenómenos culminam na acumulação moderada de fluido nucal, condicionando o achado ecográfico. (36
A TN aumentada no RCPT tem vindo a ser amplamente associada a desfechos obstétricos adversos, independentemente do sexo fetal. Ao analisarmos os desfechos adversos mais frequentemente citados na literatura (abortamento, morte fetal intrauterina, restrição de crescimento fetal e parto pré-termo), (2), (4), (18), (39 verificámos que a taxa de desfechos desfavoráveis no grupo com TN aumentada ronda os 8,8%. Esta prevalência é concordante com a da literatura, que reporta uma prevalência de desfechos gestacionais desfavoráveis entre os 2,7 e 25,9%.2), (12), (29), (39), (40 De destacar que não foram encontradas, neste estudo, diferenças estatisticamente significativas entre os três grupos em relação aos desfechos avaliados, a nível individual. Estes resultados são corroborados pela investigação de Westin et al. (12 e pela revisão conduzida por De Domenico et al. (7 A comparação com a restante literatura é dificultada pelo facto de não serem incluídos grupos de controlo em grande parte dos estudos examinados. (4), (5), (7), (39 É ainda de realçar a inexistência, no presente estudo, de diferenças estatisticamente significativas entre os três grupos avaliados no que diz respeito à ocorrência de abortamentos/mortes fetais intrauterinas, o que contradiz os achados descritos na revisão conduzida por Maymon et al. (13 Este facto poderá dever-se ao reduzido número de casos de perda gestacional na amostra. Mais uma vez, também os diferentes pontos de corte utilizados para classificar os valores da TN podem influenciar a contagem de casos em cada grupo e, consequentemente, as análises comparativas. Assim, estes resultados devem ser interpretados com alguma ponderação. A ocorrência de parto pré-termo também não mostrou diferir significativamente, tal como demonstrado previamente por Pajkrt et al. (41
Este estudo apresenta vantagens e limitações a serem destacadas. Como pontos fortes salienta-se a utilização de grupo de controlo e a exclusão de fetos com anomalias cromossómicas, genéticas e estruturais confirmadas, o que permite minimizar vieses associados à avaliação do neurodesenvolvimento infantil. É igualmente importante referir que este estudo é o primeiro, até onde sabemos, a proceder à avaliação, na população portuguesa, de desfechos obstétricos adversos associados à TN aumentada, além do impacto da elevação deste marcador ecográfico no neurodesenvolvimento infantil.
As limitações da presente investigação vão de encontro às de um estudo de natureza retrospetiva, sofrendo influência da quantidade e qualidade da informação disponível. Um outro obstáculo reside no facto de não ser possível controlar o caráter “operador-dependente” da ecografia do primeiro trimestre de gravidez, encontrando-se a avaliação da TN fetal, portanto, sujeita a alguma variabilidade interobservador. Por outro lado, o facto de o nosso estudo não conseguir excluir casos de síndromes genéticos não diagnosticados à data da aplicação do PARCA, pode afetar as taxas de rastreio positivo para atraso no neurodesenvolvimento infantil. (20 Contudo, a existência de grupo de controlo e o baixo número de casos expectáveis contribuem para a mitigação deste viés. A escala PARCA acarreta também algumas limitações. Sendo um teste de rastreio, os resultados estão sujeitos a erros. Se, por um lado, os resultados falsos negativos conduzem a uma subestimação dos rastreios positivos para atraso no neurodesenvolvimento, os resultados falsos positivos aumentam erroneamente as estimativas e podem gerar ansiedade desnecessária. É também fundamental aludir à impossibilidade de exclusão de vieses associados à influência das condições culturais e sócio-económicas no neurodesenvolvimento, não abordados pela escala PARCA; bem como à aplicação de questionários tipo self-report em detrimento de avaliações clínicas objetivas das crianças. Além disso, visto que os testes de rastreio visam identificar indivíduos, dentro de uma população, com risco aumentado para determinada doença, a sua eficácia depende da prevalência da doença na população considerada. Ora, a prevalência de atraso global no neurodesenvolvimento é baixa (1 a 3%).32 Assim, quanto menor a prevalência populacional, mais baixo se torna o valor preditivo positivo e mais elevada a contagem de falsos positivos.
Em termos de perspetivas futuras, visto que o aconselhamento pré-natal deve ser o mais rigoroso possível e assente em estudos de larga escala, seria meritória a condução de um estudo prospetivo, multicêntrico e com maior número amostral, compreendendo, para além do RCPT e da avaliação dos desfechos obstétricos, a avaliação do neurodesenvolvimento infantil em contexto hospitalar e por especialistas, de modo a esclarecer o atual estado da arte e a esbater algumas das limitações atribuíveis aos estudos disponíveis.
Este estudo demonstrou que, na ausência de anomalias cromossómicas, estruturais ou síndromes genéticos reconhecidos, uma TN≥P95 não se traduz em maior taxa de desfechos obstétricos desfavoráveis. Assim, apesar de ser necessária uma interpretação cautelosa e crítica dos resultados, a probabilidade de uma gravidez livre de eventos adversos é idêntica à da população geral. No entanto, existe associação entre rastreio positivo para atraso no neurodesenvolvimento infantil e valores aumentados de TN, apesar da prevalência global ser reduzida. Como tal, os pais devem ser informados deste risco aumentado, salientando-se que este é atribuído a um rastreio e não a um diagnóstico. Mostra-se relevante o aconselhamento e seguimento clínico destas crianças, nomeadamente através do encaminhamento pós-natal para consultas especializadas de pediatria do neurodesenvolvimento, com vista à realização de avaliação clínica em idade apropriada, de acordo com as metas de desenvolvimento, e estabelecimento de eventuais diagnósticos numa fase precoce.
Concluindo, os resultados não representam uma viragem de página no aconselhamento parental quando a TN é aumentada, em fetos euploides; mas alertam para a necessidade de seguimento a longo prazo destas crianças, avaliando clinicamente o seu neurodesenvolvimento.
Contribuições individuais
Vanessa Silva e Gabi Almeida - Desenho do estudo, colheita, análise e interpretação dos dados, redação do artigo e revisão crítica do conteúdo intelectual. Ambas as autoras contribuíram de igual forma para este manuscrito.
Sílvia Torres - Interpretação dos dados e redação do artigo.
Rui Miguelote - Orientação e revisão crítica do conteúdo intelectual.
Todos os autores aprovaram a versão final do manuscrito.