Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta Obstétrica e Ginecológica Portuguesa
versão impressa ISSN 1646-5830
Acta Obstet Ginecol Port vol.13 no.3 Coimbra out. 2019
ARTIGO DE REVISÃO /REVIEW ARTICLE
Tumores primários funcionantes do ovário
Primary functional tumors of the ovary
Mariana Rei1, Margarida Fernandes2, Raquel Mota3, Vera Paiva3, Antónia Costa1
Centro Hospitalar Universitário de São João, EPE Porto
1. Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Universitário de São João, Porto. Departamento da Mulher e da Criança, Faculdade de Medicina, Universidade do Porto
2. Serviço de Anatomia Patológica, Centro Hospitalar Universitário de São João, Porto
3. Serviço de Ginecologia e Obstetrícia, Centro Hospitalar Universitário de São João, Porto
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Functional ovarian tumors present a distinct biology and oncological behavior in comparison to epithelial malignancies, and its knowledge will majorly impact the diagnostic, therapeutic and prognostic approach. Hyperandrogenism, hyperestrogenism, hyperthyroidism, hypercalcemia, HCG production, carcinoid and Cushing syndrome are some of the most relevant clinical profiles. A brief discussion on the main endocrine manifestations, histological entities and differential diagnosis will be provided.
Keywords: Ovarian neoplasms; Endocrine gland neoplasms; Endocrine syndromes; Hyperandrogenism; Estrogens.
Introdução
Os tumores funcionantes ou produtores hormonais do ovário são raros, correspondendo a 5% das neoplasias do ovário. Traduzem-se por manifestações endócrinas resultantes da produção de hormonas/substâncias metabolicamente ativas, sendo as mais frequentes os estrogénios, androgénios, hormonas tiroideias, polipeptídeos e aminas biogénicas, proteína relacionada com a paratormona (PTHrP) e gonadotrofina coriónica humana (HCG)1.
Os autores realizaram uma revisão da literatura através de uma pesquisa eletrónica no motor de busca Pubmed com os termos MESH ovarian neoplasms, endocrine gland neoplasms, endocrine syndromes, hyperandrogenism, estrogens, hypercalcemia e cushing syndrome. Foram incluídas todas as publicações entre os anos 2000 e 2018, em inglês e com todos os níveis de evidência.
De salientar que o conhecimento relativo a este tipo de tumores baseia-se em publicações de fraca evidência, sobretudo em relatos de casos clínicos ou série de casos, encontrando-se limitadas revisões sobre esta temática na literatura. Constata-se uma completa ausência de evidência agrupada por produção hormonal ou substâncias ativas.
Tumores funcionantes do ovário
As manifestações clínicas dos tumores funcionantes dependem de fatores tumor-dependentes e hormono-dependentes. A sintomatologia causada diretamente pela dimensão tumoral, velocidade de crescimento tumoral, sua relação com estruturas adjacentes e disseminação à distância são os fatores tumor-dependentes. Estes são responsáveis pela distensão abdominal, dor, compressão e invasão de órgãos adjacentes com sintomas órgão-específico. O tipo de substância produzida, respetivos níveis séricos e ação metabólica atribuem-se aos fatores hormono-dependentes e irão condicionar a restante clínica associada.
Este tipo de tumores incluem toda a diversidade histológica das neoplasias ováricas, embora os mais frequentemente descritos sejam os tumores de células dos cordões sexuais/estroma (TCSEs) e de células germinativas. Os tumores epiteliais raramente são responsáveis pela produção de hormonas ou metabolitos ativos. De salientar que nem sempre existe correlação direta entre a morfologia das células e o tipo de hormona ou substância produzida.
Na maioria das vezes, os tumores funcionantes apresentam uma clínica inaugural relacionada com um quadro de hiperprodução de substâncias metabolicamente ativas. A abordagem diagnóstica compreende as seguintes etapas:
1. -Confirmação analítica/bioquímica de hipersecreção específica hormonal (determinação sérica, urinária, testes endócrinos de estimulação/frenação);
2. -Determinação da fonte produtora através de exames imagiológicos, de medicina nuclear funcional, estudos endoscópicos e/ou de testes endocrinológicos específicos. A ecografia endovaginal é o exame de eleição para a abordagem inicial de neoformações ováricas, embora nem sempre exista correlação direta entre a ecomorfologia tumoral e o perfil hormonal.
3. -Estadiamento imagiológico dos tumores ováricos. O sistema de estadiamento para os tumores não epiteliais do ovário segue as mesmas orientações definidas pela Federação Internacional de Ginecologia e Obstetrícia (FIGO) para os tumores epiteliais, sendo o estadio oncológico e a rotura capsular tumoral os fatores de prognóstico determinantes2.
A elevada suspeição clínica com consequente diagnóstico de hipersecreção hormonal pré- abordagem cirúrgica possibilita uma otimização da terapêutica. O controlo metabólico permite minimizar a descompensação grave aquando da indução anestésica e/ou manipulação cirúrgica, diminuindo assim a morbimortalidade associada ao tratamento cirúrgico.
O estadiamento cirúrgico pode ser realizado por via aberta ou minimamente invasiva, garantindo a ausência de rotura tumoral intraperitoneal, com realização de lavado peritoneal e cistectomia ovárica ou anexectomia seguida de exame extemporâneo. Em caso de malignidade, procedimentos de estadiamento cirúrgico deverão ser realizados de acordo com os protocolos oncoginecológicos em vigor3. Dado que a maioria destes tumores se apresenta em mulheres jovens, a cirurgia conservadora com preservação da fertilidade deverá ser considerada.
De seguida apresentam-se os tumores funcionantes primários do ovário segundo as manifestações clínicas apresentadas (Quadro I).
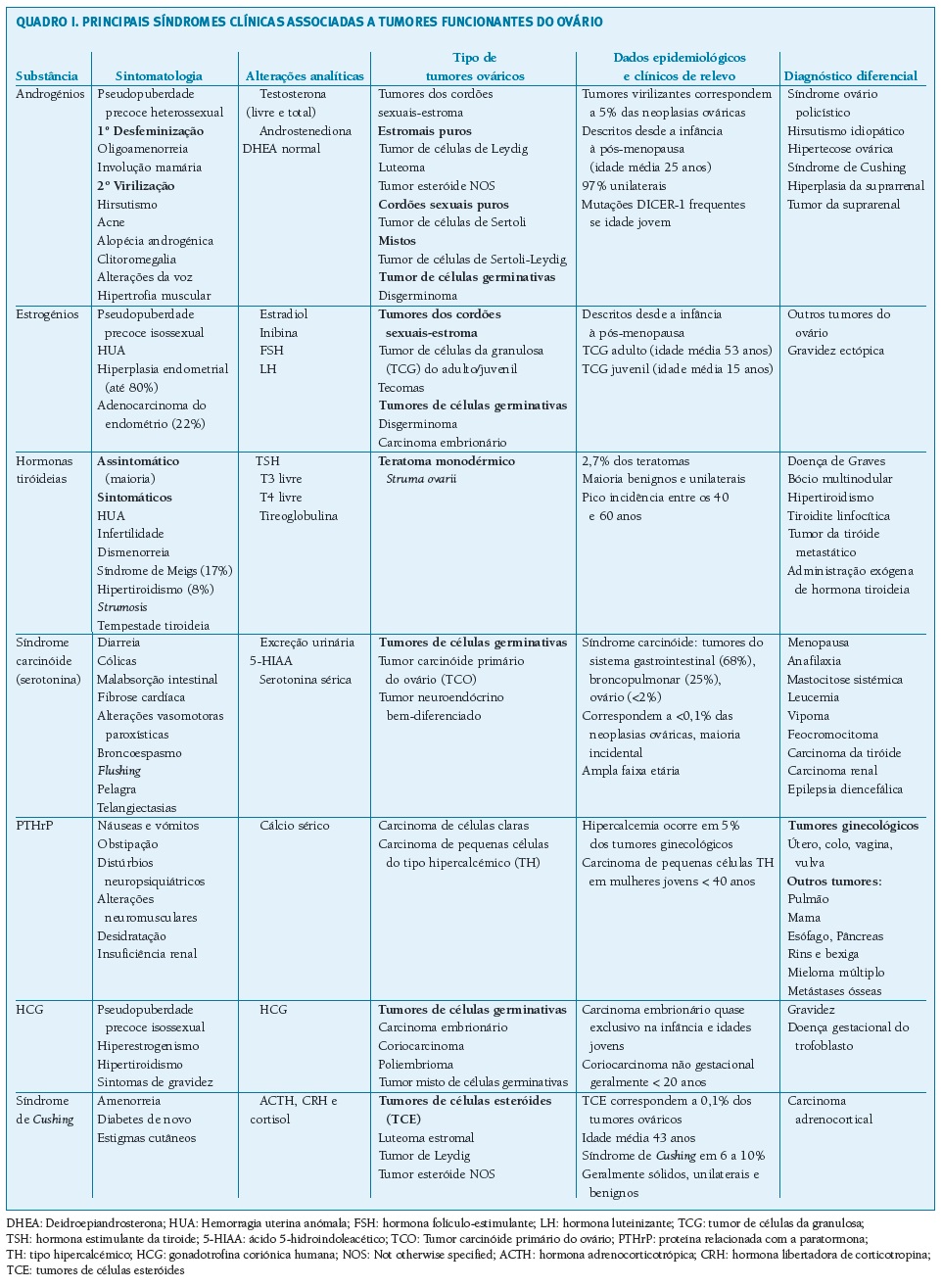
(clique para ampliar ! click to enlarge)
Hiperandrogenismo
Os tumores virilizantes do ovário são uma causa rara de hiperandroginismo (5% de todas as neoplasias do ovário)4-6. A prevalência de tumores ováricos produtores de androgénios em doentes com hiperandrogenismo é de 0,2%7.
A produção de androgénios encontra-se associada fundamentalmente aos TCSEs, em particular o tumor de células de Sertoli-Leydig, luteoma, tumor de células de Leydig e tumor de células esteroides não especificado (NOS) (79%)8. Outros tumores produtores incluem tumores de células da granulosa (TCG), tumores de células germinativas (disgerminoma) e tumores epiteliais do tipo mucinoso9,10.
Os tumores de células de Sertoli-Leydig caracterizam-se pela presença de estruturas testiculares com produção de androgénios com virilização em 70 a 85% dos doentes11. Embora geralmente descritos na segunda e terceira décadas de vida, poderão ocorrer em mulheres pós-menopáusicas12. Os tumores de Sertoly-Leydig pouco diferenciados ou retiformes são tipicamente FOXL2 negativos mas expressam a-inibina ou calretinina. Mutações do gene DICER-1 também parecem estar envolvidas13.
As manifestações clínicas variam de acordo com a idade. Na criança manifesta-se por pseudopuberdade precoce heterossexual. Na idade reprodutora e menopausa, primariamente ocorre desfeminização (oligomenorreia, involução mamária, atrofia genital) seguida de virilização (hirsutismo, acne, alopécia androgénica, clitoromegalia, aumento da líbido, alterações da voz e hipertrofia muscular)12.
O diagnóstico diferencial deve incluir outras entidades hiperandrogénicas: síndrome do ovário poliquístico, hipertecose ovárica, hiperplasia ou neoplasia da suprarrenal.
Recomenda-se o doseamento sérico de testosterona total, testosterona livre, androstenediona e deidroepiandrosterona (DHEA). Níveis elevados de testosterona confirmam a presença de uma neoplasia virilizante, enquanto concentrações normais de DHEA excluem origem supra-renal. Níveis de estradiol elevados devem-se ao processo de aromatização da testosterona, pelo que manifestações estrogénicas também se encontram reportadas.
A venopunção ovárica e supra-renal seletiva para determinação da fonte produtora de androgénios poderá ser útil no diagnóstico perante uma avaliação imagiológica inconclusiva14. Apesar de altamente eficaz na localização tumoral, trata-se de um método invasivo e não disponível em todos os centros. Em alternativa, a administração de análogos da GnRh pode funcionar como prova diagnóstica e/ou terapêutica sobretudo em doentes com contra-indicação cirúrgica15.
Hiperestrogenismo
Os tumores do ovário mais frequentemente associados à produção de estrogénios são os tumores de células da granulosa (TCG) e os tecomas, pertencentes ao grupo dos TCSEs, e menos frequentemente, tumores de células germinativas (disgerminomas e carcinomas embrionários).
Os TCG correspondem a aproximadamente 70% dos TCSEs (3 a 5% de todas as neoplasias ováricas)16. Ocorrem numa ampla faixa etária desde a infância até à idade pós-menopáusica e assumem características clinicopatológicas distintas, pelo que se consideram os TCG tipo juvenil e do adulto, correspondendo este último a 95% dos casos17.
As manifestações clínicas do hiperestrogenismo são variáveis e relacionam-se com a idade e status hormonal da doente. Na pré-puberdade manifesta-se por pseudopuberdade precoce isossexual (telarca prematura, hemorragia genital, desenvolvimento de pelo púbico e axilar, aumento do crescimento somático e da idade óssea)18. Apenas 15% dos casos de pseudopuberdade precoce são causados por tumores do ovário, sendo que a maioria está associada a TCG19.
Na idade reprodutora ou pós-menopausa, o excesso de estrogénios pode manifestar-se por tensão mamária20 e hemorragia uterina anormal (HUA) em dois terços dos casos. O padrão endometrial típico dos TCGs é a hiperplasia endometrial, com atipia em 24 a 80% dos casos, embora o adenocarcinoma esteja documentado até 22%21. São tumores hemorrágicos, que ocasionalmente sofrem rotura, resultando em dor abdominal, hemoperitoneu e choque hemorrágico20.
O hiperestrogenismo traduz-se no aumento dos níveis plasmáticos de estradiol e inibina e na diminuição da concentração de hormona folículo-estimulante (FSH) e hormona luteinizante (LH). Contudo, apesar do doseamento do estradiol ser útil na monitorização destas doentes, não apresenta sensibilidade suficiente para ser considerada um marcador tumoral nesta patologia20. A hormona anti-mulleriana (HAM), marcador da reserva ovárica tipicamente ausente em mulheres pós-menopáusicas ou submetidas a ooforectomia bilateral, apresenta níveis elevados em 75 e 78% dos TCGs tipo juvenil e do adulto, respetivamente. A sua determinação pós-operatória é útil para identificar resseção tumoral completa e eventual recidiva, com a potencial vantagem de não ser produzida por outros tumores gonadais ou extragonadais22,23. Em casos de ambiguidade morfológica, o painel imunohistoquímico de a-inibina, calretinina e FOXL2, associado à pesquisa da mutação FOXL2 (402C-G) é útil para confirmar o diagnóstico de TCG do adulto.
Do ponto de vista imagiológico, os TCG apresentam um amplo espectro de alterações, desde neoplasias sólidas com áreas císticas ou hemorrágicas, a lesões císticas uni ou multiloculares24. O estudo endometrial pré-operatório é mandatório para exclusão de neoplasias endometriais concomitantes, aquando da existência de hiperestrogenismo sobretudo em doentes com suspeita de TCG (nível IV, B)25.
À semelhança de outros tumores do ovário, o tratamento é cirúrgico com regressão das manifestações endócrinas associadas. O papel do tratamento conservador em mulheres em idade reprodutiva com TCSEs encontra-se menos estabelecido do que para os tumores das células germinativas. A preservação de útero e ovário contralateral parece uma opção segura em doentes jovens com desejo de preservação de fertilidade no estadio I (nível IV, B), mas permanece controversa para doença em estádio IC dos TCG tipo juvenil (nível V, C) e nas variantes pouco diferenciadas dos tumores de Sertoli-Leydig. Estudos recentes enfatizam que a linfadenectomia pélvica e paraaórtica não é mandatória nos TCSEs dada a baixa incidência de metastização ganglionar em estadios iniciais e o limitado impacto na instituição de terapêuticas adjuvantes e sobrevida (nível III, A)26,27.
Em 78 a 91% dos casos, os TCSEs encontram-se no estadio I aquando do diagnóstico com prognóstico favorável a longo prazo28. Embora exista um racional biológico plausível para o uso de hormoterapia, a evidência clínica permanece limitada, com taxas de resposta completa e parcial de respetivamente 26 e 45%25,29. Contudo, dada a boa tolerância e ausência de efeitos secundários significativos, pode constituir uma alternativa em casos de doença avançada ou recidiva (nível IV, B)25.
Hipertiroidismo
A produção de hormonas tiroideias associa-se fundamentalmente ao Struma ovarii, um teratoma monodérmico composto predominantemente por tecido tiroideu. O Struma ovarii é extremamente raro (2,7% de todos os teratomas)30 e associa-se a hipertiroidismo em 8% dos casos31. Estes tumores são mais comuns na idade reprodutiva com um pico de incidência entre os 40 e 60 anos32, sendo a maioria benignos e unilaterais. Os tumores malignos representam cerca de 5-37% dos casos, embora os critérios de diagnóstico de malignidade permaneçam controversos33.
A maioria destes tumores são assintomáticos. Cerca de 17% dos tumores benignos cursam com ascite, podendo associar-se ao Síndrome de Meigs33. A Strumosis é uma entidade histologicamente benigna, mas de comportamento biologicamente agressivo, caracterizada pela presença de implantes peritoneais de tecido tiroideu diferenciado.
Do ponto de vista analítico, verifica-se diminuição da hormona estimulante da tiróide (TSH) com aumento da T3 livre, T4 livre e tireoglobulina. O diagnóstico diferencial inclui outras causas de hipertiroidismo: doença de Graves, bócio multinodular, tiroidite linfocítica e administração exógena de hormona tiroideia.
Ecograficamente, o Struma ovarii é similar aos cistos dermóides, embora geralmente mais vascularizados. Não existem padrões ecográficos específicos diferenciadores de tumor benigno ou maligno32, sendo que a presença de ascite não excluí benignidade. A cintigrafia com iodo poderá ser útil no diagnóstico pré-operatório, evidenciando geralmente tecido tiroideu ativo na região pélvica.
O tratamento definitivo é cirúrgico pelo potencial de malignização. Nos casos de malignidade, a tiroidectomia total facilita o tratamento subsequente ablativo com iodo radioativo31. O tratamento médico com bloqueadores b-adrenérgicos ou antitiroideus poderá ser necessário previamente à cirurgia para estabelecer o eutiroidismo34.
Dado o elevado risco de complicações intraoperatórias graves, nomeadamente de tempestade tiroideia, a suspeição diagnóstica pré-operatória permitirá assegurar os cuidados perioperatórios adequados, reduzindo a morbimortalidade associada.
Síndrome carcinóide
A síndrome carcinóide (SC) associa-se aos tumores carcinóides produtores de polipeptídeos, aminas biogénicas e prostaglandinas, através de células neuroendócrinas. As manifestações clínicas variam de acordo com o perfil de produção endócrina e localização tumoral. Os principais órgãos/sistemas afetados são a pele, o sistema digestivo e cardiorrespiratório, com as consequentes manifestações de prurido, flushing cutâneo, telangiectasias e pelagra, diarreia e dor abdominal, alterações vasomotoras paroxísticas, fibrose valvular e broncoespasmo. Estes tumores são mais comuns a nível do trato gastrointestinal (68%) e sistema broncopulmonar (25%)35.
Os tumores carcinóides primários do ovário (TCO) correspondem a menos de 2% dos tumores carcinóides e a menos de 0,1% dos carcinomas ováricos, ocorrendo numa ampla faixa etária36. São classificados como tumores de células germinativas, sendo constituídos por células neuroendócrinas bem diferenciadas com características anatomopatológicas similares aos mesmos tipos histológicos noutras localizações37. Podem ocorrer isoladamente, derivados de teratomas ováricos, ou em associação com outros tumores ováricos como tumores mucinosos, de Brenner ou de células de Sertoli-Leydig.
A maioria dos TCO apresentam-se incidentalmente38. Um terço das doentes desenvolvem um quadro de flushing e diarreia, mais frequentemente associado ao tipo insular. A obstipação correlaciona-se com a inibição da motilidade intestinal pela produção tumoral de péptido YY39.
Entidades clínicas como a mastocitose sistémica, vipoma, feocromocitoma, epilepsia diencefálica, síndrome de taquicardia ortostática postural ou tumores carcinoides extra-ováricos deverão ser consideradas no diagnóstico diferencial.
O diagnóstico inclui a confirmação de níveis urinários elevados de ácido 5-hidroxindolacético (5-HIAA), produto final de metabolismo da serotonina. A TC (tomografia computadorizada), RM (ressonância magnética), octreoscan, endoscopia digestiva ou broncoscopia poderão ser úteis perante a suspeita de um tumor neuroendócrino. Embora as características imagiológicas deste tipo de tumor não se encontrem bem estabelecidas5, alguns autores sugerem que os TCO se apresentam como neoformações sólidas40.
No que respeita aos TCO, o tratamento baseia-se na exérese cirúrgica. Porém, perante comprovação analítica da hipersecreção carcinóide sem localização tumoral, não parece existir benefício na investigação exaustiva da referida localização, uma vez que o tratamento médico é altamente eficaz, exceto no caso de suspeita de localização digestiva sob risco de ocorrência de fibrose e outras complicações abdominais38.
A suspeita pré-operatória do diagnóstico permite a administração de octreótido para prevenção de complicações raras como a crise carcinóide, condição potencialmente grave caracterizada por alterações significativas do perfil tensional, broncoconstrição, arritmias ou alterações da consciência38.
Hipercalcémia
A hipercalcemia está descrita em 20 a 30% de todos os tumores malignos41, dividindo-se em dois subtipos: hipercalcemia osteolítica local; e hipercalcemia humoral, geralmente associada à produção de proteína relacionada com a PTHrP42.
A hipercalcemia ocorre em cerca de 5% dos tumores ginecológicos43. No ovário, esta entidade encontra-se maioritariamente associada a tumores de células claras43 e a tumores de pequenas células do ovário do tipo hipercalcémico (TH).
O carcinoma de células pequenas TH é a forma mais comum de carcinoma indiferenciado em mulheres com menos de 40 anos. É frequentemente encontrado na juventude e em 70% dos casos associa-se a hipercalcémia paraneoplásica, relacionada com a hipersecreção de PTHrP28. Trata-se de um tumor de comportamento oncológico agressivo e de prognóstico reservado com elevado risco de recorrência a curto prazo25. Estadios iniciais, idade superior a 30 anos, níveis pré-operatórios normais de cálcio sérico, dimensões inferiores a 10 cm, ausência de grandes células e citorredução completa parecem ter benefício prognóstico44.
A sintomatologia de hipercalcemia pode ser inespecífica. Habitualmente predominam os sintomas do sistema nervoso central, tais como deterioração cognitiva, alterações neuropsiquiátricas e neuromusculares. Podem ainda cursar com distúrbios renais, cardiovasculares e do trato gastrointestinal. Laboratorialmente, os tumores produtores de PTHrP cursam com aumento do cálcio sérico total e diminuição da paratormona sérica41.
O tratamento é cirúrgico, sendo crucial o controlo médico da hipercalcemia devido à possibilidade de insuficiência renal pós-operatória e exacerbação das manifestações sistémicas43, que poderá incluir fluidoterapia, administração de diuréticos, preparações de calcitonina, bifosfonatos e corticóides. A hemodiálise poderá ser considerada em casos graves.
Relativamente ao carcinoma de células pequenas hipercalcémico não existe consenso internacional relativo ao tratamento óptimo standard. Uma abordagem multimodal incluindo quimioterapia (QT) (nível III, B), cirurgia radical com estadiamento peritoneal e ganglionar, mesmo para estadios iniciais (nível IV, A) e possivelmente radioterapia (RT) (nível IV, C) é geralmente considerada45. Os regimes de QT são frequentemente extrapolados de séries de casos de carcinoma de pequenas células de pulmão, sendo os regimes de cisplatina e etoposido os mais apropriados.
Tumores produtores de HCG
Hiperestrogenismo, hipertiroidismo e sintomas de gravidez são manifestações endócrinas de tumores produtores de HCG. A produção de HCG está associada aos tumores de células germinativas, destacando-se o carcinoma embrionário, o coriocarcinoma e o poliembrioma2,46,47.
Os carcinomas embrionários são tumores raros do ovário, que ocorrem quase exclusivamente na infância e idade jovem48. Estes tumores distinguem-se dos coriocarcinomas pela ausência de células de citotrofoblasto2.
O coriocarcinoma não gestacional é extremamente raro, correspondendo a menos de 1% dos tumores de células germinativas, tanto na sua forma pura ou como tumor misto. A maioria das doentes apresentam idade inferior a 20 anos2. À semelhança dos carcinomas embrionários, apresentam manifestações endócrinas secundárias aos níveis elevados de HCG, que variam de centenas a mais de 2.000.000 mUI/mL2. A maioria das doentes apresentam pseudopuberdade precoce isossexual e HUA, apresentando por vezes quadros mimetizando gestações ectópicas.
O diagnóstico diferencial deve considerar outras entidades com elevação da HCG, nomeadamente gravidez e doença gestacional do trofoblasto. O tratamento primário é cirúrgico com particular ênfase para a necessidade de preservação da fertilidade, dada a elevada prevalência na infância e idade fértil.
Síndrome de Cushing
A doença de Cushing ocorre em 6 a 10% dos tumores de células esteróides (TCE) e deve-se à secreção ectópica de hormona adrenocorticotrópica (ACTH), hormona libertadora de corticotropina (CRH) ou cortisol50. Um quadro de amenorreia, diabetes de novo e estigmas cutâneos deverão fazer suspeitar deste diagnóstico, confirmado na presença de hipercortisolismo não suprimível. A síndrome de Cushing rapidamente progressiva representa um desafio terapêutico, dado que os debilitantes efeitos de hipercortisolismo condicionam o prognóstico, aumentando a taxa de mortalidade em três a cinco vezes49.
Os TCE constituem um subgrupo de TCSEs raro que integram três linhas celulares: luteoma estromal, tumor de Leydig e tumor de células esteróides NOS50. Embora apresentem um potencial endócrino em 75% dos casos, os TCE de secreção hormonal múltipla e simultânea são raros, estando reportado na literatura um caso de hiperandrogenismo, hipercortisolismo, hiperestrogenismo e hiperprolactinemia51,52.
Nos estudos de imagem estes tumores são geralmente sólidos e unilaterais com alterações císticas e necrose. Dadas as suas pequenas dimensões, frequentemente não são detetados em ecografia ou TC pélvica, sendo a RM o exame de eleição, demonstrando hipersinal de sequências ponderadas em T1 devido ao conteúdo lipídico e realce com gadolíneo resultante da intensa vascularização. A investigação pré-operatória perante um quadro de hipercortisolismo deverá ainda incluir exames de imagem dirigidos para exclusão de carcinoma adrenocortical.
A maioria dos TCE NOS são benignos, estando reportadas taxas de malignidade de 25 a 43% dos casos. Dimensões tumorais superiores a 7cm, mais de 2 mitoses/10CGA, necrose, hemorragia e atipia nuclear significativa são indicadores de malignidade2.
Conclusão
A baixa incidência destas neoplasias justifica o limitado conhecimento relativo a dados epidemiológicos, etiopatogenia, patofisiologia, curso clínico e fatores prognóstico.
A crescente publicação nesta área permitirá uma maior compreensão dos quadros clínicos associados aos tumores funcionantes do ovário, possibilitando um diagnóstico mais precoce, otimização terapêutica e prevenção de potenciais complicações médicas graves associadas à produção de substância metabolicamente ativas.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Olt G, Mortel R. Hormone-producing tumors of the ovary. Endocrine-related cancer 1997; 4:447-457. [ Links ]
2. Prat J. FIGO Committee on Gynecologic Oncology. Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet 2014; 124: 1-5. [ Links ]
3. Sociedade Portuguesa de Ginecologia - Secção de Ginecologia Oncológica. Consensos nacionais de Cancro Ginecológico 2016 [ Links ]
4. Stegner HE, Loning T. Endocrine-active tumors of the ovary. Pathologe 2003; 24:314-322. [ Links ]
5. Souto S, Vieira-Baptista P, Barreto F, et al. Ovarian intratumoral 21-hydroxylase deficiency in a postmenopausal hirsute woman. Arq Bras Endocrinol Metab 2012; 56-59
6. Souto S, Vieira - Baptista P, Braga D, Carvalho D. Ovarian Leydig cell tumor in a post-menopausal patient with severe hyperandrogenism. Arq Bras Endocrinol Metab 2014; 58-61
7. Carmina E, Rosato A, Janni A. Relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism. J Clin Endocrinol Metab 2006; 91-92.
8. Nishide K, Nishida M. Hormone producing ovarian tumors. In: Yakushiji M, editor. Malignant tumors of the ovary and oviduct. Tokyo: Nakayama-shoten; 1991. p. 153-164. [ Links ]
9. Tanaka Y, Saida T, Minami R, et al. MR findings of ovarian tumors with hormonal activity, with emphasis on tumors other than sex cord-stromal tumors. Eur J Radiol 2007; 62:317-327. [ Links ]
10. McGee J, Fleming N, Senterman M, Black A. Virilizing Luteinized Thecoma of the Ovary in a 15-Year-Old Female: A Case Report. J Pediatr Adolesc Gynecol 2009; 22:107-110 [ Links ]
11. Colombo N, Parma G, Zanagnolo V, et al. Management of ovarian stromal cell tumors. J Clin Oncol 2007; 25:2944-2951. [ Links ]
12. Melero Cortés L, Maestre M, Pérez-Quintela M et al. Ovarian Sertoli-Leydig cell tumours: How typical is their typical presentation?. J Obstet Gynaecol; 2017 Jul;37(5):655-659.
13. Durieux E, Descotes F, Mauduit C,, et al. The co-occurrence of an ovarian Sertoli-Leydig cell tumor with a thyroid carcinoma is highly suggestive of a DICER1 syndrome. Virchows Arch. 2016 May;468(5):631-636. [ Links ]
14. Dunne C, Havelock J. Malignant Ovarian Sertoli-Leydig Cell Tumor Localized with Selective Ovarian Vein Sampling. J Minim Invasive Gynecol 2012; 19: 789-793. [ Links ]
15. Stephens J, Katz J, Mcdermott N, et al. An unusual steroid-producing ovarian tumors. Human Reproduction 2002; 17:1468-1471 [ Links ]
16. Malmstrom H, Hogberg T, Risberg B, et al. Granulosa cell tumor of the ovary: Prognostic factors and outcome. Gynecol Oncol 52: 50, 1994.
17. Young RH, Dickersin GR, Scully RE. Juvenile granulosa cell tumor of the ovary: a clinicopathological analysis of 125 cases. Am J Surg Pathol 8: 575, 1984
18. Allmen D, Fallat M. Ovarian Tumors. In: Pediatric Surgery (7th Edition). Coran A (eds). Saunders; 2006: 529-548.
19. Wilkinson N, Osborn S, Young R. Sex cord-stromal tumours of the ovary: a review highlighting recent advances. Diagnostic Histopathology 2008; 14: 388-400. [ Links ]
20. Schumer S and Cannistra S. Granulosa Cell Tumor of the Ovary. J Clin Oncol 2003; 21:1180-1189
21. Gusberg SB, Kardon P. Proliferative endometrial response to theca-granulosa cell tumors. Am J Obstet Gynecol 111: 633.
22. Lane AH, Lee MM, Fuller AF Jr., et al. Diagnostic utility of mullerian inhibiting substance determination in patients with primary and recurrent granulosa cell tumors. Gynecol Oncol. 1999; 73:51-55. [ Links ]
23. Ray-Coquard I, Colombo N., et al. Gynecologic Cancer InterGroup (GCIG) Consensus Review for ovarian Sex Cord Stromal Tumors. Int J Gynecol Cancer.2014;24:S42-S47. [ Links ]
24. Jung S. Ovarian Sex Cord-Stromal Tumors: Computed Tomography and Magnetic Resonance Imaging. In: Cancer Imaging. Hayat M (eds). Elsevier; 2008: (32) 523-526.
25. Ray-Coquard I, Morice P, Lorusso D, et al. ESMO Guidelines Committee. Non-epithelial ovarian cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29: 1-18. [ Links ]
26. Thrall MM, Paley P, Pizer E, et al. Patterns of spread and recurrence of sex cord-stromal tumors of the ovary. Gynecol Oncol. 2011; Aug;122(2):242-245.
27. Nasioudis D, Kanninen TT, Holcomb K et al. Prevalence of lymph node metastasis and prognostic significance of lymphadenectomy in apparent early-stage malignant ovarian sex cord-stromal tumors. Gynecol Oncol 2017; 145: 243-247. [ Links ]
28. Michele Peiretti, Stefano Angioni, Valentina Corda, Nicoletta Colombo. Sex cord-stromal tumors of the ovary. Textbook of Gynecological Oncology. Chapter 87, pág. 754 - 759. ESGO 2016.
29. van Meurs HS, van Lonkhuijzen LR, Limpens J et al. Hormone therapy in ovarian granulosa cell tumors: a systematic review. Gynecol Oncol 2014; 134: 196-205. [ Links ]
30. Silva T, Guerra C. Tumores raros do ovário. In: Manual de Ginecologia. Oliveira C (eds). Pernamyer Portugal; 2009: 413-441
31. Seigel S, Hodak S. Thyrotoxicosis. Med Clin N Am 2012; 96:175-201 [ Links ]
32. Benacerraf B, Goldstein, Groszmann Y. Struma ovarii. In: Gynecologic Ultrasound: A Problem-Based Approach. Saunders; 2014: 186-188
33. Costa A, Póvoa A, Pires M, et al. Struma ovarii: a rare form of presentation and clinical review. Acta Obstet Gynecol Scand 2005; 84: 819-820 [ Links ]
34. Bahn R, Burch H, Cooper D, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract 2011; 17(3): 456-520. [ Links ]
35. Modlin I, Lye K, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97:934-959. [ Links ]
36. Rouzbahman M, Clarke B. Neuroendocrine tumors of the gynecologic tract: Select topics. Seminar in Diagnostic Pathology 2013; 30: 224-233 [ Links ]
37. Kefeli M, Usubutun A. An Update of Neuroendocrine Tumors of the Female Reproductive System. Turk Patoloji Derg 2015, 31:128-144. [ Links ]
38. Gardner G, Reidy-Lagunes D, Gehrig P. Review Neuroendocrine tumors of the gynecologic tract: A Society of Gynecologic Oncology (SGO) clinical document. Gynecol Oncol 2011; 122:190-198 [ Links ]
39. Rouzbahman M, Clarke B. Neuroendocrine tumors of the gynecologic tract: Select topics. Seminar in Diagnostic Pathology 2013; 30: 224-233. [ Links ]
40. Pappa I, Peros G, Lappas C, et al. Management of ovarian carcinoid syndrome. Int J Gynaecol Obstet. 2011 Nov;115(2):205-207. [ Links ]
41. Farias M. A Hipercalcemia nas Malignidades: Aspectos Clínicos, Diagnósticos e Terapêuticos. Arq Bras Endocrinol Metab 2005; 49:816-824. [ Links ]
42. Stewart AF. Clinical practice. Hypercalcemia associated with cancer. N Engl J Med 2005; 352(4):373-379. [ Links ]
43. Futagamia M, Yokoyamaa Y, Wakuia M, et al. A Case of Ovarian Clear Cell Carcinoma Simultaneously Producing Parathyroid Hormone-related Protein and Granulocyte Colony-Stimulating Factor. World J Oncol 2010; 1(3):138-141 [ Links ]
44. Reed NS, Pautier P, Avall-Lundqvist E et al. Gynecologic Cancer InterGroup (GCIG) consensus review for ovarian small cell cancers. Int J Gynecol Cancer 2014; 24 (9 Suppl 3): S30-S34. [ Links ]
45. Young RH, Oliva E, Scully RE. Small cell carcinoma of the ovary, hypercalcemic type. A clinicopathological analysis of 150 cases. Am J Surg Pathol 1994; 18: 1102-1116. [ Links ]
46. Alevizaki M, Huhtaniemi I. Structure-function relationships of glycoprotein hormones: lessons from mutations and polymorphisms of the thyrotrophin and gonadotrophin subunit genes. Hormone 2002; 1(4): 224-232. [ Links ]
47. Moch H, Humphrey A, Ulbright T. WHO classification of tumours of the urinary system and male genital organs. 2016. Lyon: IARC Press. [ Links ]
48. Kurman RJ, Norris HJ. Embryonal carcinoma of the ovary: a clinic-pathologic entity from endodermal sinus tumor resembling embryonal carcinoma of the adult testis. Cancer 1976; 38; 2420-2433. [ Links ]
49. Sedhom R, Hu S, Ohri A, et al. Symptomatic Cushing's syndrome and hyperandrogenemia in a steroid cell ovarian neoplasm: a case report. J Med Case Rep (2016) 10:278. [ Links ]
50. Kefeli M, Usubutun A. An Update of Neuroendocrine Tumors of the Female Reproductive System. Turk Patoloji Derg 2015, 31(Suppl):128-144. [ Links ]
51. Zang L, Ye M, Yang G, et al. Accessory ovarian steroid cell tumor producing testosterone and cortisol: A case report. Medicine (Baltimore). 2017 Sep; 96(37): e7998. [ Links ]
52. Abebe S, Erkie M, Feleke Y. A case report of steroid cell tumour of the ovary-not otherwise specified variant with hyperandrogenism, hypercortisolism, hyperprolactinemia and hyperestrogenemia. Ethiop Med J 2010; 48:67-72. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Mariana Rei
E-mail: marianarei@hotmail.com
Recebido em: 13/07/2019
Aceite para publicação: 23/08/2019














