Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Motricidade
versão impressa ISSN 1646-107X
Motri. v.5 n.4 Vila Real dez. 2009
Efeito da suplementação oral de arginina sobre a secreção de GH e metabolismo de lipídios em ratos Wistar treinados
A. Chiyoda1, P.M. Nakamura2, J.S. Codogno3, A.J. Silva Junior4, J.A. Almeida Leme3, E. Luciano4
A Suplementação Oral de Arginina (SOA) e o exercício físico são capazes de modificar a secreção do Hormônio de Crescimento (GH), interferindo no metabolismo lipídico. O objetivo do estudo foi verificar o efeito da SOA, do exercício físico aeróbio e a combinação da suplementação com o exercício sobre a secreção de GH e metabolismo lipídico em ratos. A amostra foi composta por 40 ratos machos da linhagem Wistar, divididos em grupos Controle Sedentário (CS), Arginina Sedentário (AS), Controle treinado (CT) e Arginina Treinado (AT). O AS e AT receberam a suplementação oral de arginina em dias alternados e os CT e AT realizaram exercícios de natação por 1 hora/dia com sobrecarga equivalente à 5% do peso corporal 5 dias por semana durante 4 semanas. Em conclusão, os resultados demonstram que o treinamento físico aeróbio não alterou o metabolismo lipídico e diminuiu os valores séricos de GH e a SOA não alterou a concentração de GH em ratos Wistar.
Palavras-chave: suplementação oral, metabolismo lipídico, exercício aeróbio, hormônio de crescimento
Effect of oral arginine supplementation on GH secretion and lipid metabolism in Wistar trained rats
The Oral Arginine Supplementation (OAS) and exercise are able to modify the secretion of the Growth Hormone (GH) that stimulates the lipid metabolism. The aim of the study was to verify the effect of the OAS, the aerobic exercise and the combination of the OAS with the aerobic exercise on the GH secretion and lipid metabolism in rats. The sample was composted for 40 male wistar rats, divided in four groups: Sedentary control (SC), sedentary arginine (SA), trained control (TC) and trained arginine (TA). The AS and AT received the oral supplementation in alternated days and the groups CT and AT realized swimming exercise for 1hour/day with overload equivalent to 5% of body mass five days per week during 4 weeks. The concentrations of GH were significantly difference between the sedentary groups (SC and AS) and (TC and AT) and the lipid metabolism did not change throughout all groups. In conclusions, aerobic physical training did not modify the lipid metabolism and diminishes the values of GH concentration and the OAS did not modify the concentration of GH in Wistar rats.
Key words: oral supplementation, lipid metabolism, aerobic exercise, growth hormone
O hormônio do crescimento (GH) exerce funções anabólicas que promovem o crescimento e hipertrofia muscular pela facilitação do transporte de aminoácidos para o interior das células (Fayh, Friedman, Sapata, & De Oliveira, 2007). Suas principais funções são: fortes efeitos lipolíticos, pois estimula a lipólise através da oxidação de ácidos graxos dos tecidos adiposos durante restrição calórica e no exercício físico pela ação da enzima lipoproteína lipase, promove alterações na composição corporal e reduz o metabolismo dos carboidratos para manter os níveis da glicose sangüínea (Chromiak & Antonio, 2002; Mauras et al., 2000; Moller, Jorgense, Alberti, Flyvbjerg, & Schmitz, 1990; Quisth et al., 2005).
A arginina é um aminoácido que estimula a secreção do GH através da inibição da somatostatina, a qual é um hormônio que inibe a secreção do GH (Ghigo et al., 1991). Além disso, a suplementação oral de arginina (SOA) pode aumentar os níveis de GH no repouso (Collier, Casey, & Kanaley, 2005).
Assim como a arginina, o exercício físico também é um potente estimulador para a secreção do GH, uma vez que, como outros hormônios contra-regulatórios, tendem a elevar seus níveis quando as necessidades metabólicas aumentam em situações específicas como no exercício físico agudo. No entanto, ainda é controversa a intensidade do exercício para que ocorra a secreção desse hormônio.
Estudos demonstram que exercícios de curta duração e baixa intensidade não causam resposta do GH. Entretanto, exercícios de curta duração e alta intensidade aumentam os níveis de GH significativamente (Felsing, Brasel, & Cooper, 1992). Desta forma, enquanto alguns autores acreditam em um limiar de intensidade, há fortes indícios que este aumento é linear (Wideman, Weltman, Hartman, Veldhuis, & Weltman, 2002). Em recente estudo realizado com pacientes com a doença de McCardle sugere que o lactato exerce papel fundamental na indução da secreção de GH pelo exercício em humanos (Godfrey, Whyte, Buckley, & Quinlivan, 2009).
Em relação ao exercício aeróbio existem diversos estudos que verificaram que uma sessão de exercício aeróbio é capaz de aumentar a secreção de GH (Kanaley et al., 1997; Thompson et al., 1993). Entretanto, poucos estudos verificaram a influência do exercício aeróbio crônico na secreção desse hormônio.
Prévios estudos demonstraram que o exercício físico crônico de natação, realizado na intensidade de transição metabólica aeróbia/anaeróbia em ratos, causa alterações relevantes no eixo GH/IGF (Gomes et al., 2006; Leme, Gomes, Mello, & Luciano, 2007).
Desse modo, o objetivo desse trabalho foi verificar o efeito da SOA e do treinamento físico aeróbio na intensidade moderada durante quatro semanas sobre a secreção de GH e metabolismo de lipídios em ratos Wistar.
Metodologia
Amostra
Para a realização deste estudo, foram utilizados 40 ratos machos jovens, com idade aproximada 40 dias, da linhagem Wistar (Rattus norvegicus albinus, Wistar), provenientes do Biotério Central da Universidade Estadual Paulista (UNESP) de Botucatu e mantidos no biotério do laboratório de Biodinâmica do Departamento de Educação Física, Instituto de Biociências da UNESP - Rio Claro-SP.
Os animais foram alojados em gaiolas de polietileno (5 ratos por gaiola), mantidos à temperatura ambiente de 25º C e fotoperíodo de 12 horas de claro/12 horas de escuro e alimentados com ração balanceada padrão Purina® e água ad libitum.
Os animais foram aleatoriamente distribuídos nos seguintes grupos:
- Controle Sedentário (CS): neste grupo os ratos não realizaram nenhum tipo de atividade física bem como suplementação com aminoácido arginina.
- Arginina Sedentário (AS): os ratos foram suplementados com arginina, porem não realizaram o protocolo de treinamento físico.
- Controle Treinado (CT): os animais deste grupo apenas realizaram o protocolo de atividade física proposto, sem receber nenhum tipo de suplementação.
- Arginina Treinado (AT): este grupo sofreu a intervenção tanto do protocolo de atividade física, como a suplementação de arginina.
Procedimentos
Para a realização da suplementação de arginina foi utilizado o método oral de gavagem para assegurar a ingestão total da dose proposta no experimento. A dose administrada para os animais foi de 128 mg de arginina para cada kg de peso corporal dos ratos previamente pesados, sendo tal dose adaptada de trabalho similar (Collier et al., 2005).
A administração do suplemento foi realizada em dias alternados, sendo que os animais receberam uma única dose por dia, sendo aplicados três dias de suplementação por semana.
O protocolo de exercícios consistiu de natação por 1 hora/dia, 5 vezes/semana, durante 4 semanas consecutivas, em uma intensidade considerada aeróbia, com uma sobrecarga equivalente à 5% do peso corporal acoplada ao tórax dos animais (Gomes et al., 2006). A realização do protocolo de exercício era iniciada 1 hora após a administração de arginina.
Período de adaptação: Com a finalidade de se respeitar o princípio fisiológico da sobrecarga, os animais realizaram uma adaptação ao meio aquático com aumento progressivo da sobrecarga, durante o período de uma semana.
As sessões de natação foram realizadas em tanques de amianto com 100 cm de comprimento, 70 cm de largura e 60 cm de altura. A água era mantida numa profundidade de 40 cm, para que os animais não apoiassem a cauda no fundo do tanque. A temperatura da água foi controlada, sendo mantida em 31ºC ± 1ºC, durante a realização do exercício, por ser considerada termicamente neutra em relação à temperatura dos ratos. Todas as sessões foram realizadas no período das 15:00 horas.
Os animais tiveram peso corporal, comprimento oral-anal, ingestão alimentar e hídrica registrados semanalmente.
Ao final das quatro semanas de treinamento, os animais foram mantidos em repouso por 48 horas em relação à última sessão de exercícios, com livre acesso a comida e água. O sacrifício foi realizado por decapitação em guilhotina e foram coletadas amostras teciduais e sanguíneas. O sangue foi centrifugado a 3000 rpm por 10 minutos e a partir do soro foram realizadas as seguintes análises: colesterol total, TG, HDL-C e LDL-C séricos dosados pela técnica da colesterol oxidase-peroxidase (Henry, Cannon, & Wilkeman, 1974). O GH Sérico, foi determinado pelo método de radioimunoensaio (RIA) - Kit Coat-ACount da Diagnostic Products Corporation (DPC) de duplo anticorpo.
Análise estatística
O teste de Kolmogorov-Smirnov foi utilizado para verificar a normalidade dos testes.
Para a análise da composição corporal no inicio e no final do experimento e as variáveis bioquímicas (TG, HDL, LDL, Colesterol total) foi utilizado a ANOVA two-way sendo que os fatores foram treinamento (sedentário X treinado) e arginina (com ingestão e sem ingestão). Para comparar as médias de GH nos grupos treinamento e arginina foi utilizado a ANOVA fatorial. O post hoc de Scheffé foi utilizado para as comparações.
Todos os dados foram analisados usando um programa estatístico (Statistica 6.0, Stat Soft Inc, Tulsa, Oklahoma, USA).
Valores foram expressos em média ± desvio padrão. O nível de significância foi mantido em p<0,05.
Resultados
A média e o desvio padrão da suplementação de arginina no inicio do treinamento para os ratos foi de 16,59±1,80 g e no final do treinamento foi de 38,0±3,70 g.
Os pesos e os comprimentos dos ratos dos quatro grupos experimentais foram menores no inicio do experimento quando comparado com o último dia (p<0,05). De acordo com os dados resportados no quadro 1, não se verificaram diferenças estatísticas para o peso e o comprimento dos ratos entre os grupos (p>0,05).
Quadro 1. Média e desvio-padrão (DP) dos pesos (g) e comprimentos (cm) dos ratos nos quatro grupos experimentais no inicio e no final do experimento
| Grupos | CS (M ± DP) | AS (M ± DP) | CT (M ± DP) | AT (M ± DP) |
| Peso | ||||
| Início (g) | 130 ± 16,69 | 126 ± 12,39 | 126 ± 13,43 | 129 ± 17,21 |
| Final (g) | 311 ± 36,07 * | 316 ± 45,76 * | 286 ± 37,16 * | 292 ± 17,52 * |
| Comprimento | ||||
| Início (cm) | 17,5± 0,67 | 18,0 ± 0,44 | 17,1± 0,61 | 17,0 ± 0,82 |
| Final (cm) | 22,09 ± 0,70 * | 23,0 ± 0,76 * | 22,6 ± 1,02 * | 22,7 ± 0,36 * |
* Diferença estatística em relação ao início do experimento. CS: grupo controle sedentário; AS: grupo arginina sedentário; CT: grupo controle treinado; AT: grupo arginina treinado
As concentrações de LDL, HDL, TG e colesterol total não foram diferentes entre os grupos (CS, AS, CT e AT) com p>0,05. Os valores de média e desvios padrão dos quatro grupos para as variáveis metabólicas estão apresentados no quadro 2.
Quadro 2. Média ± desvio-padrão do LDL, HDL, TG e Colesterol Total nos grupos CS, AS, CT e AT
|
| CS (M ± DP) | AS (M ± DP) | CT (M ± DP) | AT (M ± DP) |
| LDL (mg/dL) | 34,9 ± 17,1 | 38,1 ± 13,3 | 43,4 ± 9,5 | 43,3 ± 7,7 |
| HDL (mg/dL) | 50,5 ± 3,5 | 47,5 ± 2,5 | 46,6 ± 4,4 | 46,7 ± 3,6 |
| TG (mg/dL) | 185,1 ± 44,5 | 179,1 ± 59,3 | 183,7 ± 59,3 | 194,5 ± 45,7 |
| Colesterol (mg/dL) | 110,2 ± 19,5 | 107,4 ± 9,6 | 119,4 ± 19,3 | 113,1 ± 7,1 |
A figura 1 apresenta os valores séricos do hormônio do crescimento (GH). A concentração de GH apresentou diferença significativa no treinamento sendo que os grupos sedentários (CS e AS) apresentaram maiores valores do que os grupos treinados (CT e AT).
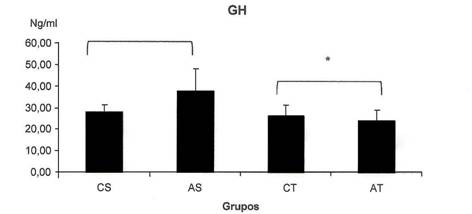
Figura 1. Concentrações do hormônio de crescimento (GH) em Ng/ml nos quatros grupos (CS, AS, CT e AT). * Diferença significativa entre o grupo treinado e sedentário
Discussão
O presente estudo teve como objetivo verificar o efeito da suplementação oral de arginina (SOA), do exercício aeróbio e a combinação da SOA com o exercício físico nos valores séricos de GH e no metabolismo lipídico. A hipótese foi que a suplementação oral de arginina, o exercício e a combinação entre os dois pudessem alterar a secreção de GH e, conseqüentemente, modificar o metabolismo de lipídios. Em nosso estudo o treinamento aeróbio moderado e a administração da SOA, não causaram efeitos fisiológicos no metabolismo lipídico de animais sem alterações patológicas.
Em relação ao peso corporal e comprimento foi observado um aumento destes valores ao final do experimento para todos os grupos.Nos valores do peso corporal do grupo AT nota-se que o desvio padrão do peso na fase final manteve-se quase idêntico à inicial (inicial:17,52, final: 17,21), porém nos outros grupos esse valor duplicou no mínimo. Para o comprimento o desvio padrão do grupo AT diminuiu em relação ao início (inicial: 0,36 e final: 0,82), ao contrário dos restantes grupos nos quais se observou um aumento.
Nas condições experimentais utilizadas para a realização do presente estudo a SOA não foi capaz de alterar a concentração sérica de GH. Prévios estudos apresentaram resultados que indicaram que a SOA administrada isoladamente pode aumentar a secreção de GH (Collier et al., 2005; Collier, Collins,& Kanaley, 2006; Kanaley, 2008). Contudo, existem na literatura estudos em que a SOA pode apresentar um efeito dose-resposta. Trabalhos realizados em humanos por Collier et al. (2005, 2006) demonstraram que a administração de arginina resultou em elevação de 45% em 9 g quando comparado a 5 g, o que indica que adeno-hipófise foi capaz de liberar mais GH em doses elevadas evidenciando a existência de uma relação dose-resposta. No presente estudo, a dose administrada foi 128 mg por peso corporal dos animais e não causou alterações nas concentrações séricas de GH.
A intensidade, o tipo e a duração do exercício físico são importantes estímulos para induzirem alterações nas concentrações de GH (Kanaley et al., 1997; Nindl, Hymer, Daniel, & Kraemer, 2001; Sartorio et al., 2006; Stokes, 2003; Stokes, Nevill, Frystyk, Lakomy, & Hall, 2005; Weltman et al., 1997; Wideman et al., 2002; Zaccaria, Varnier, Piazza, Noventa, & Ermolao, 1999). No presente trabalho o treinamento físico aeróbio de intensidade moderada realizado durante o período experimental reduziu a concentração sérica de GH.
Estudando exercício físico agudo, Felsing e colaboradores (1992) estudaram o efeito agudo do exercício físico agudo e compararam as concentrações de GH abaixo do limiar anaeróbio (↓LA) e acima do LA (↑LA) em testes com durações de 1, 5 e 10 minutos. Os autores demonstraram que ocorreram elevações nas concentrações séricas de GH nos testes ↓LA, mas sem diferença significativa. Nos testes ↑LA, as concentrações séricas de GH foram crescentes e maiores que ↓LA e apenas acima de 10 minutos ocorreram diferenças significativas entre as 3 sessões. As concentrações do GH acima do limiar crítico induzem anabolismo tecidual (juntamente com o fator de crescimento semelhante à insulina IGF-1) e protéico, lipólise pelo tecido adiposo, diminuiem a captação de glicose pelos músculos e elevam a sua produção pelo fígado (Butler & Le Roith, 2001; Guyton & Hall, 2006). Além disso, o exercício de curta duração e alta intensidade é capaz de aumentar a secreção de GH.
Uma única sessão deste tipo de exercício resulta em elevada concentração de GH no sangue (Felsing et al.,1992), pelo aumento do tônus colinérgico que pode potencializar a resposta do GH pela supressão do hormônio somatostatina e elevação das concentrações de GHRH (Collier et al., 2006). Contudo, o aumento induzido pelo exercício agudo tende a ser reduzido no exercício crônico (Deuschle et al., 1998). Esta redução na resposta ao exercício agudo em indivíduos treinados pode estar relacionada à redução da formação de lactato em mesma intensidade de exercício, sendo o lactato um dos principais estimuladores da secreção de GH durante o exercício, ou ainda por alterações na resposta molecular ao GH e concentrações das proteínas transportadoras (Godfrey, Madgwick, & Whyte , 2003; Wideman et al., 2002).
Desta forma, o treinamento físico em baixa intensidade pode induzir respostas diferentes nas concentrações de GH quer seja agudamente por redução na produção de lactato durante o exercício quanto cronicamente pelo aumento da responsivdade ao GH circulante ou ainda por outros fatores como tipo, volume e duração do treinamento, sexo, idade, estado nutricional e estado de sono dos indivíduos (Godfrey et al., 2003; 2006; Wideman et al., 2002;).
As concentrações séricas de GH em nosso experimento ainda podem ter sido influenciadas pelo tempo de treinamento que os ratos foram submetidos (4 semanas). Leme e colaboradores (2007) investigaram o efeito de treinamento moderado de curta duração na concentração do IGF-I em ratos diabéticos. Os resultados encontrados demonstram que após 4 semanas de treinamento com 1 hora de duração realizada cinco vezes por semana não houve alterações nas concentrações séricas e hepáticas de IGF-I.
Em seus estudos, Collier e colaboradores (2006) verificaram o efeito da combinação entre exercício resistido e suplementação oral de arginina ou placebo. Os autores concluíram que a maior resposta do GH no exercício quando comparado com SOA mais o exercício resistido poderia ser causada por uma diminuição nas respostas somatotrópicas devido a downregulation dos receptores ou do segundo mensageiro; ou a ocorrência de um período refratário somatrotópico causado pela repetitiva estimulação do GHRH liberado tanto pela ação da arginina quanto pelo exercício. Em nosso estudo, o SOA e o treinamento aeróbio não apresentaram interação e não causaram mudanças nas concentrações séricas de GH.
Assim, através dos resultados encontrados conclui-se que o treinamento físico aeróbio moderado não alterou o metabolismo lipídico e diminui os valores séricos de GH em ratos Wistar e a SOA não alterou a concentração de GH.
Dessa forma, futuros estudos são necessários para estudar os efeitos de diferentes tipos, intensidades e períodos de treinamento sobre a secreção do GH e metabolismo lipídico, visto que uma limitação do estudo foi o tempo relativamente pequeno de treinamento e a baixa concentração da SOA.
Da mesma forma, estudos utilizando diferentes concentrações de arginina podem contribuir para o progresso do conhecimento dessa área.
Bibliografia
Butler, A. A., & LeRoith, D. (2001). Control of growth by the somatropic axis: Growth hormone and the insulin-like growth factors have related and independent roles. Annual Review of Physiology, 63, 141-164.
Chromiak, J. A., & Antonio, J. (2002). Use of amino acids as growth hormone-releasing agents by athletes. Nutrition, 18(7-8), 657-661.
Collier, S. R., Casey, D. P., & Kanaley, J. A. (2005). Growth hormone responses to varying doses of oral arginine. Growth Hormone & IGF Research, 15(2),136-139.
Collier, S. R., Collins, E., & Kanaley, J. A. (2006). Oral arginine attenuates the growth hormone response to resistance exercise. Journal of Applied Physiology, 101, 848-852.
Deuschle, M., Blum, W. F., Frystyk, J., Orskov, H., Scweeiger, U., Weber, B., et al. (1998). Endurance training and its effect upon the activity of the GH-IGFs system in the elderly. International Journal of SportsMedicine,19, 250-254.
Fayh, A. P., Friedman, R., Sapata, K. B., & De Oliveira, A. R. (2007) Effect of L-arginine supplementation on secretion of human growth hormone and insulin-like growth factor in adults. Arquivos Brasileiros de Endocrinologia & Metabologia, 51(4), 587-592. [ Links ]
Felsing, N. E., Brasel, J. A., & Cooper, D. M. (1992). Effect of low and high intensity exercise on circulating growth hormone in men. Journal of Clinical Endocrinology and Metabolism, 75, 157-162.
Ghigo, E., Arvat, E., Valente, F., Niclosi, M., Boffano, G. M., Procopio, M., et al. (1991). Arginine reinstates the somatotrope responsiveness to intermittent growth hormone releasing hormone administration in normal adults. Neuroendocrinology, 54(3), 291-294.
Godfrey R.J., Madgwick, Z., & Whyte, G.P (2003).The exercise-induced growth hormone response in athletes. Sports Medicine, 33(8), 599-613.
Godfrey, R.J., Whyte, G.P., Buckley, J., & Quinlivan, R (2009). The role of lactate in the exercise-induced human growth hormone response: Evidence from McArdle disease. British Journal Sports Medicine, 43(7), 521-525.
Gomes, R.J., Mello, M.A.R., Caetano, F.H., Sibuya, C.Y., Anaruma, C. A., Rogatto, G.P., et al. (2006). Effects of swimming training on bone mass and the GH/IGF-1 axis in diabetic rats. Growth Hormone & IGF Research,16, 326-331.
Guyton, A. C., & Hall J. E. (2006). Textbook of Medical Physiology. Pennsylvania: Elsevier Saunders.
Henry, R. J., Cannon, D. C., & Wilkeman, J (1974). Clinical chemistry, principles and techniques (2ª edição). New York: Harper and Harper Row Publishes.
Kanaley, J. A. (2008). Growth hormone, arginine and exercise. Current Opinion in Clinical Nutrition and Metabolic Care, 11(1), 50–54.
Kanaley, J. A., Weltman, J. Y., Veldhuis, J. D., Rogol, A. D., Hartman, M. L., & Weltman, A. (1997). Human growth hormone response to repeated bouts of aerobic exercise. Journal of Applied Physiology, 83(5), 1756-1761.
Leme, J. A. C. A., Gomes, R. J., Mello, M. A. R., & Luciano E. (2007). Effects of short-term physical training on the liver IGF-I in diabetes rats. Growth Factors, 25(1), 9-14
Mauras, N., Obrien, K.O., Welch, S., Rini, A., Helgeson, K., Vieira, N.E., & Yergey A.L. (2000). Insulin-like growth factor I and growth hormone (GH) treatment in GH-deficient humans: Differential effects on protein, glucose, lipid, and calcium metabolism. Journal of Clinical Endocrinology and Metabolism, 85, 1686-1694.
Moller, N., Jorgense, J. O., Alberti, K. G., Flyvbjerg, A., & Schmitz O. (1990). Short-term effects of growth hormone on fuel oxidation and regional substrate metabolism in normal man. Journal of Clinical Endocrinology & Metabolism, 70(4), 1179-1186.
Nindl, B. C., Hymer, C. H., Daniel D. R., & Kraemer, W. J. (2001). Growth hormone pulsatility profile characteristics following acute heavy resistance exercise. Journal of Applied Physiology, 91, 163-172.
Quisth, V., Enoksson, S. Blaak, E., Hagstrom-Toft, E., Arner, P., & Bolinder, J. (2005). Major differences in noradrenaline action on lipolysis and blood flow rates in skeletal muscle and adipose tissue in vivo. Diabetologia, 48(5), 946-953.
Sartorio, A., Agostini, F., Marinone, P. G., Proietti, M., Lafortuna, C. L., Maffiuletti, N. A., et al. (2006). Human growth hormone responses to repeated bouts of sprint exercise with different recovery periods between bouts. Journal of Applied Physiology, 100, 1093-1094.
Stokes, K. (2003). Growth hormone responses to sub-maximal and sprint exercise. Growth Hormone & IGF Research, 13(5), 225-238.
Stokes, K., Nevill, M., Frystyk, J., Lakomy, H., & Hall G. (2005). Human growth hormone responses to repeated bouts of sprint exercise with different recovery periods between bouts. Journal of Applied Physiology, 99, 1254 -1261.
Thompson, D. L., Weltman, J. Y., Rogol, A. D., Metzger, D. L., Veldhuis, J. D., & Weltman, A (1993). Cholinergic and opioid involvement in release of growth hormone during exercise and recovery. Journal of Applied Physiology,75, 870-878
Weltman A., Weltman, J. Y., Womack, C. J., Davis, S. E., Blumer, J. L., Gaesser, G. A., & Hartman, M. L. (1997). Exercise training decreases the growth hormone (GH) response to acute constant-load exercise. Medicine & Science in Sports & Exercise, 29(5), 669-676.
Wideman, L., Weltman, J. Y., Patrie, J. T., Bowers, C. Y., Shah, N., Story, S., Veldhuis, J. D., & Weltman, A. (2000). Synergy of L-arginine and GHRP-2 stimulation of growth hormone in men and women: Modulation by exercise. American Journal of Physiology: Regulatory Integrative Comparative Physiology, 279(4), 1467-1477.
Wideman, L., Weltman, J. Y., Hartman, M. L., Veldhuis, J. D., & Weltman, A. (2002). Growth hormone release during acute and chronic aerobic and resistance exercise recent findings. Sports Medicine, 32(15), 987-1004.
Zaccaria, M., Varnier, M., Piazza, P., Noventa, D., & Ermolao, A. B. (1999). Blunted growth hormone response to maximal exercise in middle-aged versus young subjects and no effect of endurance training. Journal of Clinical Endocrinology and Metabolism, 84(7),2303-2307.
Submetido: 09.05.2009 | Aceite: 04.12.2009
1Alberto Chiyoda. Instituto de Biociências - Departamento de Educação Física. Universidade Estadual Paulista - UNESP- Rio Claro/SP; Pós-Graduação em Biodinâmica da Motricidade Humana - UNESP; Núcleo de Atividade Física, Esporte e Saúde - NAFES/UNESP.
2Priscila Nakamura. Instituto de Biociências - Departamento de Educação Física. Universidade Estadual Paulista - UNESP- Rio Claro/SP; Pós-Graduação em Biodinâmica da Motricidade Humana - UNESP; Núcleo de Atividade Física, Esporte e Saúde - NAFES/UNESP; Bolsista CAPES – Brasil.
3Jamile Codogno e José Almeida Leme. Instituto de Biociências - Departamento de Educação Física. Universidade Estadual Paulista - UNESP- Rio Claro/SP; Pós-Graduação em Biodinâmica da Motricidade Humana - UNESP; Bolsista CNPq – Brasil.
4Autran Silva Junior e Eliete Luciano. Professor Adjunto do Instituto de Biociências - Departamento de Educação Física. Universidade Estadual Paulista - UNESP- Rio Claro/SP; Pós-Graduação em Biodinâmica da Motricidade Humana - UNESP.
Endereço para correspondência: Alberto Chiyoda, Rua Barão de Piracicamirim, 1645, Bloco S, Apt. 11 Piracicaba, São Paulo, Brasil - CEP 15000-000. E-mail: beto_chiyoda@yahoo.com.br














