Introdução
A nanotecnologia é um conjunto de conhecimentos e de tecnologia que utiliza materiais e as suas interações ao nível molecular e atómico (tamanhos entre 0,1 e 100 nm) (Hock & Gralinski, 2020; Zeng et al., 2021). O pequeno tamanho das nanopartículas é comparável ao dos ácidos nucleicos, proteínas e anticorpos (Zeng et al., 2021) e as alterações das suas propriedades físicas e químicas, em comparação com os seus análogos macromoleculares, oferecem muitas vantagens para a medicina contemporânea como maior fiabilidade na administração de medicamentos, diagnóstico e tratamento não invasivos e direcionados, reduzindo as reações adversas e os efeitos sistémicos (Hock & Gralinski, 2020; Nikolova et al., 2020).
No entanto, as mesmas diferenças nas propriedades físicas e químicas das nanopartículas podem levar a efeitos colaterais graves e imprevisíveis para o corpo humano e para o ecossistema global, incluindo os efeitos mutagénicos, cancerígenos, aumento do potencial inflamatório e toxicidade (Zeng et al., 2021). A nanotecnologia auxilia no diagnóstico e tratamento de doenças degenerativas (Ling et al., 2021), como o Alzheimer, na qual apresenta um grande potencial quer no diagnóstico quer numa abordagem alternativa de tratamento (Ling et al., 2021), visto conseguirem atravessar a BHE diminuindo assim os sintomas da doença (Ling et al., 2021).
A doença de Alzheimer (DA), principal causa de Demência, inicia com a acumulação anormal de agregados Aβ que se depositam sob a forma de placas amiloides e emaranhados neurofibrilares da proteína tau levando à perda de neurónios (Figura 1), resultando em danos cerebrais que afetam o sistema cognitivo (A. Li et al., 2021).

Figura 1 Comparação de um cérebro saudável com um cérebro com Alzheimer. Adaptado de Sousa (Sousa, 2017).
De acordo com o Relatório da OCDE de 2017 (OECD, 2017), são apresentados novos dados sobre a prevalência da demência, colocando Portugal como o quarto país com mais casos por cada mil habitantes. A média da OCDE é de 14,8 casos por cada mil habitantes, sendo que para Portugal a estimativa é de 19,9. De acordo com este relatório, a estimativa do número de casos com demência para Portugal sobe para mais de 205 mil pessoas, número que subirá para os 322 mil casos até 2037 (OECD, 2017).
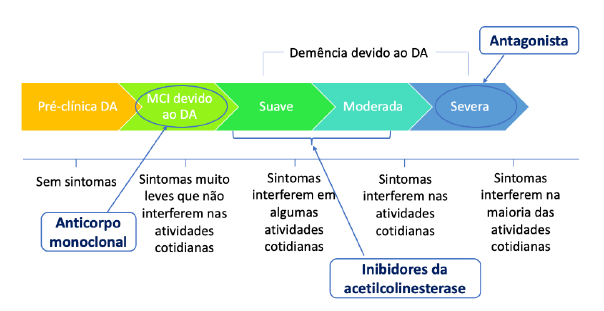
A doença de Alzheimer pode ser classificada em cinco fases: pré-clínica, MCI (comprometimento cognitivo leve provocado pela DA), suave, moderada e severa, sendo que cada uma das fases apresenta alterações neuropatológicas e sintomas específicos assim como terapêuticas diferenciadas (Faiyaz, 2021), Figura 2.
A etiologia subjacente da DA permanece desconhecida e muitas pesquisas são direcionadas em relação à sua patogénese envolvendo múltiplos fatores que foram apresentados como hipóteses, destacando-se acumulação de proteína β-amiloide (Aβ), hiperfosforilação da proteína tau e hipótese colinérgica (Figura 3) (Menghani et al., 2021; Zeng et al., 2021).
A hipótese da cascata Aβ é das teorias mais amplamente aceites para a patogénese da DA e tem dominado as pesquisas dos últimos 30 anos. Uma das evidências que suporta esta hipótese é a acumulação excessiva de péptidos Aβ que eventualmente levam à formação de placas senis extracelulares (SPs) no cérebro (Yiannopoulou & Papageorgiou, 2020). Sabe-se que Aβ é um metabolito normal do corpo, hidrolisado a partir da proteína precursora (APP) da β-amiloide. Assim, em condições fisiológicas normais, a maior parte das APP são clivadas por α-secretase, β-secretase e γ-secretase formando um fragmento solúvel. Contudo, ao mesmo tempo, algumas Aβ são clivadas por β-secretase e γ-secretase no lisossoma citoplasmático; em condições normais a produção e degradação estão em equilíbrio dinâmico, mas quando o metabolismo da proteína precursora é anormal, a produção aumentada de Aβ e/ou diminuição da degradação, leva a um grande aumento da acumulação de Aβ. Como resultado do equilíbrio dinâmico de Aβ entre as formas fibrosas, oligoméricas e monoméricas, o estado oligomérico deste peptídeo é o mais tóxico e, por isso, a contínua acumulação causará um movimento das estruturas para essa forma, produzindo um efeito tóxico nos neurónios (Fulop et al., 2018; Zeng et al., 2021).
A hiperfosforilação da proteína tau é outro mecanismo neuropatológico possível que leva à DA (Ma et al., 2017; Sharma et al., 2019). As pesquisas mostram que pacientes mais idosos com DA podem apresentar valores até 300 % acima do valor normal da proteína tau quando comparados com pacientes saudáveis (Zeng et al., 2021).
As proteínas tau são altamente solúveis e associadas aos microtúbulos; a principal função desses compostos é estabilizar os microtúbulos, especialmente axónios, na forma fosforilada. Os efeitos fisiológicos da fosforilação da tau incluem a regulação dinâmica dos microtúbulos, crescimento de sinapses e transporte axonal (Sharma et al., 2019). Assim, sob condições fisiológicas, a fosforilação e desfosforilação da proteína tau permanecem em equilíbrio dinâmico, mas no caso de DA, vários fatores interagem e levam à hiperfosforilação. Portanto, a hiperfosforilação das proteínas tau tende a agregar anormalmente filamentos espirais emparelhados, perdendo a capacidade de manter a normal morfologia e função dos microtúbulos, processo que resulta em dano degenerativo dos neurónios (Ma et al., 2017). A hiperfosforilação da proteína tau também ocupa anormalmente o sítio de ligação da tubulina o que faz com que seja difícil para as proteínas de condução retornarem normalmente ao microtúbulo, isso leva também à perda da função microscópica e dano irreversível nos neurónios (Ma et al., 2017; Zeng et al., 2021).
A acetilcolina (ACh) é o primeiro defeito no neurotransmissor que foi encontrado na DA. Apo-lipo-proteína E (APOE) é o genótipo mais importante associado à DA. A Colina acetil-transferase e a acetilcolinesterase são os principais marcadores para neurónios colinérgicos que desempenham um papel importante na síntese e degradação de ACh (Hampel, et al., 2018a; Hampel, et al., 2018b).
O nível de ACh diminuiu nas áreas do cérebro - córtex e hipocampo - que estão envolvidos na cognição e na memória. São afetados principalmente os neurónios colinérgicos do núcleo basal e do córtex entorrinal (Hampel, et al., 2018a; Hampel, et al., 2018b).
Este reconhecimento do papel da acetilcolina na memória e aprendizagem levam à hipótese colinérgica. A melhor abordagem usada na DA é a inibição da colinesterase. A Tacrina foi o primeiro medicamento aprovado para uso clínico em DA. O donepezilo (Aricept®), rivastigmina (Exelon®) e galantamina (Reminyl®) são os três novos inibidores de colinesterases atualmente disponíveis (Menghani et al., 2021).
Atualmente as terapias convencionais para DA consistem na utilização de inibidores da acetilcolinesterase (Galantamina, Tacrina, Donepezil, Rivastigmina) e antagonista (Memantina) (Zeng et al., 2021).
Os inibidores da acetilcolinesterase são medicamentos que restringem a quebra da acetilcolina pela enzima colinesterase e, portanto, levam a um aumento da concentração de acetilcolina nas fendas sinápticas (Yiannopoulou & Papageorgiou, 2020). Em Portugal os três medicamentos aprovados para as fases leve a moderada são a donepezila, rivastigmina e galantamina.
Relativamente ao método antagonista, a memantina indicada para os casos moderados ou graves, é o único medicamento de N-metil D-Aspartato (NMDA) autorizado em Portugal no tratamento da DA. A disfunção mitocondrial e a sobrecarga de cálcio foram resultadas da excitotoxicidade mediada do glutamato, levando ao aumento de óxido nítrico responsável pela formação de altos níveis de oxidantes e apoptose neuronal. Este processo completo é bloqueado pelo antagonista recetor NMDA (Barbosa et al., 2020; Menghani et al., 2021).
Estas terapias apenas aliviam os sintomas sendo acompanhados por efeitos como náuseas, diarreias e em alguns casos, efeitos a nível cardíaco (Vaz & Silvestre, 2020; Zeng et al., 2021). Medicamentos como a Tacrina foram retirados do mercado devido à sua hepatotoxicidade.
Em junho de 2021 foi aprovado pela FDA o medicamento Aducanumab, trata-se de um anticorpo monoclonal humano com capacidade para reduzir em dose e forma as placas Aβ acumuladas no cérebro (Dunn et al., 2021; Walsh et al., 2021).
1. Métodos
A metodologia consiste em uma revisão bibliográfica realizada a partir da consulta às principais plataformas de comunicação científica consultadas através do Google Académico, como Science Direct, Web of Science, PubMed e Scielo. Numa primeira fase, efetuou-se a pesquisa dos artigos científicos contidos nas plataformas científicas previamente citadas para definir e desenvolver os aspetos relacionados ao tema a ser apresentado: as nanopartículas no tratamento da doença de Alzheimer, incluindo as nanopartículas desenvolvidas, as técnicas mais promissoras e a toxicidade dos nanomateriais. A pesquisa fez-se através da análise de palavras-chave presentes nos títulos, nos resumos e nos termos indexados que descrevem os artigos.
Durante a investigação bibliográfica, as principais palavras-chave pesquisadas foram: “Alzheimer’s disease”, “nanotechnology”, “nanomaterials”, “toxicity” e “PLGA” tendo sido considerados para esta revisão os artigos publicados durante o período de 2011 a 2021. A Figura 4 foi obtida pelo software VOSviewer a partir das palavras-chave presentes nos artigos selecionados, em que sua ocorrência tenha acontecido no mínimo duas vezes em dois artigos diferentes. O tamanho do círculo indica a frequência de ocorrência de cada palavra-chave e as linhas revelam suas conexões. A nuvem criada indica que as palavras-chave mais frequentes foram “nanoparticles” e “Alzheimer’s disease” o que está de acordo com o intuito da revisão bibliográfica proposta.
A análise com o software VOSviewer selecionou 8 palavras-chave das 48 referências bibliográficas utilizadas, reunidas em 3 grupos, com um total de 18 links. Os grupos encontram-se apresentados na Tabela 1, onde mostra-se a ocorrência de cada palavra, a quantidade de links e o ano médio de publicação.
Este artigo de revisão visa apresentar informação relacionada a aplicação das nanopartículas no tratamento da doença de Alzheimer e a informação foi complementada explicando questões relacionadas a toxicidade dessas partículas, ou seja, os possíveis impactos adversos na saúde humana.
Tabela 1 Grupos das palavras-chave contidas na bibliografia utilizada para este artigo de revisão
| Grupo | Palavra-Chave | Ocorrências | Links | Ano médio de publicação |
|---|---|---|---|---|
| 1 | Alzheimer's disease | 5 | 5 | 2018 |
| Oxidative stress | 2 | 1 | 2018 | |
| Tau protein | 2 | 1 | 2018 | |
| 2 | Nanoparticles | 6 | 4 | 2018 |
| PLGA | 2 | 2 | 2017 | |
| Polyoxometalates | 2 | 1 | 2013 | |
| 3 | Drug delivery | 3 | 3 | 2019 |
| Nanomaterials | 2 | 1 | 2020 |
2. Resultados
Nanopartículas no tratamento da doença de alzheimer
Uma nova e promissora abordagem para o tratamento da DA reside no desenvolvimento de nanopartículas capazes de atravessar a BHE e atuar diretamente sobre as causas da doença, como na dissolução de placas senis e emaranhados neurofibrilares (Karthivashan et al., 2018).
Até à data, já foram realizados diversos estudos promissores, porém, ainda nenhum foi aprovado para testes em humanos, devido à possibilidade de desencadearem efeitos colaterais graves e imprevisíveis (Karthivashan et al., 2018).
2.1 Nanopartículas desenvolvidas
As propriedades físico-químicas das nanopartículas encontram-se intimamente relacionadas com o seu tamanho, forma, material, características da superfície, entre outras, nesse sentido foram desenvolvidas várias formulações (Figura 5), que procuram dar resposta a um problema comum - o tratamento da DA (Sajid & Płotka-Wasylka, 2020).

Figura 5 Tipos de Nanopartículas desenvolvidas para o tratamento da DA. Adaptado de Karthivashan et al., 2018.
2.1.1 Nanopartículas inorgânicas e orgânicas
Estudos demonstraram que nanopartículas de PLGA carregadas com fator de crescimento vascular endotelial (VEGF-NS) foram capazes de reduzir a deposição do peptídeo β-amilóide, com consequente diminuição na perda de neurônios e anomalias cerebrais vasculares (Baranowska-Wójcik & Szwajgier, 2020; Herrán et al., 2013; Menon et al., 2012). Na Figura 6 encontra-se as micrografias dadas pela Microscopia Eletrónico de Transmissão (MET) de um exemplo deste tipo de nanopartículas.

Figura 6 Imagens de MET representam a morfologia de (A) PLGA-PVA (~157 nm) e (B) PLGA-PF127 NPs (~150 nm). Ambos os NPs são esféricos em forma com uma camada externa fraca característica de NPs feita por dupla emulsão. Adaptado de Menon et al., 2012.
2.1.2. Nanopartículas de Iões Metálicos
O estudo efetuado sobre o efeito de nanopartículas de óxido de zinco (ZnONPs) (Figura 7) na inibição da formação de produtos finais de glicólise avançada (AGEs), associadas ao desenvolvimento da DA, mostrou que as ZnONPs atuam como um forte antioxidante capaz de inibir a formação de AGEs, protegendo a estrutura proteica, podendo ser promissoras na prevenção ou reversão de patologias primárias do sistema nervoso central (Ashraf et al., 2018; Baranowska-Wójcik & Szwajgier, 2020).
2.1.3 Nanolipossomas
Estudos efetuados sobre o efeito de nanolipossomas (Figura 8) sobre a agregação de peptídeos de β-amilóide (1-42), mostraram que os nanolipossomas contendo curcumina ou derivados inibem a formação de Aβ fibroso e oligomérico in vitro, o que é importante no tratamento da doença de Alzheimer (Baranowska-Wójcik & Szwajgier, 2020; Taylor et al., 2011).
No que diz respeito ao efeito destes nanomateriais verificou-se ainda que os nanolipossomas formados a partir de um peptídeo originado do domínio de ligação ao recetor da apolipoproteína E (APOE), são capazes de atravessar a BHE. Após injeção de nanolipossomas funcionais em ratos transgénicos APOE/presenilina 1, ocorreu a inibição da formação e desagregação de sistemas Aβ in vitro. Ainda neste estudo, os investigadores constataram que a coroa de olietilenoglicol (PEG) de nanopartículas poliméricas de longa circulação (NPs) é capaz de reter Aβ tóxico, tanto em solução como no soro sanguíneo (Balducci et al., 2014; Baranowska-Wójcik & Szwajgier, 2020).
2.1.4 Polímeros biodegradáveis
A combinação de Polietilenoglicol (PEG), Solanumtuberosumlectina (STL), polilactídeo poliglicólico (PLGA) (Figura 9) para a formação de uma nanopartícula, carregada com fator de crescimento de fibroblasto básico resultou num tratamento notável para DA. Neste estudo, a via de administração das NPs foi intranasal, permitindo a administração de uma maior quantidade de fármacos em comparação com a administração feita por via intravenosa (Arya et al., 2019; Zhang et al., 2019).
2.1.5 Nanogéis
Os nanogéis auto-organizados (NGs) (Figura 10) carregados com Curcumina (Cur-HA NGs) podem inibir a agregação de Aβ e a citotoxicidade. Os resultados mostraram que a taxa de inibição foi 69% e o teste de citotoxicidade mostrou que as células SH SY5Y incubadas com Aβ e Cur-HA NGs tiveram uma inibição 28% maior taxa do que a mistura de Aβ e ácido hialurónico (HA). Espera-se que este inibidor possa ser utilizado para desenvolver agentes eficazes contra a agregação de Aβ e citotoxicidade (Y. Li et al., 2014; Zeng et al., 2021).
2.1.6 Nanocompósitos
O nanocompósito esférico NC-KLVFF consiste numa encapsulação de albumina de soro bovino (BSA) numa camada de polímero contendo KLVFF reticulado sintetizado por polimerização in situ. Os resultados mostram que o NC-KLVFF é capaz de se combinar com monómeros Aβ para formar o agregado Aβ/NC-KLVFF (Figura 11), evitando assim a formação de fibras e mitigando os danos neuronais induzidos pela deposição do peptídeo Aβ, com consequente redução da inflamação e restaurando a capacidade fagocítica da microglia intracraniana (Zeng et al., 2021; Zhang et al., 2019).
2.2 Técnicas mais promissoras
De entre as técnicas analisadas, as que mais se realçam são aquelas que têm como alvo terapêutico os monómeros Aβ e a hiperfosforilação da proteína tau. Além disso, as melhores técnicas são aquelas que garantem que as nanopartículas são capazes de atravessar a BHE, atingir o seu alvo terapêutico, bem como garantir que estas partículas não induzem efeitos tóxicos no organismo.
Atualmente, as nanopartículas mais utilizadas no desenvolvimento de novas terapias para a DA assentam em iões metálicos, como o ouro, e polímeros biodegradáveis, como o PLGA.
2.2.1 Nanopartículas de ouro
Estudos efetuados mostram que o Polioxometalato (POM) de fórmula molecular K8(P2CoW17O61) (4534,95 g mol-1) é capaz de inibir a formação de agregados do peptídeo β-amilóide (Aβ), sendo que os POMs com a estrutura Wells-Dawson (POMD) exibem o melhor efeito inibitório (Geng et al., 2011).
Vários péptidos que atuam como inibidores da β-sheet mostram-se muito eficientes na prevenção da fibrilogénese, de entre os quais se destaca o péptido LPFFD.
Assim, a combinação do POMD e LPFFD possui uma maior capacidade de ligação e de redução dos efeitos tóxicos do Aβ. Para conjugar os dois, os autores utilizaram nanopartículas de ouro (AuNPs) como caroço, originando as partículas AuNPs@POMD-pep. As partículas de ouro permitem ainda a passagem eficaz pela BHE (Pramanik et al., 2011).
A morfologia das AuNPs@POMD-pep foi analisada por Microscopia Eletrónico de Transmissão (MET) (Figura 11). O tamanho das partículas é de cerca de 21,7 nm e são formadas por um caroço de ouro, revestido por aniões POMD, com cerca e 1,35 nm de espessura. A avaliação do potencial zeta das partículas mostrou que estas não se combinariam facilmente com a maioria das proteínas presentes no sangue, devido à sua carga negativa.

Figura 12 Imagens MET das nanopartículas de ouro (A e B) e sua representação esquemática (C). Adaptado de N. Gao et al., 2015.
Segundo o trabalho desenvolvido por N. Gao et al. (2015) para avaliar a agregação de Aβ em fibrilhas, utilizou-se Tioflavina T, cuja fluorescência aumenta exponencialmente quando ligada a agregados amiloides. Na presença das AuNPs@POMD-pep, a fluorescência sofreu uma redução de 47%, provando a sua capacidade em inibir a formação de fibrilhas. Também foi comprovada a eficácia das AuNPs@POMD-pep na dissolução de agregações Aβ pré-existentes e verificou-se uma redução de cerca de 37% da capacidade de fluorescência após a adição das nanopartículas (Figura 12).

Figura 13 Variação da intensidade normalizada em função do tempo durante a inibição (A) e desagregação (B) de agregados de Aβ. Adaptado de N. Gao et al., 2015.
Por forma a avaliar os efeitos das AuNPs@POMD-pep na redução da citotoxicidade provocada pelos aglomerados Aβ, utilizaram-se células não tratadas, com fibrilhas Aβ, como controlo positivo. A viabilidade celular das do grupo tratado com o péptido Aβ1-40 foi de 58%, enquanto as células tratadas com AuNPs@POMD-pep apresentaram uma taxa de sobrevivência superior a 90%. Além disso, a adição das AuNPs@POMD-pep mostrou-se não tóxica a diferentes concentrações e tempos de incubação (Figura 13).

Figura 14 Efeito da NPs de ouro na viabilidade celular (A), a diferentes concentrações (B) e em diferentes tempos de incubação (C). Adaptado de N. Gao et al., 2015
2.2.2 Nanopartículas de PLGA
O T807 é um agente utilizado na tomografia de emissão de positrões para a imagiologia da DA (Ono et al., 2017). Exibe uma grande afinidade para com as regiões do cérebro que apresentam maior fosforilação da proteína tau. Devido ao seu baixo peso molecular e ao seu coeficiente de partição adequado, o T807 consegue atravessar a BHE e possui uma boa permeabilidade celular. Por este motivo e sendo seguro in vivo, tem sido amplamente utilizado no desenvolvimento de novas terapias para a DA, baseadas no mecanismo da hiperfosforilação da proteína tau (Barret et al., 2017).
O revestimento de nanopartículas de PLGA com membranas dos eritrócitos (RBCm) intactas permite desenvolver RBCNPs, que possuem tanto as características físico-químicas de materiais sintéticos como a as funções biológicas complexas de um material endógeno. Uma particularidade importante destas NPs é a sua capacidade de preservar a integridade das RBCm, incluindo a proteína CD47, que é capaz de inibir a fagocitose por parte dos macrófagos.
Projetou-se a síntese de RBCNPs modificadas com DSPE-PEG3400-T807, capazes de atravessar a BHE e direcioná-las especificamente à tau no interior das células neuronais. Estas nanopartículas foram carregadas com Curcumina, que demonstrou ter efeitos positivos na redução da sintomatologia da DA (Figura 14) (C. Gao et al., 2020).

Figura 15 Representação esquemática da atuação in vivo (A) e preparação das NPs de PLGA (B). Imagem MET da aparência morfológica das NPs de eritrócitos (C.1), NPs carregadas com CUR (C.2 e C.3) e PLGA + RBCm + Cur+ T807 (C.4). Adaptado de C. Gao et al., 2020.
A avaliação da estabilidade das T807/RBCNP-CUR em condições fisiológicas, foi efetuada utilizando soro bovino para simular as condições in vivo. Este estudo permitiu concluir que não ocorreu a formação de agregações ou sedimentações após 24h, pelo que as nanopartículas são adequadas para utilização in vivo. De forma a avaliar a biossegurança das nanopartículas contendo em PLGA, foram efetuados vários estudos com finalidade de mostrar o seu efeito na viabilidade celular, estes permitiram concluir que não se verificaram alterações significativas relativamente aos grupos de controlo (Lemoine et al., 2017; Marinho et al., 2017).
3. Toxicidade dos nanomateriais
O desenvolvimento da nanotecnologia tem permitido grandes conquistas em diferentes áreas, incluindo na saúde. Porém, os nanomateriais podem também representar uma ameaça para a saúde, na sua tentativa de a melhorar (Nikolova et al., 2020).
Diversos autores têm tentado avaliar os efeitos tóxicos das nanopartículas inorgânicas em linhas celulares e em modelos animais, porém, os resultados obtidos são contraditórios. A capacidade das nanopartículas provocarem efeitos inflamatórios e oxidativos já foi demonstrada, e sabe-se que esta capacidade pode levar a citotoxicidade e genotoxicidade, com dano à molécula de ADN, perturbação de genes e alterações metabólicas (León-Silva et al., 2018).
O tamanho das partículas está diretamente relacionado com a sua toxicidade, sendo que, em regra geral, quanto menor é o tamanho, maior é a toxicidade. Isto deve-se ao facto de quanto menor for o tamanho de uma partícula, maior é a sua capacidade de penetração nas barreiras biológicas, o que pode resultar na sua acumulação em compartimentos celulares ou órgãos, como o cérebro, onde não é comum ocorrer acumulação de com materiais convencionais (Catalán & Norppa, 2017). Algumas destas nanopartículas são passíveis de se deslocar até outros órgãos, através das correntes sanguínea e linfática, podendo acumular-se e causar danos nos mesmos (Z. Li et al., 2018).
Na nanomedicina é utilizada uma grande variedade de materiais. Os mais frequentes são a prata, o ouro, a platina, a sílica, o carbono e óxidos de zinco e ferro (León-Silva et al., 2018).
Alguns dos estudos referidos ao longo deste trabalho utilizam nanopartículas de ouro como nanocarriers (N. Gao et al., 2015), a versatilidade destas partículas potencia a sua utilização em nanomedicina (León-Silva et al., 2018). Porém, enquanto metal pesado, o ouro pode provocar danos no ambiente e na saúde humana. Tanto as nanopartículas de ouro carregadas positivamente como as carregadas negativamente podem causar toxicidade aguda e crónica (Z. Li et al., 2018). A avaliação da toxicidade destas nanopartículas tem sido muito estudada, porém, os resultados obtidos são contraditórios. Ainda assim, muitos autores apontam para a possibilidade das partículas de ouro se alojarem no fígado, e passarem por um processo de eliminação muito longo. Estes estudos provaram ainda que as NPs de ouro desencadeiam a geração contínua, provocando stress oxidativo que acaba por levar à morte das células, geralmente por necrose. Nestas células, verifica-se que os genes pró-inflamatórios se encontram ativos, ao contrário dos genes relacionados com o ciclo celular (Jia et al., 2017).
Vários nanomateriais orgânicos, como o polímero biodegradável PLGA, foram apontados como promissores no que toca à libertação de fármacos localizada, dado serem muito biocompatíveis e apresentam boa biodegradabilidade e baixa citotoxicidade (C. Gao et al., 2020).
A descarga não controlada de nanopartículas no ambiente pode provocar sérios danos nos ecossistemas, tanto em microrganismos, como em animais e plantas (León-Silva et al., 2018; Z. Li et al., 2018). NPs de PLGA afetam a nitrificação e as bactérias nitrificantes essenciais existentes no solo (Nishu et al., 2020).
4. Discussão
As NPs de ouro mostram-se capazes de atravessar a BHE, carregando fármacos essenciais para a inibição da agregação dos peptídeos Aβ, bem como dissolver fibrilhas pré-existentes. À semelhança destas partículas, a grande maioria das possibilidades terapêuticas em estudo baseiam-se na sua atuação sobre a inibição da formação de aglomerados da proteína β-amilóides e a dissolução de fibrilhas pré-formadas. Porém, a grande maioria destes ensaios falharam, colocando a eficácia desta abordagem em causa.
Assim, outra possível abordagem terapêutica é a atuação sobre a hiperfosforilação da proteína tau. NPs constituídas por polímeros biodegradáveis e biocompatíveis, como o PLGA, constituem uma abordagem promissora e segura, tendo sido muito utilizada nestes estudos. A sua associação com agentes farmacológicos ou naturais, como a curcuma, garante-lhes a biocompatibilidade, biodegradibilidade e eficácia necessárias à diminuição dos níveis de tau hiperfosforilada intracelulares, suprimir a apoptose e diminuir o stress oxidativo, aliviando os sintomas da DA, ocorrendo a recuperação de algumas capacidades cognitivas.
Uma característica importante da DA é o aumento da geração de ROS. As partículas de ouro e as partículas de PLGA mostraram-se eficazes na redução do stress oxidativo, bem como aumentaram a taxa de sobrevivência celular.
Os estudos efetuados mostram-se muito promissores no que diz respeito à reversão dos sintomas associados à DA, contrariamente ao que acontece com as terapias atualmente aprovadas, que apenas são capazes de atrasar o desenvolvimento da patologia. As NPs apresentam ainda menos efeitos secundários do que os tratamentos convencionais, permitindo melhorar a qualidade de vida dos pacientes. Porém, desconhece-se o potencial tóxico destas NPs a longo prazo, dado que os tratamentos devem prolongar-se no tempo, podendo levar à acumulação de metais pesados, como o ouro, no organismo, ou à acumulação de substâncias ativas, como a curcumina no cérebro, não existindo ainda qualquer estudo que permita aferir as consequências destes tratamentos.
Para que exista um avanço mais significativo da utilização segura de nanopartículas na medicina, é necessário que sejam continuamente realizados estudos que avaliem o seu efeito inflamatório e oxidativo. A maioria dos estudos foca-se nos efeitos agudos das nanopartículas, sendo que futuramente é necessário avaliar os riscos associados à exposição prolongada às mesmas.
A segurança dos nanomateriais é avaliada tendo por base diretrizes pré-existentes que não são capazes de dar uma resposta concreta e certa dos perigos que podem advir da utilização dos mesmos. Ainda que o desenvolvimento de nanopartículas já venha a ocorrer há mais de 30 anos, o desenvolvimento de métodos e protocolos standard necessários para assegurar a biossegurança das mesmas ainda não existem, pelo que é difícil avançar para a aplicação destas terapias em humanos.
Conclusão
Têm sido estudadas várias abordagens terapêuticas promissoras, no entanto, ainda nenhuma resultou numa terapia aprovada, uma vez que é difícil manter concentrações adequadas de fármaco no espaço intraneuronal. A citotoxicidade de uma nanopartícula tem de ser avaliada, de forma a testar a sua biocompatibilidade. O estabelecimento de doses consideradas tóxicas é um pré-requisito para a aprovação de uma nanopartícula, porém estes valores são muito difíceis de estabelecer, sendo quase impossível prever os efeitos citotóxicos em regiões extra-neuronais, que podem advir da terapia com nanopartículas.
Além disso, num sistema biológico complexo, como é o caso do organismo humano, as interações biológicas, como as respostas imunes e a absorção, e as propriedades físico-químicas das nanopartículas, como o tamanho, a forma, a carga da superfície, a concentração e a estabilidade in vivo, têm de ser consideradas para que se possa compreender o seu potencial citotóxico, o que torna a esta análise muito complexa. Porém, as NPs de PLGA não são capazes de atravessar a BHE per si, sendo necessário associá-las a agentes capazes de melhorar esta capacidade, de forma que os fármacos possam ser libertados diretamente sobre o alvo, reduzindo os efeitos sistémicos e melhorando a qualidade da terapia.
Corroborando com o referido anteriormente, ainda que exista evidência de que as nanopartículas são capazes de tratar algumas doenças de forma eficiente, as dúvidas sobre a possibilidade de existirem efeitos secundários, que poderão ou não ser mais danosos para o organismo do que a doença que pretendem tratar, inviabilizam ainda a sua utilização.
Apesar da incerteza associada a estes métodos, a verdade é que estes abrem uma nova porta no que toca ao tratamento de doenças do foro neurodegenerativo, permitindo tratar a patologia, revertendo as causas e mitigando os sintomas.