Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.16 n.1 Lisboa jan. 2010
Tumor carcinóide do timo – Caso clínico
Lina Carvalho1, Luís Eugénio Fernandes2, Filipe Ferreira3, Filipa Januário3, Diogo Robles3, Inês Sanches3, Edgar Vaz3, Manuel Antunes2
1 Anatomia Patológica
2 Cirurgia Cardiotorácica
3 Alunos da disciplina de Oncologia – 6.º ano – Medicina – Faculdade de Medicina da Universidade de Coimbra/6th year Oncology medical students
Resumo
Os tumores neuroendócrinos primários representam cerca de 4% do total dos tumores do mediastino anterior, incluindo o timo, afectando mais homens que mulheres numa razão de 3:1 e apresentando uma maior incidência entre os 40 e os 60 anos. Antigamente classificados como timomas, desde 1972 são considerados um grupo distinto de neoplasias tímicas, podendo ser biologicamente activos, estando sobretudo associados à síndroma NEM-1 (19 a 25% dos doentes, sendo nestes casos mais agressivos).
São descritos como tendo grande progressão local, recorrência e metástases em elevada percentagem de casos, o que determina um mau prognóstico. O estadiamento é o parâmetro mais importante para determinar a sobrevida. Tumores detectados em fase precoce e capsulados associam-se a um excelente prognóstico, enquanto em estádios avançados, localmente invasivos, têm prognóstico relativamente pobre.
A remoção cirúrgica completa, para todos os tumores tímicos, é a base da terapêutica e o factor crítico para a sobrevivência a longo prazo, independentemente do tipo histológico. São uma causa de morte importante, nomeadamente os tumores associados a NEM-1 e síndroma de Cushing, e há autores que defendem a realização de timectomia profiláctica nestes doentes.
Palavras-chave: Timo, carcinóide, prognóstico.
Thymic carcinoid – case report
Abstract
Primary neuroendocrine tumours (carcinoid tumours) account for about 4% of anterior mediastinal tumours concerning thymus localization. They appear to have a male predilection (3:1 ratio) and occur mostly between 40 and 60 years of age. Classified primarily as thymomas, they have been considered a different group of thymic neoplasia since 1972. They can be biologically active, mostly associated with MEN-1 (19-25% of patients and more aggressive in these cases).
As a locally invasive disease, with recurrence and metastasis in a high percentage of cases, it correlates with a poor prognosis. Staging is the most important determinant of survival. Encapsulated tumours diagnosed in early stages have an excellent prognosis, while locally invasive tumours in more advanced stages have a relatively poor prognosis as happens with thymomas.
Complete surgical removal is the critical factor for long-term survival rates and the basis for treatment of all thymic tumours, independent of histologic type. As an important cause of death, especially in carcinoid tumours associated with MEN-1 and Cushing’s syndrome, some authors advocate the need for profilactic thymectomy in these patients.
Key-words: Thymus, carcinoid, prognosis.
Introdução
O timo localiza-se no mediastino anterior, deriva da 3.ª bolsa faringobraqueal e começa a sua formação a partir da 6.ª semana in utero.
Histologicamente é constituído por túbulos epiteliais que se organizam em lóbulos tímicos, formando o córtex e a medula. O córtex é rico em linfócitos T e tem poucas células epiteliais, ao contrário da medula, onde predominam células epiteliais. Ao longo destas zonas ocorre a maturação dos linfócitos T à medida que estes migram do córtex para a medula. Esta determinação embrio nária vai permitir entender a histogénese dos timomas1.
Em 1999, a Organização Mundial de Saúde (OMS) actualizou a classificação dos tumores do timo. A classificação dos timomas baseia-se na avaliação histológica da componente neoplásica epitelial e quantidade relativa do componente linfocítico não neoplásico15 (Quadro I), sendo a sua aplicação consensual. Foi mantida na edição de 20042-4.
Quadro I – Classificação histológica dos timomas (WHO 2004)
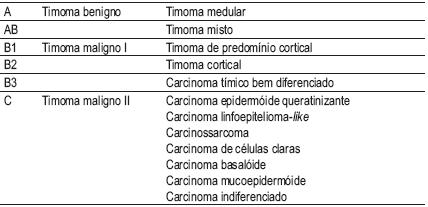
Os carcinomas neuroendócrinos estão incluídos no grupo de tumores designado por carcinoma tímico e abrangem os tipos histológicos seguintes: carcinoma neuroendócrino bem diferenciado (carcinóide típico e atípico) e carcinoma neuroendócrino pouco diferenciado (carcinoma neuroendócrino de células grandes e carcinoma neuroendócrino de células pequenas) semelhando a classificação deste grupo de tumores no brônquio e pulmão2,5-8.
Na edição de 2004 foram também acrescentados os tipos histológicos seguintes ao grupo do tumores epiteliais do timo:
– Tumor tímico epitelial combinado: neoplasia que tem pelo menos duas áreas distintas, cada uma correspondendo ao timoma e/ou carcinoma tímico, incluindo o carcinoma neuroendócrino (a combinação mais frequente é o tipo B2 e o B3, seguido do tipo B3 combinado com o carcinoma tímico das células escamosas);
– Timoma micronodular: 1% a 5% dos timomas é encapsulado e raramente está associado à miastenia gravis. Poderá estar associado ao tipo A;
– Timoma metaplásico bifásico: designado anteriormente como “timoma com estroma pseudosarcomatoso” e “carcinoma metaplásico de baixo grau”;
– Carcinoma e adenocarcinoma;
Os tumores do timo são raros, mas são os tumores do mediastino anterior mais frequentes nos adultos (representam cerca de 50% das massas com esta localização) e a maioria dos doentes está entre os 40-60 anos de idade. A etiologia continua desconhecida e actualmente nenhuma anomalia cromossómica foi associada ao tipo histológico específico de timoma ou carcinoma tímico. A incidência é semelhante em ambos os sexos, embora alguns estudos mostrem uma ligeira predominância do sexo masculino, nomeadamente do carcinoma tímico9-11.
Os autores apresentam um caso de carcinóide tímico e abordam o comportamento clínico desta entidade com base na literatura disponível, estabelecendo uma comparação com os restantes tumores do timo.
Caso clínico
Doente do sexo masculino, com 37 anos, admitido nos Hospitais da Universidade de Coimbra em Julho de 2006 devido a desconforto retroesternal recente, sem história de tosse, expectoração, dispneia ou queixas constitucionais. Tinha antecedentes pessoais de amigdalectomia aos 9 anos, esteatose hepática e litíase renal esquerda (detectados por ecografia abdominal em 2006). Sem alergias conhecidas, o doente tinha cessado hábitos tabágicos (30 UMA) um ano antes e referia consumo moderado de álcool. Apresentava um bom estado geral, sem alterações ao exame físico.
Na recolha analítica observou-se hemoglobina de 20,4 g/dl (N=14-18 g/dl) e VS de 37 mm/h (N<15 mm/h). A radiografia torácica (Rx tórax) mostrou uma massa de contorno regular e bem definido, com procidência no bordo esquerdo do mediastino, a nível da janela aortopulmonar. A tomografia axial computorizada torácica (TACt) revelou uma massa de tecidos moles no mediastino anterior, de localização justaaórtica, bem delimitada e de contornos ligeiramente polilobulados, com cerca de 4,7×3,7 cm, com plano de clivagem com as estruturas adjacentes, sofrendo realce periférico após contraste intravenoso, não se detectando adenopatias mediastino-hilares (Fig. 1). A broncofibroscopia, provas de função respiratória e ECG não revelaram alterações.
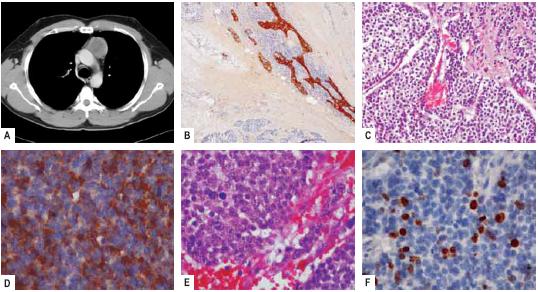
Fig. 1 – A: corte da TACt pré-operatória; B: caracterização da localização intratímica da neoplasia pela CK 19 e negatividade das células neoplásicas, CK19 X 40; C: padrões trabecular e sólido, HE X 100; D: marcação granular da cromogranina citoplasmática (TTF-1 negativa), cromogranina X 200; E: mitose visível, HE X 200; F: índice proliferativo superior a 10%, Ki 67 X 200
Cerca de três semanas depois do episódio clínico, o doente foi submetido a intervenção cirúrgica para excisão da massa mediastínica, por esternotomia mediana, com dissecção da loca tímica, sem complicações intra ou pós-operatórias.
A peça operatória consistia numa formação nodular com 46 g de peso e 6,5×3,5×3,8 cm de dimensões, envolvida por uma fina cápsula brilhante e acinzentada, com áreas suspeitas de invasão. O padrão histológico correspondia a um tumor carcinóide com padrão sólido e trabecular, intratímico e sem invasão da cápsula do órgão, áreas extensas de necrose e índice mitótico superior a 10% (Ki 67).
Por imunoistoquímica, as células neoplásicas mostraram positividade citoplasmática para cromogranina e queratina (Fig. 1). Três gânglios linfáticos mediastínicos não apresentavam metástases, permitindo classificar este carcinoma neuroendócrino bem diferenciado no estádio I da classificação de Masaoka (T1 N0 Mx).
No período pós-operatório foram realizados doseamentos hormonais: ACTH e PTH normais; cortisol sérico de 26,0 μg/dl (N= 5-25 μg/dl) e cortisol urinário de 139 μg/24h em 3150cc (N = 10-80 μg/24h).
O cintigrama com pentetreótido-In111 (receptores de somatostatina) não mostrou lesões; no entanto, havia dois pequenos focos de valorização duvidosa no andar médio do mediastino posterior, pelo que um mês após a cirurgia realizou radioterapia adjuvante em 28 fracções de 180 cGy, numa dose total de 50,40Gy (fotões de 18 MV). Durante este tratamento surgiu eritema da pele irradiada e disfagia discreta para sólidos. Após o término da radioterapia adjuvante, decidiu-se pela não realização de quimioterapia. Aos 6 meses de pós-operatório, foi realizada uma ressonância agnética nuclear torácica (RMNt), onde se observou no lobo superior do pulmão esquerdo (segmento ápico-posterior) uma área de hipersinal ligeiro, compatível com processo inflamatório em resolução ou processo fibrótico residual.
Actualmente, 2009, o doente é vigiado em consultas de oncologia médica e radioterapia, não apresentando alterações clínicas ou imagiológicas.
Discussão
Os tumores neuroendócrinos do timo são tumores pouco frequentes, representando até 4% do total dos tumores do mediastino anterior e menos de 1,8% do conjunto de tumores neuroendócrinos8. Antigamente classificados como timomas, desde 1972 que são considerados um grupo distinto de neoplasias tímicas11. São neoplasias que afectam mais o homem que a mulher, numa razão 3:1, com maior incidência entre os 40 e os 60 anos. O caso clínico apresentado diz respeito a um doente do sexo masculino de 37 anos, aproximando-se desta maneira do pico de incidência12,13.
A apresentação clínica mais frequente diz respeito a manifestações relacionadas com efeito de massa local (tumores entre 6 -20cm de maior diâmetro), sendo os sintomas mais comuns a dor ou desconforto torácico, tosse, dispneia ou síndroma da veia cava superior. Podem estar associados a síndroma de neoplasias endócrinas múltiplas tipo 1 (NEM-1) em aproximadamente 19-25% dos doentes17, tendo estes casos comportamento mais agressivo. Podem ser biologicamente activos (33%), segregando um conjunto de hormonas, entre as quais se destaca a ACTH (estando associado a síndroma de Cushing13,21), por vezes também a produção de HAD3 e PTH16 e já foram reportados casos de secreção de calcitonina e ß-HCG16.
Não estão no entanto relacionados com a síndroma carcinóide ou miastenia gravis, ao contrário de outros tumores tímicos. Aproximadamente 30% dos casos são assintomáticos na altura do diagnóstico, sendo encontrados acidentalmente através da realização de RX tórax14 ou TACt. A apresentação clínica do caso actual enquadra-se nas manifestações devidas a efeito de massa local, nomeadamente sob a forma de desconforto retro-esternal recente. Embora a associação com a síndroma de Cushing seja frequente21, o caso presente não demonstrou clínica sugestiva14-16.
O diagnóstico clínico de um tumor tímico é feito essencialmente por meios imagiológicos: no RX do tórax identifica-se uma massa lobulada e mais de 90% dos casos estão localizados ao mediastino anterior9, não permitindo estabelecer diagnóstico diferencial entre os diferentes tipos histológicos; a TACt permite localizar a neoplasia com maior precisão anatómica, a sua relação com as estruturas adjacentes e características que possam fazer suspeitar de malignidade. No caso, a radiografia do tórax e a TAC torácica identificaram uma massa mediastínica com plano de clivagem com as estruturas adjacentes. Para diagnóstico também podemos recorrer à medicina nuclear e a doseamentos hormonais, uma vez que os carcinóides tímicos estão frequentemente associados a NEM-1 e a síndromas paraneoplásicas, nomeadamente com manifestações do síndroma de Cushing, como já referido. O doente não apresentava alterações significativas no cintigrama com pentetreótido-In111, tendo no entanto aumento dos níveis séricos e urinários de cortisol17-19.
À observação macroscópica, o carcinóide tímico apresenta-se como uma massa acinzentada com ou sem focos de necrose10. Em microscopia apresenta mais vulgarmente um padrão organóide, possível microcalcificação, vascularização marcada e pode estar presente invasão linfática e vascular. Por imunoistoquímica, as células tumorais mostram positividade para citoqueratinas de baixo peso molecular (CAM 5,2), em 100% dos casos, queratinas de largo espectro (88%) e para marcadores neuroendócrinos como a cromogranina A (75% dos casos), sinaptofisina (72%), Leu 7/CD 57 (68%) e enolase neuronioespecífica (NSE) em raros casos6,8. No caso clínico reportado o tumor apresentava-se como uma massa capsulada acinzentada, com áreas sugestivas de necrose e histologicamente com um padrão sólido e trabecular, sem invasão da cápsula tímica. A marcação imunoistoquímica mostrou positividade para queratina MNF116 e cromogranina no citoplasma das células neoplásicas, características de tumor carcinóide com qualquer localização.
Foram identificas mitoses em HE em número superior a 2 por 10 HPF (campos de grande ampliação) e o índice mitótico era superior a 10% pela marcação da histona nuclear Ki 67 (Fig. 1). Desta forma, a neoplasia foi classificada como carcinoma neuroendócrino bem diferenciado – carcinóide atípico do timo. A caracterização histológica dos tumores neuroendócrinos do timo e recomendações para a sua classificação acompanham os conhecimentos para os tumores neuroendócrinos do pulmão e do aparelho digestivo20-23.
Os tumores tímicos podem ser estadiados por vários sistemas, nomeadamente pelo sistema TNM ou pelos critérios de Masaoka. O sistema de Masaoka5 (Quadro II) corresponde a uma classificação histoclínica com base no grau de invasão local e à distância12 e é mais utilizada do que o estadiamento TNM.
Quadro II – Classificação de Masaoka

Classifica os tumores em 4 estádios (I – IV): no estádio I o tumor está completamente capsulado e microscopicamente não apresenta invasão da cápsula; no estádio II já há invasão da cápsula, tecido adiposo mediastínico e/ou pleura mediastínica, mas não dos órgãos vizinhos (pericárdio e coração, grandes vasos ou pulmão); caso isso ocorra será classificado no estádio III; no estádio IV ocorre disseminação metastática por via linfática ou hematogénica.
Segundo estes critérios, o tumor em estudo foi classificado no estádio I. Segundo o sistema TNM, caracteriza-se como T1 (sem invasão da cápsula ou envolvimento de tecidos adjacentes), N0 (sem metástases dos nódulos linfáticos) e M0 (pois nos exames realizados não foram confirmadas metástases à distância)17,24,25.
Num estudo genético recente demonstrou-se alterações cromossómicas específicas que não foram observadas em tumores carcinóides com outras localizações (aparelho digestivo, esporádicos ou associados a NEM-1).
O facto de não terem sido detectadas alterações cromossómicas em 11q13 suporta a distinção entre este tumor e o grupo de tumores que se integram no NEM-1, onde estão expressas em 36% dos casos18,19. Consequentemente, deve ser considerada a existência de um mecanismo citogenético distinto no desenvolvimento do carcinóide tímico, comparativamente aos outros carcinóides.
No caso clínico descrito, o doente não apresentava outras neoplasias, daí que se tenha optado por não fazer o seu estudo citogenético14,26-28
O diagnóstico diferencial do carcinóide tímico é feito com outros tumores mediastínicos primários, nomeadamente o timoma, o paraganglioma, o linfoma, adenoma/carcinoma da paratiróide e carcinoma medular da tiróide. A diferenciação mais difícil e importante prende-se com o timoma, principalmente o carcinoma de células escamosas//epidermóide do timo em pequenas amostras de tecido biopsado, sendo ambos positivos para a queratina de adesão celular CAM 5,2. Os timomas não expressam marcadores neuroendócrinos como a cromogranina ou a sinaptofisina7. Os paragangliomas mediastínicos têm positividade celular para os marcadores neuroendócrinos e não apresentam a citoqueratina CAM 5,2; os tumores da paratiróide têm secreção celular PAS positiva; no carcinoma medular da tiróide, as células têm positividade citoplasmática para calcitonina e para o CEA (antigénio carcinoembrionário)11,29,30
A cirurgia continua a ser a principal medida terapêutica preconizada para o tratamento de todos os rumores do timo, onde se incluem os tumores neuroendócrinos. O objectivo é a ressecção completa de todo o tumor, incluindo zonas de invasão local e metástases regionais. O doente poderá também beneficiar de terapêutica regional ou sistémica adicional, rádio ou quimioterapia adjuvante, considerada nas situações em que a cirúrgica não está indicada, como nos casos de doença metastática generalizada ou quando a invasão de estruturas vitais torna a ressecção curativa inviável. Tendo em conta que estes tumores apresentam radiossensibilidade razoável, a radioterapia é utilizada sobretudo para controlo local da doença e melhoria sintomatológica, apresentando excelentes resultados, nomeadamente na síndroma de Cushing. É uma forma de tratamento muitas vezes preconizada, sendo normalmente utilizadas doses de 50-60Gy, e poderá ser aplicada em regime pós-operatório, eliminando assim a necessidade de operar num campo irradiado, optimizando ainda o efeito biológico por evitar a interrupção da irradiação. A aplicabilidade da quimioterapia nestes tumores é discutível, visto ainda não ter sido encontrado um regime satisfatório, aplicando-se os conhecimentos adquiridos para outras localizações Vários fármacos foram administrados, como a cisplatina (utilizada no carcinoma tímico) e também o 5-fluorouracilo, a estreptozocina e o α-interferão (agentes utilizados com sucesso nos tumores neuroendócrinos intestinais), sem benefícios significativos. No presente caso efectuou-se timectomia total através de esternotomia mediana associada a radioterapia pós-operatória (28 sessões com dose total de 50,40 Gy), tratamento que se enquadra nos padrões vigentes11,31-33.
Tratando-se de uma doença com grande progressão local possível, recidiva e metastização em elevada percentagem de casos, apresenta um mau prognóstico geral.
A ressecção cirúrgica incompleta, a presença de síndroma de Cushing16 ou NEM-120, recidiva após a químio e radioterapia e presença de metástases são factores associados a pior prognóstico. O estadiamento é a condicionante mais importante para de 28% e 10% aos 5 e 10 anos, respectivamente8.
São uma causa de morte importante, nomeadamente nos casos associados a NEM-1 e síndroma de Cushing, e existem autores que defendem a realização de timectomia profiláctica nestes doentes17. No presente caso existem indicadores que apontam para um bom prognóstico, como seja o facto de ter sido realizada uma cirurgia com ressecção total da neoplasia e não estar associada a síndroma de Cushing4,13,14,26,34.
Pode concluir-se que os tumores neuroendócrinos do timo têm uma baixa incidência, relativamente a outras neoplasias do timo, mas são tumores malignos de mau prognóstico e, por isso, devem ser diferenciados dos restantes tumores mediastínicos anteriores e estabelecer a sua origem primária. O tratamento de escolha é a ressecção cirúrgica total, com possível terapêutica adjuvante de radioterapia e/ou quimioterapia.
Bibliografia
1. Rosai J, Higa E. Mediastinal endocrine neoplasm of probable thymic origin, related to carcinoid tumour. clinicalopathologic study of 8 cases. Cancer 1972; 29:1061-1075.
2. Travis W, Brambilla E, Muller-Hermelink H, Harris C. tumors of the lung, pleura, thymus and heart. WHO, IARCPress. Lyon 2004.
3. Rosai J. Histological Typing of Tumours of the Thymus; New York, NY: Springer-Verlag, 2nd ed., 1999.
4. Detterbeck F, Parsons AM. Thymic tumours. Ann Thorac Surg 2004; 77:1860-1869.
5. Ullmann R, Petzmann S, Klemen H, et al. The position of pulmonary carcinoids within the spectrum of neuroendocrine tumours of the lung and other tissues. Genes Chromosomes Cancer 2002; 34:78-85.
6. Du E, Goldstraw P, Zacharias J, Tiffet O, Craig P, Nicholson A, Weinder N, Yi E. TTF -1 expression is specific for lung primary typical and atypical carcinoids: TTF -1 -positive carcinoids are predominantly in peripheral location. Human Pathology 2004; 35(7):825-831.
7. García-Yuste M, Matilla J, Cueto A, Paniagua J, Ramos G, Cañizares M, Muguruza I. Typical and atypical carcinoid tumours: analysis of the experience of the Spanish multi -centric study of neuroendocrine tumours of the lung. Eur J Cardio-Thorac Surg 2007; 31:192-197.
8. García-Yuste M, Matilla J, Alvarez-Gago T, Duque J, Heras F, Cerezal L, Ramos G. prognostic factors in neuroendocrine lung tumors: a Spanish multicenter study. Ann Thorac Surg 2000; 70:258-263.
9. Economopoulos G, Lewis J, Lee M, et al. Carcinoid tumours of the thymus. Ann Thorac Surg 1990; 50:58-63.
10. Moran C, Suster S. Spindle-cell neuroendocrine carcinomas of the thymus (spindle-cell thymic carcinoid): a clinicopathologic and immunohistochemical study of seven cases. Mod Phatol 1999; 12:587-591.
11. Moran C, Suster S. Thymic neuroendocrine carcinomas with combined features ranging from well differentiated (carcinoid) to small cell carcinoma. Am J Clin Pathol 2000; 113:345-350.
12. Engels E, Pfeiffer R. Malignant thymoma in the United States: demographic patterns in incidence and associations with subsequent malignancies. Int J Cancer 2003; 105 (4):546-551.
13. Moran C, Suster S. A clinicopathologic analysis of 80 cases of neuroendocrine carcinomas of the thymus. Am J Clin Pathol 2000; 114:100-110
14. Pan C, Jong Y, Chen Y. Comparative genomic hybridization analysis of thymic neuroendocrine tumors. Modern Pathology 2005; 18:358-364.
15. Okumura M, Ohta M, Tateyama H, et al. The World Health Organization histologic classification system reflects the oncologic behavior of thymoma: a clinical study of 273 patients. Cancer 2002; 94(3):624-632.
16. Pearson F, Griffith J, Cooper J, Deslauriers J, et al. Thoracic Surgery 2nd edition, Churchill Livingstone 2002; 1682-1710.
17. Masaoka A, Monden Y, Nakahara K, Tanioka D. Follow -up studies of thymomas with special reference to their clinical stages. Cancer 1981; 48:2485-2492.
18. Daniels C, Lowe V, Aubry M-C, Allen, M, Jett J. The utility of fluorodeoxyglucose positron emission tomography in the evaluation of carcinoid tumors pre-senting as pulmonary nodules. Chest 2007, 131: 255-260.
19. Rosenberg J. Neoplasms of the mediastinum. In: De Vita VT, Hellman S, Rosenberg SA (Eds.). Cancer: Principles and practice of oncology, 4th edition J.B. Lippincott Company 1993; 1333-1435.
20. Schmidt-wolf I, Rockstroh J, Schuller H, et al. Malignant thymoma: current status of classification and multimodality treatment. Ann Hematol 2003; 82(2):69-76.
21. Takayama T, Kammeya T, Inagaki K, et al. MEN type 1 associated with mediastinal carcinoid producing parathyroid hormone, calcitonin and chorionic gonadotropin. Pathol Res Pract 1993; 189:1090-1996.
22. Teh B, McArdle J, Chan S, et al. Clinicopathologic studies of thymic carcinoids in multiple endocrine neoplasia type 1. Medicine 1997; 76:21-27.
23. Walch A, Zitzelsberger H, Aubele M, et al. Typical and atypical carcinoid tumours of the lung are characterized by 11q delections as detected by comparative genomic hybridization. Am J Pathol 1998; 153:1089-1098.
24. Wick M, Scoot R, Li C, et al. A clinicopathologic report of seven cases with a review of the literature. Mayo Clin Proc 1980; 55:246-251.
25. Wick M, Carney J, Bernatz P, Brown L. Primary mediastinal carcinoid tumours. Am J Surg Pathol 1982; 6:195-205.
26. Strobel P, Marx A, Zettl A, Muller-Hermelink HK. Thymoma and thymic carcinoma: an update of the WHO Classification 2004. Surg Today 2005; 35:805-811.
27. Rossi G, Cavazza A, Marchioni A, Longo L, Migaldi M, sartori G, Bigiani N, Schirosi L, Casali C, Morandi U, Facciolongo N, Maiorana A, Bavieri M, Fabbri L, Brambilla E. Role of chemotherapy and the recptor tyrosine kinases KIT, PDGFRá, PDGFRâ, and meti n large -cell neuroendocrine carcinoma of the lung. J Clin Oncol 2005; 23(24):8774-8785.
28. Davies S, Gosney J, Hansell D, Wells A, Bois R, Burke M, Sheppard M, Nicholson A. Didffuse idiopathic pulmonary neuroendocrine cell hyperplasia: an under -recognised spectrum of disease. Thorax 2007; 62:248-252.
29. Bastos P, Magalhães A, Cruz MR, Saleiro S, Gonçalves L, Piñon Miguel. Cistos e tumores primários do Mediastino. Rev Port Pneumol 2007; 13(5):659-673. [ Links ]
30. Ping H, Varticovski L, Bowman E, Fukuoka J, Welsh J, Miura K, Jen J, Gabrielson E, Brambilla E, Travis W, Harris C. Identification of carboxypeptidase e and ã-glutamil hydrolase as biomarkers for pulmonary neuroendocrine tumors by cDNA microarray. Human Pathology 2004; 35(10):1196-1209.
31. Kobayashi Y, Tokuchi Y, Hashimoto T, Hayashi M, Nishimura H, Yuichi I, Nakagawa K, Sato Y, Takahashi A, Tsuchiya E. Molecular markers for reinforcement of histological subclassification of neuroendocrine lung tumors. Cancer Sci 2004; 95:334 -341.
32. Barata F, Costa A. Carcinoma do pulmão de pequenas células. Estado da arte e perspectivas futuras. Ver Port Pneumol 2007; 13(4):587-603.
33. Sousa B, Araújo A, Amaro T, Azevedo I, Soares M, Sousa O. Timomas malignos. a experiência do IPO do Porto e revisão de literatura. Rev Port Pneumol 2007; 13(4):553-585.
34. Onuki N, Wistuba I, Travis W, Virmani A, Yashima K, Brambilla E, Hashleton P, Gazdar A. Genetic changes in the spectrum of neuroendocrine lung tumors. Cancer 1999; 85(3):600-607.
e-mail: lcarvalho@huc.min-saude.pt
Recebido para publicação/received for publication: 09.04.28
Aceite para publicação/accepted for publication: 09.07.08