Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.20 no.3 Lisboa maio 2013
https://doi.org/10.1016/j.jpg.2012.04.035
CASO CLÍNICO
Linfoma intestinal de células T e doença celíaca
Intestinal t-cell lymphoma and celiac disease
Flávia Semedoa,∗, Cláudio Quintaneiroa, Rosário Santos Silva a, Luísa Loureiroa, Raquel Diasb, Fátima Guedesa e Amélia Pereiraa
a Serviço de Medicina Interna, Hospital Distrital da Figueira da Foz EPE, Figueira da Foz, Portugal
b Serviço de Cirurgia, Hospital Distrital da Figueira da Foz EPE, Figueira da Foz, Portugal
*Autor para correspondência
RESUMO
O linfoma de células T associado a enteropatia (LTAE) é uma neoplasia rara, com origem nos linfócitos T intestinais intraepiteliais e que está frequentemente associado a doença celíaca (DC).
Os autores relatam o caso de um doente com quadro de desconforto abdominal, perda de peso acentuada, intolerância ao glúten, com anticorpos antigliadina positivos e múltiplas adenomegálias mesentéricas, ao qual foi diagnosticado DC e LTAE após ressecção cirúrgica de segmento do jejuno com cerca de 15 centímetros, envolvido por implantes tumorais.
Com a descrição deste caso, salienta-se a dificuldade no diagnóstico clínico e anatomopatológico desta entidade, alicerçando o tema numa revisão da literatura.
Palavras-Chave: Linfoma intestinal de células T; Doença celíaca; Enteropatia
ABSTRACT
Enteropathy associated T-cell lymphoma (EATL) is a rare tumor. It develops in intestinal intra-epithelial T-cells and is commonly associated with celiac disease (CD).
The authors report a patient presenting with abdominal discomfort, weight loss, intolerance to gluten, positive gliadin antibodies and mesenteric lymph node enlargement. CD with EALT was diagnosed after surgical resection of 15 centimeters of jejuno with tumor implants.
This case brings out to discussion the difficulty of clinical and histological diagnosis of this entity based on a literature review.
Keywords: Intestinal T-cell lymphoma; Celiac disease; Enteropathy
Introdução
A doença celíaca (DC) acarreta, entre outras complicações, um risco aumentado de neoplasias entre as quais o Linfoma não Hodgkin. Destes, menos de 1% resultam da proliferação anormal de linfócitos T intestinais intraepiteliais1, designando-se linfoma de células T associado a enteropatia (LTAE).
A despeito da associação entre estas 2 entidades, a epidemiologia é diferente. O LTAE atinge maioritariamente os indivíduos do sexo masculino, com idade superior a 40 anos, sendo a relação sexo masculino/feminino de 2/1. Localizase habitualmente na região proximal do jejuno2.
É mais frequente nos doentes com o diagnóstico recente de DC, com poucos meses ou semanas de evolução3. Noutros surge como complicação tardia da DC3. Em muitos casos, não obstante a ausência de sintomas sugestivos de DC, a mucosa adjacente à neoplasia apresenta alterações compatíveis com esta enteropatia, nomeadamente aumento dos linfócitos intraepiteliais, hiperplasia das criptas e atrofia das vilosidades2.
A jejunite ulcerativa e a DC refratária tipo II (caracterizada por atrofia vilositária e presença de linfócitos intraepitelias aberrantes, após a suspensão alimentar de glúten por um período superior a um ano) são consideradas lesões pré-neoplásicas, ou mesmo fases iniciais do linfoma3,4.
O prognóstico é reservado, atendendo à resistência aos citostáticos, à carência nutricional associada e ao elevado risco de abdómen agudo5.
Caso clínico
O caso refere-se a uma doente de 54 anos, raça caucasiana, referenciada à Consulta de Medicina Interna, em março de 2011, por linfocitose e trombocitose.
Na história da doença atual aferiu-se quadro com início em maio de 2010, de vómitos alimentares e dejeções líquidas não sanguinolentas, que a doente relacionou com a ingestão de certos alimentos, nomeadamente derivados do trigo e aveia (negava consumo de centeio). Após a eliminação (sem orientação médica) destes alimentos, constatou melhoria clínica. Em outubro do mesmo ano recorreu à Consulta Médica privada por reaparecimento dos sintomas gastrintestinais (apesar da dieta), astenia e anorexia. Efetuou ecografia abdominal, estudo endoscópico digestivo alto e baixo, que não revelaram alterações, tendo sido estabelecido o diagnóstico de síndrome de intestino irritável, para o qual foi medicada com espasmolítico e antidiarreico. Apesar da melhoria das queixas gastrintestinais, manteve astenia e anorexia. 2 meses depois, verificou-se recidiva do quadro abdominal, com aumento do número de dejeções (4 a 6 vezes por dia) e perda de peso acentuada (cerca de 30 kg em 3 meses, equivalente a 38,9% de peso perdido).
Negava outros sintomas orgânicos, nomeadamente febre ou sudorese noturna. Sem história de viagens recentes nem contexto familiar patológico relevante.
Dos antecedentes pessoais registam-se síndrome do intestino irritável, histerectomia total por miomatose uterina, neuropatia periférica hereditária com suscetibilidade a paralisias de pressão, discopatia lombar degenerativa, síndrome depressiva e rinossinusite. Estava medicada com brometo de otilónio 40 mg (3/dia), loperamida 2 mg (1/dia), domperidona 10 mg (3/dia), duloxetina 60 mg (1/dia) e gabapentina 300 mg (1/dia).
Ao exame objetivo apresentava-se emagrecida (índice de massa corporal - 17 kg/m2), com palidez cutâneo-mucosa, abdómen difusamente doloroso à palpação, sem massas palpáveis, e com edema periférico. Sem adenomegálias palpáveis ou outras alterações.
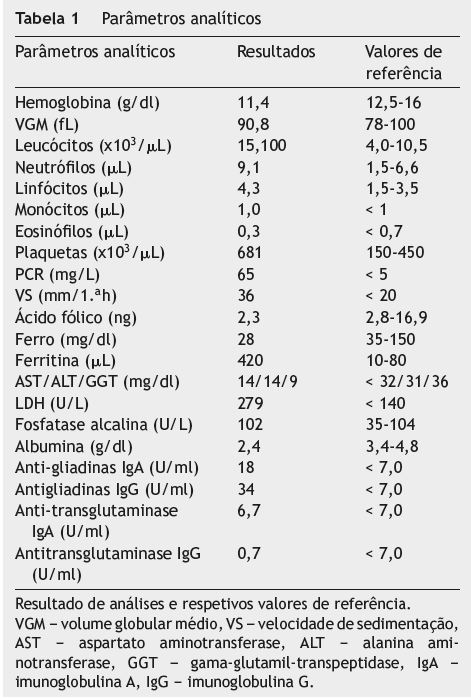
Nos exames solicitados destacavam-se leucocitose (com neutrófila, linfocitose e monocitose) anemia normocrómica/ normocítica, trombocitose, ferropenia, hipoalbuminémia, diminuição do ácido fólico sérico, proteína C reativa (PCR) elevada e anticorpos antigliadina positivos (tabela 1). A ecografia abdominal foi normal. Na tomografia computorizada (TC) toraco-abdomino-pélvico foram observadas adenomegálias mesentéricas (fig. 1) e hiposplenismo. A prova de tuberculina foi negativa. O exame parasitológico das fezes foi negativo, assim como as serologias para citomegalovírus, Epstein Barr e Ascaris lumbricoides. Os vírus de imunodeficiência humana (VIH) 1 e 2 foram igualmente negativos. O medulograma e a fenotipagem da medula não apresentaram alterações. Fez endoscopia digestiva alta, que revelou gastropatia ligeira e ausência de lesões esofágicas e duodenais (porções D1 e D2). Efetuou colonoscopia, em que foi visualizado pólipo cólico (hiperplásico). Foi submetida a laparotomia exploradora, tendo sido observados implantes tumorais jejuno-ileais, adenomegálias no meso jejunal, ileal e ao longo da mesentérica superior. Procedeu-se a ressecção do segmento do jejuno envolvido (15 centímetros) e de adenomegália mesentérica, seguida de anastomose jejuno-jejunal topo a topo.
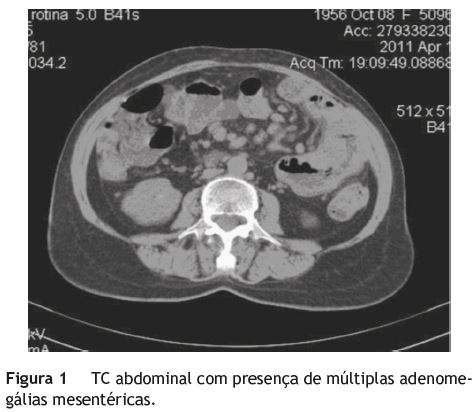
O exame anátomo-patológico inicial foi inconclusivo, tendo sido descritas, no jejuno e no gânglio, lesões constituídas por numerosos histiócitos, polimorfonucleares eosinofílicos e células com dimensões médias a grandes, cujo fenótipo não foi possível determinar, e áreas de necrose/ulceração da mucosa suprajacente. Foram colocadas as hipóteses de neoplasia linfoproliferativa, enterite eosinofílica e sarcoma mieloide.
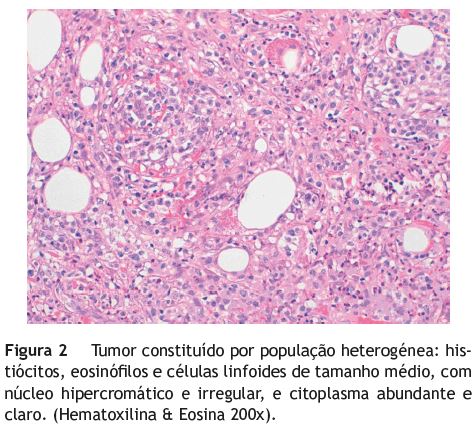
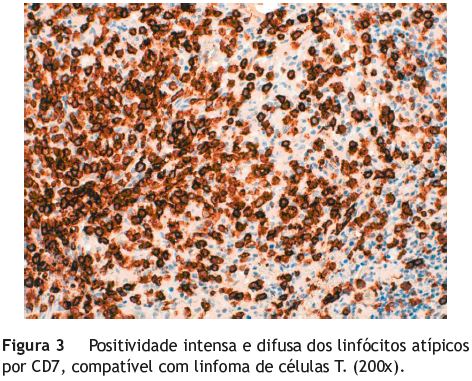
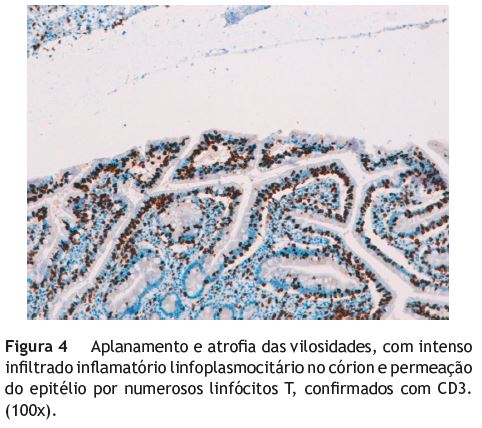
A revisão histológica da peça permitiu o diagnóstico de linfoma de células T associado a enteropatia. O exame imuno-histoquímico revelou positividade para CD3 e CD7, marcação focal para CD8, CD30 e TiA-1, e negatividade para CD117 e MPX (figs. 2 e 3). A mucosa adjacente à neoplasia apresentava aplanamento e atrofia das vilosidades, intenso infiltrado inflamatório linfoplasmocitário no córion e permeação do epitélio por numerosos linfócitos, sendo o perfil imunológico igual ao do tumor. Relativamente a área da mucosa envolvente, ressalta-se a positividade para CD3, que confirma a presença de linfócitos T (fig. 4) e a marcação focal para CD8 que traduz o fenótipo aberrante de algumas destas células (as CD8 negativas), aspeto que é característico da DC refratária tipo II.
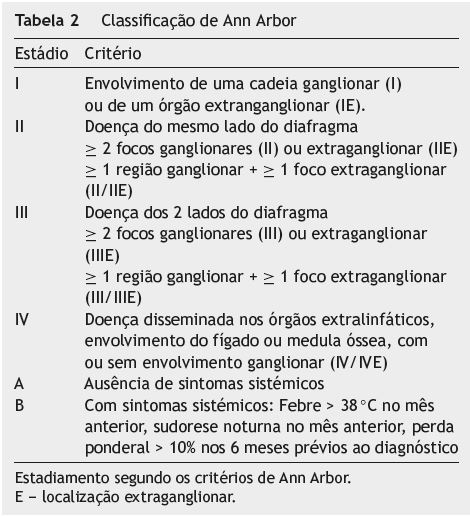
Assim, foram estabelecidos os diagnósticos de DC e LTAE estádio IIE-B, segundo os critérios de Ann Arbor (tabela 2).
Foi proposta quimioterapia com o esquema CHOP (ciclofosfamida, vincristina, doxorrubicina e prednisolona) de 21/21 dias. Atendendo a presença de DC, apesar da dieta previamente adotada pela doente, foi reforçado o ensino dietético, com estabelecimento de dieta totalmente restritiva.
Antes de iniciar a quimioterapia, a doente foi internada por agravamento do estado funcional (Eastern Cooperative Oncology Group - ECOG 3), ascite (a pesquisa de células neoplásicas foi negativa) e edema periférico acentuado, tendo sido submetida a terapêutica nutricional parentérica. Após compensação clínica, iniciou quimioterapia, tendo já completado o 3.◦ ciclo, sem intercorrências.
Quanto à resposta ao tratamento (quimioterápico e nutricional), nas primeiras semanas após a sua instituição, verificou-se resolução do quadro de vómitos e de alteração do trânsito intestinal (1 dejeção diária de consistência normal). Progressivamente, houve melhoria do estado funcional (ECOG 1) e aumento ponderal (em 3 meses aumentou 3 kg).
Discussão
A origem do LTAE é desconhecida. Admite-se que a estimulação crónica dos linfócitos T intestinais intraepiteliais pelos alimentos com glúten desempenha um papel importante na sua patogénese2,4. Fatores genéticos e citocinas inflamatórias também têm sido implicados1-4.
Na maioria dos casos, afeta o segmento proximal do jejuno. Raramente, pode localizar-se no duodeno, estômago, cólon ou noutras áreas fora do trato gastrointestinal1.
Macroscopicamente, caracteriza-se por ser multifocal, formando úlceras, nódulos, placas e estenoses. Menos vezes, apresenta grandes massas que podem infiltrar o mesentério e gânglios mesentéricos. Na maioria dos casos, restringese às estruturas extramedulares; no entanto, pode ocorrer invasão da medula óssea.
Mesmo nos doentes com doença celíaca estabelecida, o diagnóstico clínico é muitas vezes difícil, atendendo à inespecificidade dos sintomas. Os doentes podem referir, assim como no caso descrito, (re)aparecimento de queixas semelhantes às da doença celíaca (doença celíaca like), edema periférico, ascite e sintomas constitucionais. Noutros casos, pode apresentar-se como quadro abdominal agudo (peritonite, perfuração intestinal e oclusão intestinal). Impõe-se, portanto, o diagnóstico diferencial com outras neoplasias, patologia infecciosa (exemplos: infeção VIH, tuberculose intestinal, parasitoses, doença de Whipple), enteropatia funcional ou inflamatória (exemplos: doença de Crohn, enterite eosinofílica), doenças autoimunes e endócrinas.
No caso descrito, perante às queixas sugestivas de intolerância ao glúten, apesar da forte suspeita de estarmos perante um processo neoplásico, reforçadas pela presença de hiposplenismo, foram solicitados os anticorpos antigliadina, que foram positivos, e antitransglutaminase, que foram negativos (os anticorpos antiendomísio não se encontram disponíveis no nosso Hospital). Pensamos que este resultado «curioso» (tendo em conta a maior sensibilidade e especificidade dos anticorpos antitransglutaminase face aos antigliadina), seja devido à dieta restritiva instituída pela doente, que se traduziu na negativação dos anticorpos antitranglutaminase e, eventualmente, na diminuição dos anticorpos antigliadina.
Apesar de ter sido realizado estudo endoscópico digestivo alto, não foi efetuada biópsia duodenal (justificada pela ausência de lesões duodenais macroscópicas). Pensamos que tal seria fundamental, pois permitiria não só o estabelecimento do diagnóstico de DC, mas também a deteção, ou não, de linfócitos T aberrantes (CD8 negativos) compatíveis com DC refratária tipo II e até mesmo de células neoplásicas.
A laparotomia exploradora permitiu não somente a visualização e excisão da lesão tumoral como também a determinação da sua extensão intra-abdominal.
O estudo anátomo-patológico da peça estabeleceu o diagnóstico final de LTAE, assente numa mucosa com alterações morfológicas e imunofenotípicas compatíveis com DC. Ainda acerca do resultado anátomo-patológico da mucosa adjacente, pensamos que a marcação focal para CD8 traduz as alterações dinâmicas subjacentes a este processo patológico, ou seja, a transformação de alguns linfócitos T intraepiteliais em linfócitos T aberrantes (CD8 negativas) e sua posterior degeneração no LTAE.
Morfologicamente, o LTAE caracteriza-se por um infiltrado celular relativamente monomórfico, de grandes células, com núcleos redondos com nucléolo proeminente e citoplasma pálido, moderado a abundante, e frequentemente associado a exuberante infiltrado inflamatório, o que muitas vezes compromete a visualização de células neoplásicas. Pode infiltrar o epitélio de superfície ou as criptas, condicionando distorção da arquitetura intestinal, destruição dos enterócitos e ulcerações.
Quanto à imunofenotipagem as células tumorais, são, na maioria dos casos, positivas para CD3, CD7, CD103 e proteínas citotóxicas, negativas para CD4, CD5 e CD8 (ressalva-se que em alguns casos ocorre marcação focal para CD8 e que noutros, se bem que raramente, este marcador é positivo), e com marcação focal para TCRB1. O tecido adjacente ao tumor apresenta geralmente as características de DC/DC refratária tipo II. As células tumorais podem apresentar ainda alterações genéticas específicas, nomeadamente +9q31.3 ou -16q12.11.
Este perfil (morfológico, imunológico e genético) permite a sua distinção, entre outras neoplasias, do linfoma T intestinal monomórfico, também designado por linfoma de células T associado a enteropatia tipo II (LTAE tipo II), entidade que habitualmente ocorre de forma esporádica e que raramente está associada a DC1.
O tratamento consiste na remoção cirúrgica do tumor, seguida de quimioterapia (a presença de células neoplásicas em segmentos do intestino sem alterações macroscópicas corrobora a necessidade de quimioterapia adjuvante). Numa casuística de 31 doentes com LTAE descrita por Gale et al., 6 foram submetidos inicialmente apenas a tratamento cirúrgico5. Destes, apenas um se apresentava sem doença após 49 meses de follow-up. Os restantes faleceram por progressão da doença.
Quanto a quimioterapia, não existe nenhum esquema standard. Os vários esquemas terapêuticos utilizados, entre os quais o CHOP, foram pouco eficazes, com baixa percentagem de resposta completa ou parcial6.
Na maioria dos casos, há progressão da doença, recidiva e metastização (hepática, esplénica, cutânea ou de outros órgãos)2. Este caráter agressivo também foi demonstrado no trabalho de Gale et al., em que 84% dos doentes faleceu, sendo a duração média de sobrevivência de 7,5 meses5. Estima-se que a sobrevivência média aos 5 anos seja de 13 a 25%7.
Novas abordagens terapêuticas têm surgido, nomeadamente o transplante autólogo e alogénico de medula óssea. Embora o número de casos relatados seja escasso (devido, em grande parte, à infrequência desta patologia) há expectativa de que estas venham a alterar o prognóstico desta doença. Sieniawski et al.publicaram em 2010 uma casuística em que compararam a resposta terapêutica entre 2 grupos, um constituído por doentes com LTAE e submetidos a quimioterapia convencional (54 doentes), e outro constituído por doentes com o diagnóstico de LTAE submetidos a transplante autólogo da medula óssea após ciclo de quimioterapia agressiva e remissão completa do tumor (26 doentes)3. Concluíram que, nos doentes transplantados, a sobrevivência média foi maior, assim como a duração da remissão da doença, a mortalidade foi mais baixa e houve menor incidência de efeitos secundários3. Na nossa opinião, a interpretação dos resultados está condicionada, entre outros fatores, pela discrepância nos 2 grupos quanto à presença de DC (superior nos doentes não transplantados) e pela não discriminação dos doentes que entraram em remissão ou que faleceram quanto à presença de DC/DC refratária tipo II.
O transplante alogénico de medula óssea é outra opção terapêutica. Nos casos consultados, todos os doentes transplantados se encontravam em remissão clínica após ciclo de quimioterapia convencional, e todos os dadores tinham sido submetidos a testes de histocompatibilidade e de rastreio de DC8,9. Dos 3 casos revistos, todos tinham DC, apresentavam metástases à distância, e vieram a falecer após o transplante por progressão da doença.
Tendo em conta estes dados, não obstante os seus condicionamentos, parece-nos que a presença de DC e o estádio avançado da doença influenciaram negativamente os resultados. Trabalhos futuros visando a avaliação da resposta nos doentes com DC e LTAE no estádio inicial, assim como casuísticas com um maior número de doentes (caracterizados do ponto de vista morfológico, fenotípico e genético) serão fundamentais para consubstanciar estas abordagens e estabelecer os critérios para transplante nesta patologia.
São considerados fatores de mau prognóstico: a presença de DC, o estádio do tumor, a idade de apresentação (pior nas idades extremas), a forma de apresentação clínica (mais grave em caso de perfuração intestinal), a presença de massa tumoral de grandes dimensões (maior que 7 centímetros), invasão parietal, imunodepressão associada e baixo performance status.
Para este desfecho sombrio concorrem não só a gravidade da doença per se, mas também a carência nutricional associada, o risco elevado de complicações abdominais agudas (mesmo nos doentes sob quimioterapia, as lesões de mucosite secundárias potenciam esse risco), o risco aumentando de sépsis inerente à própria doença (hipoesplenismo), a quimiorresistência e os efeitos adversos dos citostáticos.
Conclusão
Como conclusão, relembramos que o diagnóstico célere desta entidade implica a sua suspeição, principalmente se a doença celíaca é recente, ou perante doença de longa duração «agudizada» apesar de dieta restritiva. Ressalvamos ainda que esta pode ser a primeira manifestação da doença celíaca.
Por fim, investigações futuras com vista ao estabelecimento de esquemas terapêuticos mais eficazes e com potencial curativo, assim como a implementação de estratégias de tratamento e seguimento perante as condições pré-neoplásicas, serão fundamentais para que se possa alterar a história natural desta doença.
Bibliografia
1. Isaacson PG, Chott A, Ott G, Stein H. Enteropathy-associated Tcell lymphoma. In: Swerdlow SH, Campos E, Harris NL, Jaffe ES, Pileri SA, Stein H, et al., editores World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press; 2008. p. 289-91. [ Links ]
2. Zettl A, De Leeuw R, Haralambieva E, Mueller-Hermelink HK. Enteropathy type t-cell lymphoma. Am J Clin Pathol. 2007;127:701-6. [ Links ]
3. Sieniawski M, Angamuthu N, Boyd K, Chasty R, Davies J, Forsyth P, et al. Evaluation of enteropathy-associated t-cell lymphoma comparing standart therapies with a novel regimen including autologous stem cell transplantation. Blood. 2010;115:3664-70. [ Links ]
4. Nobre S, Silva T, Cabral J. Doença celíaca revisitada. GE-J Port Gastro. 2007;14:184--4. [ Links ]
5. Gale J, Simmonds P, Mead G, Sweetenham JW, Wright DH. Enteropathy-type intestinal t-cell lymphoma: clinical features and treatment of 31 patients in a single center. J Clin Oncol. 2000;18:795-803. [ Links ]
6. Delabie J, Holte H, Vose J, Ullrich F, Jaffe ES, Savage KJ, et al. Enteropathy-associated t-cell lymphoma: clinical and histological findings from the international peripheral t-cell lymphoma project. Blood. 2011;118:148-55. [ Links ]
7. Villaverde RM, Gordo AJ, González JLL, Sánchez AR, Rodríguez MA, Barón MG. Linfoma t primário intestinal: a propósito de dos casos com revisión de la literatura. An Med Interna. 2002;19:457-9. [ Links ]
8. Regelink JC, Tack GJ, Huijgens PC, Mulder CJJ, Janssen JJWM, Visser O. Disappointing outcome of allogenic hematopoietic SCT in two EATL patients. Bone Marrow Transplant. 2010;45:959-60. [ Links ]
9. Okuda M, Nomura J, Tateno H, Kameoka J, Sasaki T. CD56 positive intestinal t-cell lymphoma: treatment with high dose chemotherapy and autologous peripheral blood stem cell transplantation. Intern Med. 2002;41:734-7. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: fhsemedo@hotmail.com (F. Semedo).
Recebido a 7 de novembro de 2011; aceite a 9 de janeiro de 2012













