Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.2 Lisboa fev. 2012
Tumores neuroendócrinos gástricos e duodenal simultâneos
Simultaneous gastric and duodenal neuroendocrine tumors
Joana Saiote*, Gonçalo Ramos, Liliana Santos, António Mateus Dias, Teresa Bentes e João Barreiras
Serviço de Gastrenterologia, Centro Hospitalar Lisboa Central, Lisboa, Portugal
*Autor para correspondência
Resumo
Os tumores neuroendócrinos gastrointestinais são neoplasias raras. A probabilidade de ocorrência simultânea de tumores neuroendócrinos gástricos e duodenal é baixa. Os autores descrevem o caso de um doente do sexo masculino, 73 anos, com diagnóstico de anemia perniciosa desde há 13 anos, submetido a endoscopia digestiva alta por vigilância. O exame revelou mucosa do corpo gástrico com aspecto atrófi co com pequenas pápulas e um pólipo séssil no bulbo duodenal. O exame histopatológico mostrou tratar-se de microtumores neuroendócrinos gástricos no contexto de gastrite atrófi ca e um tumor neuroendócrino no bulbo duodenal.
Os autores discutem a ocorrência simultânea de tumores neuroendócrinos gástricos e duodenal, no contexto de doente com anemia perniciosa, abordando o mecanismo etiopatogénico, estratégia de tratamento e prognóstico destas patologias.
PALAVRAS-CHAVE Tumores neuroendócrinos; Anemia perniciosa; Gastrite atrófica; Gastrina
Abstract
Gastrointestinal neuroendocrine tumors are relatively rare neoplasms and usually occur singly. The probability of simultaneous occurrence of gastric and duodenal carcinoid tumors is low. The authors report a case of a 73-year old male patient, diagnosed pernicious anemia 13 years ago, who underwent upper endoscopy for surveillance. The examination revealed atrophic gastritis and a polypoid lesion in the duodenal bulb, which was completely excised. Pathological examination revealed gastric microcarcinoids in the context of atrophic gastritis and a neuroendocrine tumor in the duodenal bulb.
The authors discuss the simultaneous occurrence of gastric carcinoid tumors and duodenal, in the context of pernicious anemia, addressing the etiopathogenic mechanism, treatment strategy and prognosis of these diseases.
KEYWORDS Neuroendocrine tumors; Atrophic gastritis; Pernicious anemia; Gastrin
Introdução
Os tumores neuroendócrinos (TNE) gastrointestinais são neoplasias raras, com uma incidência estimada de 1 a 2 casos por 100,000 habitantes1,2.
São tradicionalmente classificados de acordo com local de origem dentro das subdivisões embriológicas do intestino: anterior, médio e posterior3.
Os TNE do intestino anterior incluem os tumores gástricos e duodenais. Estas neoplasias apresentam diferenças significativas no comportamento clínico dependendo do órgão de origem, exigindo uma estratégia de tratamento individualizada.
Os TNE gástricos correspondem a cerca de 0,3% dos tumores gástricos (4). Até há uma década eram considerados uma raridade patológica, constituindo 4% dos tumores neuroendócrinos. Nas séries actuais constituem 11 a 41% dos TNE gastrointestinais4. Incluem um espectro de neoplasias com diferentes características clinico-patologicas, mecanismo patogénico e prognóstico, dividindo-se em 2 grupos: tumores dependentes da gastrina (tipos I e II) e independentes da gastrina (esporádicos, ou tipo III).
Os TNE gástricos tipo I representam a maioria dos casos (> 75%). Estão associados a gastrite crónica atrófica (GCA) e em cerca de 50 a 65 % associam-se a anemia perniciosa5.
O mecanismo etiopatogénico proposto, no contexto de anemia perniciosa, consiste na destruição auto-imune da mucosa oxíntica. A hipocloridria resultante estimula a produção de gastrina pelas células G do antro gástrico. A hipergastrinémia constitui um estímulo trófico para as células enterocromafins6. Os TNE têm origem na transformação destas células, através da sequência hiperplasia, displasia, dependendo da interacção de factores endógenos e exógenos (colonização bacteriana, dieta). Estudos moleculares sugerem que os mecanismos subjacentes poderão envolver a sobre expressão do gene bcl-27,8 e mutações no RegIa9.
Os TNE gástricos tipo II associam-se a Neoplasia Endócrina Múltipla tipo 1 (MEN1)/Síndrome Zollinger-Ellison (MEN-ZES), correspondendo a 5 a 10% dos casos4,5.
Os TNE gástricos dependentes da gastrina são tumores bem diferenciados, com comportamento benigno e baixo índice de proliferação tumoral (Ki 67 < 2%), geralmente indolentes e com bom prognostico, distinguindo-se do tipo III, que ocorre sem doença predisponente associada (tumores esporádicos) e corresponde a cerca de 15 a 25% dos TNE gástricos10. Estes tumores têm um comportamento agressivo, com índice de proliferação tumoral elevado (Ki67 > 2%), metastização à distância ao diagnóstico e síndrome carcinóide atípico em 30% dos casos5.
Os TNE duodenais constituem 2 a 8,9% dos TNE e 3 a 5,5% dos tumores duodenais11. Podem ser identificados 5 tipos de acordo com o tipo de células de origem (gastrinoma, somatostatinoma, paraganglioma gangliocítico, tumor de células enterocromafins e carcinomas endócrinos pouco diferenciados). O gastrinoma é o tipo mais frequente, correspondendo a 70% dos tumores, estando associado a Neoplasia Endócrina Múltipla tipo I (MEN 1) num terço dos casos.
Na altura do diagnóstico, 40 a 60% destes tumores apresentam metástases ganglionares e cerca de 10% metástases hepáticas. A sobrevida aos 5 anos na ausência de metástases é 65% e caso estejam presentes 25%12.
Caso clínico
Doente do sexo masculino, 73 anos, etnia indiana, com diagnóstico de anemia perniciosa desde há 13 anos, foi submetido a endoscopia digestiva alta. O exame identificou mucosa gástrica do corpo e fornix com aspecto atrófico e pequenas pápulas dispersas no corpo, que foram biopsadas. No bulbo duodenal observou-se um pólipo séssil com 5 mm (fig. 1), que foi excisado.

Figura 1 Bulbo duodenal com pólipo sessil de 5 mm.
O exame histopatológico das biopsias gástricas mostrou fragmentos de mucosa do fornix e corpo com gastrite crónica atrófica e diversos microtumores neuroendócrinos bem diferenciados (fig. 2). O pólipo duodenal consistia num tumor neuroendócrino bem diferenciado (fig. 3). O índice de proliferação tumoral de ambas as lesões era inferior a 2%.
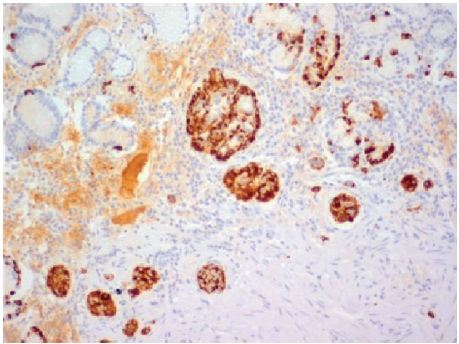
Figura 2 Biopsias corpo gástrico, marcação imuno-histoquímica com cromogranina A: diversos microtumores neuroendócrinos bem diferenciados. Nas lâminas do doente era possível observar os diversos estádios da sequência evolutiva, apresentando hiperplasia de células tipo enterocromafins em padrão linear, hiperplasia nodular, displasia e microcarcinoides.
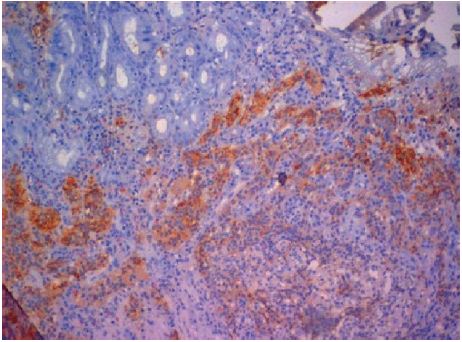
Figura 3 O pólipo duodenal. Marcação imuno-histoquímica com cromogranina A: tumor neuroendócrino bem diferenciado.
O estudo complementar realizado incluiu doseamento da gastrina [2016 pg/mL (VR: 13-115)], serotonina sérica e Ac 5-hidroxindolacético dentro dos limites do normal. O valor de cromogranina A encontrava-se aumentado [295 ng/mL (VR 19-98)]. Não apresentava alterações ao nível da função tiroideia, PTH, cálcio, glicemia, calcitonina, a-fetoproteina, antigénio carcinoembrionario (CEA).
O doente realizou tomografia axial computorizada abdominal que mostrava fígado normodimensionado, sem lesões focais intraparênquimatosas, sem envolvimento adenopático das cadeias ganglionares abdominais e pâncreas sem alterações (figs. 4A e 4B). A ECO-endoscopia, identificou discreto espessamento focal da mucosa ao nível do corpo gástrico e ausência de alterações da estrutura ecográfica da parede duodenal ou pâncreas. A vídeocápsula endoscópica não mostrou alterações. A cintigrafia com receptores somatostatina não apresentava zonas de hiperfixação com significado patológico (fig. 5). Realizou ecografia da tiróide e paratiroideias sem alterações.
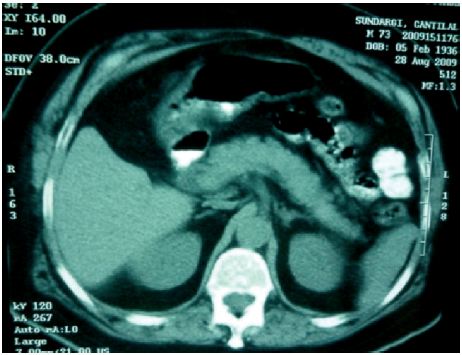
Figura 4 Tomografia Computorizada Abdominal: fígado normodimensionado, sem lesões focais intraparênquimatosas, sem envolvimento adenopático das cadeias ganglionares abdominais superiores e lombo-aorticas e pâncreas sem alterações.
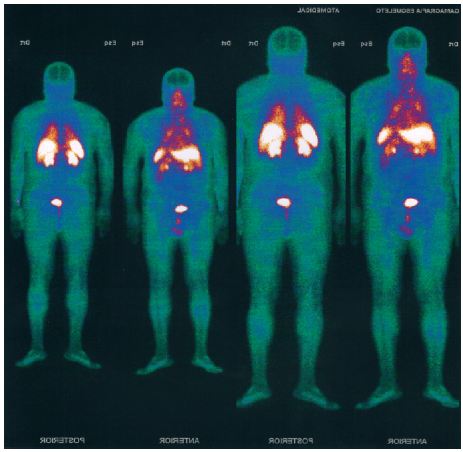
Figura 5 Cintigrafia com receptores somatostatina. Sem zonas de hiperfixação com significado patológico.
Discussão
Os tumores neuroendócrinos gástricos e duodenais são entidades raras, sendo a probabilidade de ocorrência simultânea de tumores primários baixa. A relevância da gastrite crónica tipo A e/ou hipergastrinémia no desenvolvimento de TNE duodenais não está estabelecida, pelo que um background genético de múltiplos TNE foi posta em consideração.
Os tumores neuroendócrinos podem ocorrer como parte de síndromes familiares de neoplasias endócrinas, como a neoplasia endócrina múltipla tipo 1 (MEN1), tipo 2 (MEN2), neurofibromatose tipo 1 (NF1), Von Hippel Lindau, e complexo de Carney, embora a maioria ocorra sob a forma esporádica.
Embora o exame genético não tenha sido realizado neste caso, a hipótese de se tratar de uma anomalia genética do tipo de MEN apresentava-se como pouco provável, dada a ausência de história familiar, a idade avançada do doente, a ausência de lesões paratiroideias (que ocorrem em 90 a 100% dos doentes) ou neoplasias pancreáticas endócrinas.
Considerando a hipergastrinémia (> 2.000 pg/mL) no presente caso, a relevância de um tumor neuroendócrino duodenal, produtor de gastrina podia ser posta em consideração. No contexto de gastrite atrófica, não desenvolveria a clínica típica da síndrome de Zollinger Ellison, mas a hipergastrinémia exerceria estímulo trófico adicional para as células enterocromafins gástricas.
A hipótese mais provável para a ocorrência simultânea das lesões no presente caso, deriva do facto da gastrina ser um estímulo trófico reconhecido13. O aumento da gastrina pela hiperplasia das células G do antro, exerceria um estímulo trófico nas células enterocromafins duodenais. A posterior interacção entre factores endógenos e exógenos favoreceria o desenvolvimento de displasia e tumor neuroendócrino duodenal.
No que diz respeito a indicadores de prognóstico, o doseamento da cromogranina A (CgA) é o mais amplamente utilizado. Nos tumores do intestino médio os níveis de CgA correlaciona-se com o tamanho do tumor e têm valor prognóstico independente para a sobrevida, sendo que valores elevados são detectados em tumores metastáticos14. No entanto, a interpretação do valor de CgA deve ter em consideração a sua sensibilidade e especificidade que variam entre 10 a 100% e 68 a 100%, respectivamente15. A insuficiência renal e a hipergastrinemia são as principais causas de falsos positivos15. No caso deste doente, a hipergastrinémia superior a 2.000 pg/mL, poderá ter originado um falso aumento de CgA.
A abordagem terapêutica dos TNE gástricos depende do tipo e tamanho das lesões. Para os tumores tipo 1 com características sugestivas de comportamento biológico benigno, preconiza-se uma abordagem conservadora se o tamanho e número de lesões o permitir. No caso de lesões de tamanho inferior a 1 cm, é proposta a vigilância endoscópica anual8.
No presente caso, perante microcarcinóides múltiplos, a vigilância endoscópica anual parece ser a opção apropriada8, devido à idade do doente, à ausência de características atípicas, ao baixo índice de proliferação tumoral (Ki 67 < 2%) e ausência de invasão da submucosa.
No que diz respeito ao TNE duodenal, a OMS preconiza que a ressecção endoscópica é suficiente para lesões inferiores a 1 cm e sem evidência de metástases ganglionares16. O seguimento proposto pelo consenso do ENETS (2005) para TNE duodenais consiste na reavaliação endoscópica, imagiológica (por ecografia ou tomografia abdominal) e doseamento da cromogranina A aos 6, 24 e 36 meses após a excisão endoscópica.
Bibliografia
1. Modlin I, Kidd M, Latich I, et al. Current status of gastrointestinal carcinoids. Gastroenterology. 2005;128:1717‑51. [ Links ]
2. Plockinger U, Rindi G, Arnold R, et al. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology. 2004;80:394‑424. [ Links ]
3. Williams ED, Sandler M. The classification of carcinoid tumors. Lancet. 1963;1:238‑9. [ Links ]
4. Rindi G, Azzoni C, La Rosa S, et al. ECL cell tumor and poorly differentiated endocrine carcinoma of the stomach: prognostic evaluation by pathological analysis. Gastroenterology. 1999;116:532‑42. [ Links ]
5. Kulke MH, Mayer RJ. Carcinoid tumors. N Engl J Med. 1999;340: 858‑68. [ Links ]
6. Hellman P, Lundstrom T, Ohrall U, et al. Effect of surgery on the outcome of malignant carcinoide disease with lymph node and liver metastases. World J Surg. 2002;26:991‑7. [ Links ]
7. Borch K, Ahrén B, Ahlman H, et al. Gastric carcinoids: biologic behavior and prognosis after differentiated treatment in relation to type. Ann Surg. 2005;242:64‑73. [ Links ]
8. Massironi S, Sciola V, Spampatti MP, et al. Gastric carcinoids: Between underestimation and overtreatment. World J Gastroenterol. 2009;15: 2177‑83. [ Links ]
9. Higham AD, Bishop LA, Dimaline R, et al. Mutations of RegIa are associated with ECL cell tumor development in patients with hypergastrinemia. Gastroenterology. 1999;116:1310‑8. [ Links ]
10. Kloppel G, Perren A, Heitz PU. The gastroenteropancreatic neuroendocrine cell system and its tumors. The WHO classification. Ann N Y Acad Sci. 2004;1014:13‑27. [ Links ]
11. Shebani KO, Souba WW, Finkelstein DM, et al. Prognosis and survival in patients with gastrointestinal tract carcinoid tumors. Ann Surg. 1999;229:815‑21. [ Links ]
12. Kirshbom PM, Kherani AR, Onaitis MW, et al. Foregut carcinoids: a clinical and biochemical analysis. Surgery. 1999;126:1105‑10. [ Links ]
13. Kidd M, Tang LH, Modlin IM, et al. Gastrin‑mediated alterations in gastric epithelial apoptosis and proliferation in a mastomys rodent model of gastric neoplasia. Digestion. 2000;62:143‑51. [ Links ]
14. Eriksson B, Oberg K, Stridsberg M. Tumor markers in neuroendocrine tumors. Digestion. 2000;62 (Suppl 1):33‑8. [ Links ]
15. Nobels FR, Kwekkeboom DJ, Coopmans W, et al. Chromogranin A as serum marker for neuroendocrine neoplasia: comparison with neuron‑specific enolase and the subunit of glycoprotein hormones. J Clin Endocrinol Metab. 1997;82:2622‑8. [ Links ]
16. Zyromski NJ, Kendrick ML, Nagorney DM, et al. Duodenal carcinoid tumors: how aggressive should we be? J Gastrointest Surg. 2001;5:588‑93. [ Links ]
*Autor para correspondência
Correio electrónico: joana.saiote@gmail.com
Recebido a 5 de fevereiro de 2010; aceite a 29 de março de 2011













