Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.18 no.6 Lisboa nov. 2011
Lesões Precursoras de Cancro do Fígado
José Velosa
Serviço de Gastrenterologia e Hepatologia, Hospital de Santa Maria, Faculdade de Medicina de Lisboa, Universidade de Lisboa
RESUMO
A identificação de condições patológicas e de lesões precursoras de carcinoma hepatocelular (CHC) e de colangiocarcinoma (CC) é fundamental para a prevenção e o manejo clínico do cancro do fígado. A cirrose, independentemente da etiologia, e o adenoma hepático são as principais condições predisponentes de CHC. A colangite eslcerosante, a hepatolitíase e as malformações biliares são patologias pré-malignas potenciais do CC. Em ambos os tumores, a transformação maligna ocorre lentamente e de forma progressiva através de estádios intermédios dominados pela sequência displasia-carcinoma. A inflamação crónica é o factor que favorece a proliferação celular, diminui a apoptose e facilita o aparecimento de mutações genéticas que promovem a hepatocarcinogénese.
O macronódulo e os nódulos displásicos, em particular os de pequenas células, são considerados lesões pré-neoplásicas em doentes com cirrose hepática, enquanto o adenoma hepático (AH), principalmente quando associado a mutações da β-catenina, é uma causa de CHC em doentes não cirróticos. Como os métodos imagiológicos correntes são insensíveis para detectar ou para esclarecer a natureza de lesões de reduzidas dimensões, o diagnóstico dos nódulos displásicos e o seu cariz maligno está dependente da biópsia hepática. Existe a expectativa que o aperfeiçoamento dos métodos imagiológicos e o desenvolvimento de novos testes serológicos permitam o rastreio não invasivo das lesões precursoras de cancro do fígado.
PALAVRAS-CHAVE: Macronódulo regenerativo; nódulo displásico; cirrose; carcinoma hepatocelular; colangiocarcinoma intrahepático.
Precursor Lesions of Liver Cancer
ABSTRACT
The identification of precancerous hepatic lesions is an important step in the prevention and clinical management of liver cancer. Cirrhosis, irrespective of its etiology, and hepatocellular adenoma (HA) are the most important predisposing conditions for hepatocellular carcinoma (HCC). As far as colangiocarcinoma is concerned, potentially premalignant pathologies include primary sclerosing cholangitis, hepatolithiasis and biliary malformations. In both tumors, malignant transformation is a multistep process through intermediary stages dominated by the dysplasia-carcinoma sequence. Chronic inflammation is the determinant factor promoting genetic mutations involved in hepatocarcinogenesis.
Regenerative macronodule and dysplasia, particularly small cells dysplastic nodules, are documented as intermediary lesions in neoplastic transformation in cirrhotic patients. HA, particularly when associated with β-catenin mutations, is responsible for HCC in non cirrhotic patients. Diagnosis and evaluation of the malignant potential of dysplastic nodules requires histological examination, because current radiologic tools are relatively insensitive in detecting or elucidating borderline lesions. In future, advances in radiologic methods and development of new serologic assays could allow non invasive screening of precursor lesions of liver cancer.
KEYWORDS: Macroregenerative nodule; dysplastic nodule; cirrhosis; hepatocellular carcinoma; intrahepatic cholangiocarcinoma.
INTRODUÇÃO
O cancro primário do fígado é o quinto cancro mais comum em todo o mundo1, sendo o carcinoma hepatocelular (CHC) responsável por cerca de 90% dos casos. Existe uma larga variação geográfica na prevalência do cancro do fígado, de tal modo que menos de 20% dos casos têm origem nos países ocidentais.
A incidência dos dois tumores malignos mais frequentes do fígado – o CHC e o colangiocarcinoma (CC) – tem aumentado significativamente nos últimos anos, apesar dos factores predisponentes para os dois tipos de cancro serem conhecidos2-6. A expansão dos programas de vigilância, a maior longevidade dos doentes com cirrose e a eventual alteração da prevalência dos factores de risco poderão explicar o acréscimo de casos diagnosticados7.
A cirrose está presente em mais de 80% dos casos de carcinoma hepatocelular (CHC)8,9, podendo a percentagem ser superior se o método de diagnóstico utilizado for a autópsia. O risco de desenvolvimento de CHC depende da etiologia da cirrose10-13, das características demográficas dos indivíduos afectados2,14,15, de factores víricos nas hepatopatias víricas16,17, da ocorrência de comorbilidades, da influência agentes externos, e da presença de coinfecções18-21. Contudo, uma proporção significativa de doentes com CHC, que pode atingir os 50%, não apresenta um factor de risco definido22.
Os doentes com cirrose hepática associada ao VHC apresentam maior susceptibilidade para o desenvolvimento de colangiocarcinoma intrahepático (CCI), mas o risco não é, apesar de tudo, significativo23. Outras causas assumem particular relevância, especialmente as patologias que cursam com inflamação crónica das vias biliares como, por exemplo, a litíase intrahepática, a colangite esclerosante primária e as malformações dos ductos biliares24.
A identificação dos marcadores que estão associados ao cancro do fígado e a avaliação quantitativa do risco são fundamentais para a implementação de programas de rastreio tendo em vista a sua detecção e tratamento precoces. A alfa-fetoproteína tem sido o marcador serológico mais usado para o rastreio e para o diagnóstico de CHC, não obstante revelar uma sensibilidade bastante baixa nas fases precoces do tumor25,26. No futuro, espera-se que a análise dos perfis moleculares do tumor, o reconhecimento dos padrões associados às lesões preliminares e a identificação das proteínas transcritas pelos genes mutados permitam a preparação de testes serológicos capazes de rastrear e diagnosticar precocemente o CHC27-29.
São essencialmente as lesões histológicas precursoras, como a displasia, os nódulos displásicos e o índice de proliferação celular aumentado que alertam para a eminência de transformação maligna30-32. Apesar de apresentarem uma morfologia nodular, estas lesões escapam aos métodos de imagem tradicionais33-35, pelo que o seu reconhecimento só pode ser feito histologicamente36.
Não existem marcadores tumorais específicos para o CCI. O CA 19-9 pode estar elevado, mas a sua capacidade diagnóstica é bastante baixa, principalmente se for usado na diluição corrente37. À semelhança do que acontece no CHC, a expectativa de novos marcadores moleculares está depositada no resultado dos estudos de genómica e proteómica38.
Nesta revisão analisamos as condições patológicas e as lesões precursoras relacionadas com o desenvolvimento de CHC e de colangiocarcinoma intrahepático (CCI) e os mecanismos patogénicos envolvidos na carcinogénese.
LESÕES PRECURSORAS DE CARCINOMA HEPATOCELULAR EM DOENTES COM CIRROSE
Cirrose Hepática
A implicação da cirrose na patogénese do CHC derivou essencialmente da verificação de que o tumor raramente ocorre em fígados sem cirrose. A regeneração hepática, e a consequente cirrose, está presente em cerca de 80% - 90% dos casos de CHC, sendo o tumor, presentemente, uma complicação e causa de morte importante nos doentes com cirrose39-42. O risco de desenvolvimento do tumor varia em função da etiologia da cirrose, sendo mais elevado nos doentes com infecção pelos VHB e VHC10,43,44 (Quadro 1). Os factores relacionados com o vírus e com o hospedeiro desempenham um papel importante no desenvolvimento do tumor. Nas cirroses associadas ao VHB e ao VHC, a persistência da replicação vírica e, em particular, as virémias altas, são factores que aumentam o risco de desenvolvimento de CHC16,17,45,46; a idade mais avançada, o sexo masculino, o estádio mais avançado da fibrose hepática e o consumo de álcool são também factores de risco significativos47-50. O CHC pode, contudo, ocorrer em doentes não cirróticos portadores do VHB10 e em doenças hepáticas que cursam sem cirrose, como a colestase familiar progressiva de tipo 2 (BSEP)51, em algumas doenças metabólicas52-55, e em populações expostas a elevados teores de aflatoxina56.
Quadro 1. Risco de Carcinoma Hepatocelular de Acordo com a Etiologia da Cirrose.

A hepatocarcinogénese é um processo lento que se desenrola em múltiplas etapas (Fig. 1). A regeneração hepática e o processo inflamatório que lhe dá origem proporcionam as condições favoráveis para a ocorrência das alterações genéticas e epigenéticas que levam à proliferação celular e, simultaneamente, à inibição da apoptose57,58. Em dado momento, surgem focos de hepatócitos monoclonais que, através de um processo de arterialização progressivo, se autonomizam e organizam em nódulos (nódulo displásico); seguem-se a invasão estromal (cancro inicial), a invasão venosa e, finalmente, a metastização (cancro avançado). Subsistem ainda muitas dúvidas e incertezas quanto às etapas intermédias, nomeadamente no que diz respeito às lesões que indicam que o processo degenerativo entrou numa fase irreversível58. A compreensão do carácter multisequencial do tumor primário do fígado e da relevância clínica das lesões preliminares provém, em boa parte, do exame minucioso dos fígados explantados de doentes com CHC, em particular da análise dos pequenos nódulos que normalmente circundam o tumor principal59,60.
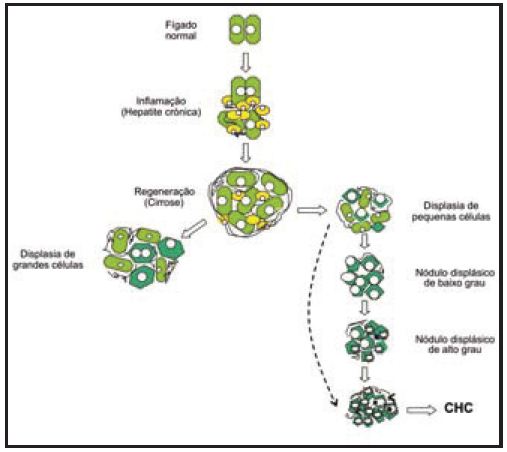
Fig. 1. A progressão da cirrose para o carcinoma hepatocelular (CHC) processa-se por uma sequência de eventos dominados pelas mutações genéticas, proliferação celular, displasia de pequenas células, nódulo displásico e, finalmente, CHC. A evolução para CHC pode fazer-se directamente a partir do nódulo de pequenas células.
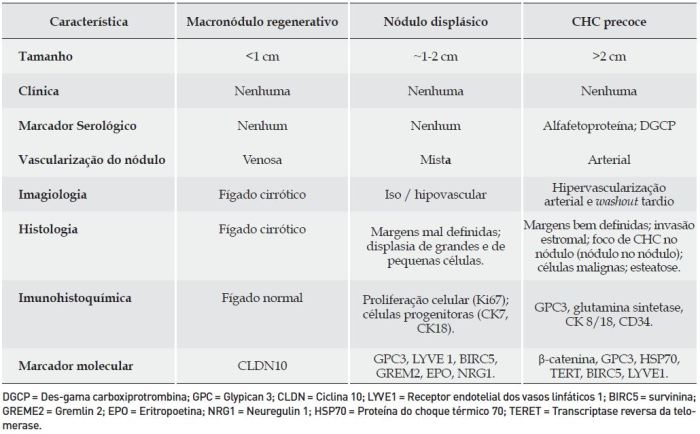
Como já foi salientado, as lesões pré-malignas, nomeadamente os nódulos displásicos, escapam quase sempre à detecção imagiológica, pelo que o seu diagnóstico requer um exame histológico cuidadoso realizado por patologistas experientes61. Algumas lesões, como os macronódulos regenerativos, podem ter tradução imagiológica, mas a capacidade descriminativa dos métodos de imagem ainda é insuficiente para distinguir um vulgar nódulo de regeneração de um CHC em fase precoce. No que diz respeito ao CHC, o diagnóstico imagiológico baseia-se na hipervascularização arterial e no washout venoso tardio, características essas que não ocorrem nas fases mais precoces (hipovasculares) do tumor62. Por outro lado, o grau de diferenciação celular do tumor pode, igualmente, afectar a acuidade diagnóstica das técnicas de contraste dinâmicas aplicadas ao diagnóstico de pequenos CHC63. Enquanto os marcadores moleculares e os testes serológicos baseados na proteómica não estiverem disponíveis na prática clínica29, o diagnóstico precoce do CHC depende quase exclusivamente do exame histológico e de marcadores imunohistoquímicos específicos (Quadro 2). A importância do diagnóstico precoce destas lesões, idealmente com diâmetro inferior a 2 cm, deve-se ao facto da invasão e da terapêutica curativa estarem directamente relacionadas com o tamanho da lesão64,65.
Quadro 2. Características Distintivas Entre os Nódulos Pré-Malignos e o Carcinoma Hepatocelular (CHC) Precoce.
Lesões Nodulares Hepatocelulares
A classificação das lesões nodulares do fígado, de acordo com o International Working Party66, está descrita no Quadro 3. No processo de carcinogénese por etapas, os focos displásicos evoluem para nódulos displásicos de baixo ou alto grau e estes, por sua vez, para CHC31,67 (Fig. 1). Os focos de displasia de pequenas e grandes células representam as alterações mais precoces que são possíveis reconhecer no desenvolvimento do CHC68,69. Estes focos, constituídos por agrupamentos de células, de dimensões inferiores a 1 mm, estão dispersos pelo fígado, sendo reconhecidos somente pelas características das células, que se distinguem morfologicamente das células do parenquima adjacente. Se as condições que os promoveram persistirem, como por exemplo a replicação vírica, poderão progredir para focos de displasia de pequenas e de grandes células, posteriormente para nódulo displásico ( > 1 mm) de baixo ou alto grau e, por fim, para CHC35,67.
Quadro 3. Terminologia das Lesões nodulares Hepatocelulares, de Acordo com o International Working Party (1994)*.

O nódulo displásico constitui uma formação nodular bem individualizada do tecido cirrótico circundante pelo tamanho ( > 1 mm), cor e textura, e por ser formado por hepatócitos contendo alterações arquitecturais e/ou citológicas (Quadro 2). Os estudos de análise clonal mostram que o nódulo displásico corresponde à expansão de um clone de células geneticamente alteradas, que numa fase inicial se organizam num foco hiperplástico – presentemente designado por displásico de pequenas ou grandes células – e que posteriormente evolui para CHC precoce70,71.
Cerca de um terço dos nódulos displásicos evoluem para CHC62,72. É comum encontrá-los na vizinhança da lesão maligna.
Macronódulo Regenerativo
A presença de um ou mais nódulos no fígado de doentes com cirrose é um achado frequente, embora não isento de dificuldade de interpretação quanto à sua natureza (Quadro 3). Estes nódulos, também designados como macronódulos regenerativos (MNRs), caracterizam-se, não tanto pelo tamanho, mas pela cor e textura, as quais são claramente distintas do restante parenquima hepático73. Os MNRs podem ser encontrados em qualquer tipo de cirrose, com uma prevalência que varia entre 14% e 25%73.
Existe uma forte associação entre a presença de MNRs e o desenvolvimento de CHC, prevalecendo a convicção de que os MNRs, mais do que meras lesões colaterais, são lesões de natureza pré-maligna74,75. Vários factos apontam para um papel efectivo dos MNRs na hepatocarcinogénese: a presença no mesmo fígado de MNRs e CHC; a ocorrência num MNR de um ou mais focos de displasia ou de CHC; e a progressão do MNR para CHC75,76. O seguimento de doentes com macronódulos mostra que, não obstante 17% dos nódulos desaparecerem, cerca de metade evoluem para CHC no prazo de 5 anos, sendo a presença de displasia uma condição predizente de transformação maligna74.
A distinção entre um macronódulo e um CHC depende da caracterização histológica, que nem sempre é óbvia dada a dificuldade em distinguir um nódulo de regeneração de um CHC bem diferenciado. Quando na avaliação de um nódulo hepático de pequenas dimensões se verifica discrepância entre dois métodos de imagem, recomenda-se a realização de biópsia hepática para o seu esclarecimento62. Contudo, nem sempre uma única biópsia esclarece a natureza do nódulo, sendo, com alguma frequência, necessário insistir no exame histológico77. Como já foi mencionado, pode-se evocar um erro de amostragem mas, atendendo ao potencial maligno do macronódulo, também se pode contrapor com o desenvolvimento posterior do CHC. Borzio et al72 seguiram durante 33 meses 90 doentes cirróticos com macronódulos detectados por ecografia, tendo verificado que a transformação maligna ocorria em 31% dos doentes, com uma incidência de 49% aos 5 anos.
Se o MNR se desenvolve a partir de um pequeno nódulo cirrótico ou tem origem na expansão de um clone celular fora de qualquer nódulo é uma questão ainda em aberto73. Os MNRs monoclonais parecem conter um risco mais elevado de CHC do que os policlonais, pelo que a análise da clonicidade dos macronódulos pode ser útil na avaliação do prognóstico destas lesões78. A análise molecular do macronódulo, revelando a sub expressão de vários genes comparativamente ao tecido cirrótico, aponta para o carácter evolutivo do macronódulo e do seu papel de lesão intermédia entre a cirrose e o CHC. Um dos genes, o Klf6, parece desempenhar um papel importante, pois tem uma reduzida expressão em todos os macronódulos79.
Existe uma relação entre o tamanho do nódulo e a probabilidade de CHC62. Infelizmente, é nos nódulos de dimensões inferiores a 1 cm, onde o macronódulo se posiciona, que a acuidade diagnóstica dos métodos de imagem para o diagnóstico do CHC é mais baixa33. O MNR, ao contrário do CHC, tem uma circulação predominantemente venosa, não apresentando, portanto, as características imagiológicas típicas do CHC (Fig. 2), embora este facto não afaste completamente a presença de um CHC hipovascular. Como nem sempre é possível distinguir o macronódulo do CHC, quer imagiológica quer histologicamente, a estratégia recomendada é o seguimento a intervalos de 3 meses com a técnica de imagem que primeiro documentou a presença do nódulo62.
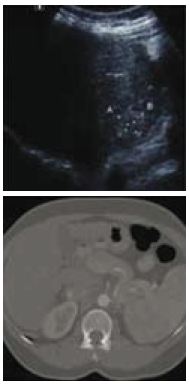
Fig. 2. (A), macronódulo regenerativo numa doente com cirrose hepática associada ao vírus da hepatite C. No exame ecográfico, o fígado é difusamente nodular, destacando-se um nódulo de 2,2 cm, ligeiramente hiperecogénico. (B), a TAC com contraste não mostrou qualquer nódulo na fase arterial.
Nódulo Displásico
Foco displásico de pequenas células (DPC). Estes focos são constituídos por grupos de hepatócitos monoclonais, que apresentam volume citoplasmático diminuído e núcleo moderadamente aumentado, resultando numa relação núcleo-citoplasma aumentada (Fig. 3). Estas células expressam em mais de metade dos casos marcadores imunohistoquímicos de células progenitoras (CK7, CK19) ou de hepatócitos intermédios (CK8, CK18) e revelam elevado índice de proliferação e baixa taxa de apoptose. Multinucleação e nucléolos podem ser observados. A DPC é constituída por células mitoticamente activas, que adquiriram autonomia proliferativa por via das mutações genéticas.
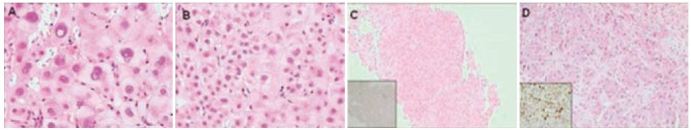
Fig. 3. (A), displasia de grandes células. (B), displasia de pequenas células, num fígado cirrótico (H&E). (C), nódulo displásico de baixo grau, com 8 mm, num doente com cirrose associada ao vírus da hepatite C; observa-se irregularidade e aumento da espessura das trabéculas, e aumento da densidade nuclear sem atipia citológica; a imunohistoquímica para o Ki67 revela fraca proliferação celular. (D), carcinoma hepatocelular, com elevada proliferação celular marcada pelo Ki67.
O envolvimento das células progenitoras na patogénese do CHC tem sido matéria de investigação, mas algumas dúvidas ainda subsistem quanto ao seu verdadeiro papel na hepatocarcinogénese. Cerca de 50% dos casos de CHC expressam marcadores de células progenitoras, tais como as citoqueratinas 7 e 19, mas não é certo se esses tumores têm origem na proliferação e em mutações das células progenitoras existentes nos canais de Hering (teoria da paragem da maturação). Uma teoria alternativa – teoria da desdiferenciação –, propõe que os hepatócitos maduros regridem para células imaturas adquirindo características de hepatócitos intermédios80. Patologicamente é possível admitir ambas as teorias, embora a presença de células intermédias na periferia de focos de DPC expressando de forma homogénea marcadores de células progenitoras sugira que, em situações de forte actividade regenerativa, possa ocorrer a diferenciação das células progenitoras (teoria da paragem da maturação).
Foco displásico de grandes células (DGC). Os hepatócitos destes focos são atípicos, com núcleo grande, pleomorfismo nuclear e nucléolo proeminente, mas a relação núcleo-citoplasma é normal (Fig. 3). São frequentes a multinucleação (anisocariose) e as pseudoinclusões nucleares.
O carácter pré-neoplásico dos focos displásicos, em particular daqueles contendo grandes células, tem originado alguma controvérsia81. O papel da DGC como precursor efectivo de CHC e o alto valor predizente de degenerescência maligna que lhe foi atribuído49 têm cada vez menos defensores. A teoria mais em voga actualmente sustenta que, não obstante a DGC estar patogenicamente ligada ao desenvolvimento de CHC, não representa, todavia, um precursor directo de CHC. As células grandes não seriam mais do que células senescentes, com pouca ou nenhuma capacidade proliferativa82.
Em condições normais, os hepatócitos permanecem em repouso mitótico. Nas situações de intenso turnover celular, como é comum no processo regenerativo, as células vão perdendo gradualmente a capacidade de se dividirem devido ao progressivo encurtamento do telómero. A acumulação destas células displásicas senis83 decorre paralelamente com o desenvolvimento de CHC devendo, então, a sua presença ser encarada como um marcador de risco paralelo, uma espécie de um sinaleiro.
Nódulo displásico de baixo grau (NDBG). Tem uma estrutura bem definida, medindo cerca de 1.0 cm, não tem cápsula e apresenta uma tonalidade levemente mais amarelada do que os pseudonódulos da cirrose. É constituído por células ligeiramente mais basófilas, a relação núcleo/citoplasma é normal ou ligeiramente aumentada, a atipia nuclear é mínima e não há mitoses (Fig. 3). São hipovasculares e ricos em células contendo gordura, razão porque alguns destes nódulos são detectados como nódulos hiperecóicos no estudo ecográfico. Estudos moleculares recentes, recorrendo à tecnologia dos microarrays, revelaram não só alterações genéticas sugestivas de expansão monoclonal, mas também uma clara demarcação genética entre o nódulo displásico e o CHC bem definido28,29. A confirmação de que os NDBG podem progredir para CHC avançado e a verificação de que alguns CHC contêm células com displasia de baixo grau são elementos a favor do potencial maligno destes nódulos.
Nódulo displásico de alto grau (NDAG). Tem dimensão ligeiramente superior (cerca de 1,5 a 2,0 cm) ao NDBG, apresenta maior densidade celular, atipia nuclear mais evidente, basofilia mais marcada e alterações arquitecturais que compreendem trabéculas mais espessas e aspectos pseudo-acinares. Estas alterações estão muitas vezes organizadas em um ou mais focos dentro do nódulo, dando a aparência de formação de nódulo-dentro-de-nódulo; a esteatose é difusa, as células endoteliais sinusoidais não expressam as características imunohistoquímicas próprias, sinal revelador de capilarização incompleta, e as artérias estão desemparelhadas. A invasão estromal, isto é, a penetração das células tumorais nos espaços porta incluídos no nódulo caracteriza, para alguns autores, o nódulo com displasia de alto grau, enquanto para os autores japoneses este achado significa já um CHC bem diferenciado36. O designado nódulo-dentro-de-nódulo pode ter tradução imagiológica, aparecendo como um nódulo hiperecóico contendo no seu interior um nódulo hipoecóico bem demarcado31. A Fig. 4 ilustra a evolução de um nódulo displásico de pequenas células para CHC num doente com cirrose.
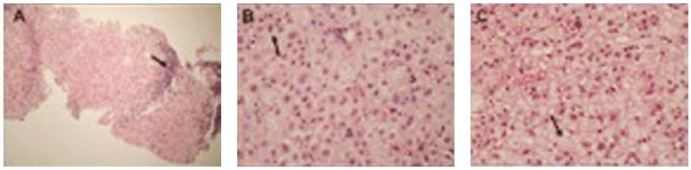
Fig. 4. Desenvolvimento de carcinoma hepatocelular num doente com cirrose hepática associada ao vírus da hepatite C. (A), nódulo cirrótico com infiltrado inflamatório septal linfo-plasmocitário, com agregados linfóides (seta); esteatose micro e macro vesicular. (B), nódulo displásico de baixo grau, com displasia de pequenas células, algumas binucleadas (seta), com irregularidade e aumento da espessura das trabéculas, aumento de densidade nuclear, sem atipias citológicas proeminentes. (C), carcinoma hepatocelular trabecular bem diferenciado, observando-se inúmeros corpos pálidos (seta) intracitoplasmáticos, ligeiramente eosinofílicos.
Nos pequenos nódulos, a distinção entre o nódulo com displasia de alto grau e o CHC bem diferenciado nem sempre é fácil, e pode mesmo ser impossível, principalmente se a biópsia for realizada com agulha fina. Esta reduz a possibilidade de avaliar a invasão estromal, não só porque o fragmento colhido contém espaços porta em menor número, diminuindo ainda mais o já de si reduzido número de espaços porta nos nódulos displásicos, mas também porque os pequenos CHC, inferiores a 2 cm de diâmetro, podem ser indistintamente nodulares, hipovasculares, sem cápsula e, por esse motivo, facilmente confundidos com o tecido cirrótico31. Neste tipo de CHC, embora bem individualizado ecograficamente, os aspectos histopatológicos são vagos e imprecisos, a atipia celular é ligeira, principalmente nas margens do nódulo onde as células são bem diferenciadas, proliferam activamente e invadem e confundem-se com o tecido não tumoral. A área de tecido neoplásico bem diferenciado diminui à medida que o tumor cresce, sendo substituída por tecido moderadamente ou pouco diferenciado quando os tumores atingem os 3 cm. O conteúdo em gordura vai diminuindo e praticamente desaparece. Esta evolução morfológica do tumor está em estreita correspondência com as alterações genéticas28.
O estudo do perfil molecular do genoma permite discriminar o nódulo displásico do pequeno CHC em doentes com cirrose29 (Quadro 2). Três genes (glipican-3, survinina e LYVE1) e a imunohistoquímica das proteínas expressas, em particular da GPC3, diferenciam com elevada sensibilidade e especificidade aqueles dois tipos de lesões84-86. Através da técnica da assinatura molecular é possível, em doentes com CHC associado ao VHC, verificar que a cada estádio patológico corresponde um perfil genético específico87.
LESÕES PRECURSORAS DE CARCINOMA HEPATOCELULAR EM DOENTES SEM CIRROSE
Adenoma hepático (AH)
O AH é um tumor benigno do fígado, presumivelmente de origem epitelial, que ocorre em cerca de 0,004% da população em risco. Esta é constituída em 90% dos casos por mulheres jovens tomando contraceptivos orais. Está, também, associado à terapêutica hormonal com androgéneos, à glicogenose tipo I e III e à diabetes tipo III (MODY3). Apesar de incidência do AH ter diminuído nos últimos anos, provavelmente como consequência dos actuais contraceptivos possuírem uma dosagem mais baixa de estrogéneos, o interesse pelo adenoma hepático recrudesceu devido ao facto de recentemente se ter demonstrado que pode representar uma lesão precursora de CHC. Esta evolução permite explicar os casos de desenvolvimento de CHC em fígados sem cirrose, sugerindo que uma das vias de hepatocarcinogénese poderia ser a sequência adenoma-carcinoma hepatocelular. Esta via alternativa adquire maior consistência se se atender ao facto de existirem exemplos de nódulos contendo os dois tipos de tecido88,89. A transformação maligna de um AH ocorre em cerca de 10% dos casos90-93, é mais frequente no homem (43%) e em doentes com nódulos de maiores dimensões93,94; contudo, não parece estar relacionada com o número de nódulos93. A explicação de maior incidência de malignização no sexo masculino pode residir na convergência de factores etiológicos implicados no desenvolvimento de CHC95.
Recorrendo a uma minuciosa caracterização genética e imunohistoquímica, o grupo de Bordeaux classificou os AHs em três subtipos: um grupo com mutações no gene HNF1α (35% - 50% dos casos); outro com activação da β-catenina (15% - 18%); e um terceiro sem mutações, inflamatório (40% - 55%)94-96. O último foi subdividido em dois subgrupos de acordo com a presença de infiltrado inflamatório. Dado que as alterações genéticas estão normalmente associadas a características morfológicas específicas, é possível classificar histologicamente os AHs em quatro grupos: esteatósicos (relacionados com as mutações HNF1a), pseudo-glandulares (com activação da β-catenina), inflamatórios e não inflamatórios. Curiosamente, os AHs de tipo inflamatório partilham alguns aspectos morfológicos e clínicos com a hiperplasia nodular focal, com a qual pode ser confundido97.
Nem todos os AHs possuem o potencial de transformação maligna, que está reservado apenas para os AHs com mutações na β-catenina94. Por outro lado, vem a propósito referir que os AHs são tumores monoclonais, cujo desenvolvimento resulta provavelmente da interacção entre defeitos genéticos e factores ambientais95,98,99. Quando comparado com o tipo liver fatty acid binding protein (LFABP)-negativo, o AH inflamatório (SAA/CRP-positivo) ocorre mais frequentemente em doentes com excesso de peso, esteatose e peliose hepática59,95. Este tipo de adenoma comporta um risco aumentado de CHC quando está presente a mutação da β-catenina59. A triagem dos doentes em risco pode ser efectuada através do estudo das mutações genéticas ou pela marcação imunohistoquímica da β-catenina no tecido hepático.
OUTRAS LESÕES OU CONDIÇÕES PRÉ-NEOPLÁSICAS
Os focos de hepatócitos desp rovidos de ferro (iron-free foci, na designação anglo-saxónica) observados na hemocromatose primária, em doentes com ou sem cirrose, são reveladores de displasia e de eventual desenvolvimento de CHC100,101. A esteatose focal e a presença de agregados de hepatócitos com inclusões do tipo dos corpos hialinos de Mallory parecem ter um significado idêntico102. Quanto aos focos de células claras ricas em glicogénio que podem ser encontrados no fígado cirrótico de doentes com CHC o seu significado é menos evidente75.
Embora os complexos de von Meyenburg (CVM) estejam associados ao desenvolvimento de CC, alguns casos de CHC foram descritos em doentes portadores daquelas malformações biliares, ainda que não esteja completamente afastada a possibilidade de serem apenas achados acidentais103. Esta hipótese tem suporte na ocorrência simultânea de doença hepática crónica associada ao vírus da hepatite C, ao álcool ou à hemocromatose, apesar de em alguns casos não haver cirrose103.
LESÕES PRECURSORAS DE COLANGIOCARCINOMA INTRAHEPÁTICO
O CCI é o tumor maligno que tem origem nos ductos biliares intrahepáticos. Compreende o tipo periférico e tipo peri-hilar, de acordo com a sua localização na árvore biliar, embora alguns autores considerem apenas os tumores com origem dentro do parenquima hepático104. Apesar de o CCI ser a segunda neoplasia intrahepática mais frequente depois do CHC, correspondendo a 10 - 20% das neoplasias malignas do fígado105,106, a frequência da forma periférica, com origem nos pequenos ductos, é inferior a 10%. A prevalência do CCI é mais elevada na Ásia devido a factores etiológicos locais.
Nos países ocidentais, a taxa de mortalidade por CCI tem registado um inexplicável acréscimo, contrariamente ao declínio verificado no CC extra-hepático107.
Somente em cerca de 10% dos casos é possível identificar um factor de risco responsável pelo CCI. Entre os factores bem estabelecidos (Quadro 4) contam-se a colangite esclerosante primária, a litíase intrahepática, a infestação por Opisthorcis viverrini, a cirrose, e as lesões congénitas das vias biliares como o quisto do colédoco, a doença de Caroli e os complexos de von Meyenburg23,108-111. A infecção crónica pelo vírus da hepatite C tem sido referida como um factor de risco para o CCI112-114. A presença de um processo inflamatório crónico é um traço comum a todas estas entidades e, provavelmente, o factor de risco determinante para o desenvolvimento de CCI. A doença poliquística do fígado, talvez pelo facto dos quistos não terem ligação às vias biliares, muito raramente se complica de CC115. A cirrose associada à hemocromatose e a cirrose biliar primária também não comportam um risco aumentado de CCI114.
Quadro 4. Condições Patológicas que Condicionam Risco de Desenvolvimento de Colangiocarcinoma Intrahepático.
A colangite esclerosante, primária ou secundária à doença inflamatória intestinal, possui um risco aumentado de CCI, que está estimado entre os 8% e os 20%, com um risco cumulativo de 31% aos 10 anos116. A incidência anual é de 1,5%, sendo mais elevada no primeiro ano após a detecção da doença117. O risco parece ser independente da duração da colangite esclerosante, da duração da doença inflamatória crónica intestinal, e não parece depender da presença de cirrose118,119. O Opisthorcis viverrini, e menos o clonorchis sinensis, são agentes etiológicos importantes em determinadas regiões da Ásia, sendo o processo inflamatório crónico originado pela presença do parasita nas vias biliares o responsável pela carcinogénese. O mesmo mecanismo, resultante da estáse biliar provocada pelos cálculos biliares intrahepáticos, aliada à infecção recorrente, parece estar na origem do CCI associado à hepatolítiase110.
Algumas malformações biliares, como o quisto congénito e a doença de Caroli, uma malformação congénita caracterizada por dilatações saculares dos ductos biliares intrahepáticos que afecta um segmento ou todo o fígado, comportam um risco aumentado de CC120. Novamente, é a inflamação crónica resultante da estáse, formação de cálculos e infecção secundária que proporciona as condições para a transformação maligna. Contudo, a ressecção do segmento afectado não elimina completamente o risco121.
Os complexos de von Meyenburg são microhamartomas biliares que se formam nos resquícios da placa ductal. A frequência varia entre os 0,6% e os 5,6%, consoante a série é baseada em biópsia de agulha ou cirúrgica122,123. Na ressonância magnética (RM), os CVM apresentam-se como numerosas pequenas lesões quísticas disseminadas pelo parenquima hepático, sem comunicação com as vias biliares124. A transformação maligna dos CVM é controversa, embora existam estudos que documentam a transição morfológica dos CVM para colangiocarcinoma111,125,126. Até 2009 tinham sido descritos 18 casos de CCI associado aos CVM125.
Atendendo ao aspecto macroscópico, o CCI classifica-se em nodular, infiltrativo, intraductal e misto104,127. Histologicamente pode apresentar características diversas108, mas, no geral, é um adenocarcinoma com estruturas tubulares e/ou papilares e um estroma fibroso (Quadro 5). Em 9% dos casos pode ser um carcinoma colangiohepatocelular128.
Quadro 5. Características do Colangiocarcinoma Intrahepático (CCI) Precoce.
Na ultrasonografia com contraste o CCI apresenta-se tipicamente como uma lesão com realce periférico em forma de anel na fase arterial129. Contudo, no doente cirrótico é comum o CCI apresentar com esta técnica uma captação homogénea do contraste na fase arterial e washout na fase venosa130, o que poderia originar um falso diagnóstico de CHC nos nódulos com diâmetro superior a 2 cm se fossem aplicados os critérios imagiológicos de diagnóstico preconizados pela AASLD62. A RM, mostrando uma progressiva captação do contraste nas diferentes fases do estudo dinâmico e, sobretudo, a ausência de washout pode permitir a distinção dos dois tipos de tumor130 (Quadro 5).
À semelhança do CHC, o desenvolvimento do CCI também está relacionado com alterações genéticas que ocorrem em sucessivas etapas. Têm sido propostos dois tipos de lesões precursoras: a neoplasia intraepitelial plana e a lesão intraductal papilar131,132. A primeira progride para adenocarcinoma tubular e a segunda para adenocarcinoma tubular ou carcinoma colóide133. Qualquer delas ocorre nos ductos biliares intra e extrahepáticos, mas são raramente observados nos ductos biliares mais periféricos (septais ou interlobulares). A primeira é identificada apenas histologicamente, enquanto a segunda pode ser observada radiologicamente132,134.
Presentemente, a neoplasia intraepitelial plana é classificada em três graus: displasia de baixo grau, displasia de alto grau e carcinoma in situ135; enquanto a lesão intraductal papilar é classificada em dois subgrupos: lesão benigna ou borderline e carcinoma in situ. Esta gradual transição arquitectural tem sido observada em doentes com CVM, nos quais as lesões hamartomatosas benignas evoluem para displasia, carcinoma in situe, finalmente, CC125,126. O risco parece ser mais elevado quando as lesões têm mais de 2 cm de diâmetro e um alto índice mitótico avaliado pelo Ki-67111. Shimonishi et al136 propõem uma sequência de eventos, comuns à maioria dos CCI, os quais começam na hiperplasia regenerativa do epitélio biliar, evoluem para displasia e culminam no carcinoma. Estas lesões precursoras revelam diversas alterações moleculares e genéticas133,136, podendo a marcação das proteínas expressas por estes genes servir como marcadores de transformação maligna em doentes em risco para o desenvolvimento de colangiocarcinoma137.
A hipermetilação do DNA e a consequente inactivação de genes supressores é uma via alternativa de carcinogénese admitida para o CC138. As alterações epigenéticas em genes reguladores, que contribuem tanto para a activação de oncogenes como para a inactivação de genes supressores, podem ocorrer precocemente e funcionar como iniciadores da transformação maligna138.
REFERÊNCIAS
1. Parkin DM, Pisani P, Ferlay J. Estimates of the worldwide incidence of 25 major cancers in 1990. Int J Cancer 1999;80:827-841. [ Links ]
2. McGlynn KA, Tsao L, Hsing AW, et al. International trends and patterns of primary liver cancer. Int J Cancer 2001;94:290-296. [ Links ]
3. Bosch FX, Ribes J, Díaz M, et al. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004;127:S5-S16. [ Links ]
4. El-Serag H, and Mason AC. Rising incidence of hepatocellular carcinoma in the United States. N Engl J Med 1999;340:745-750. [ Links ]
5. El-Serag H, Davila JA, Petersen NJ, et al. The continuing increase in the incidence of hepatocelular carcinoma in the United States: an update. Ann Intern Med 2003;139:817-823. [ Links ]
6. Patel T. Increasing incidence and mortality of primary in trahepatic cholangiocarcinoma in the United States. Hepatology 2001;33:1353-1357. [ Links ]
7. Velosa J. Tumores do fígado. In: Areias J, ed. Tratado de He7. patologia. 1ª edição. Lisboa: Permanyer Portugal 2006;499-546.
8. Zaman SN, Melia WM, Johnson RD, et al. Risk factors in development of hepatocellular carcinoma in cirrhosis: prospective study of 613 patients. Lancet 1885;i:1357-1360. [ Links ]
9. Tiribelli C, Melato M, Crocè LS, et al. Prevalence of hepatocellular carcinoma and relation to cirrhosis: comparison of two different cities of the world – Trieste, Italy, and Chiba, Japan. Hepatology 1989;6:998-1002. [ Links ]
10. Fattovich G, Stroffolini T, Zagni I, et al. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology 2004;127:S35-S50. [ Links ]
11. Velosa J, Raimundo M, Marinho R, et al. Carcinoma hepatocelular associado ao vírus da hepatite B e ao vírus da hepatite C. J Port Gastrenterol 1999;6:10-15. [ Links ]
12. Teufel A, Weimann A, Center C, et al. Hepatocellular carcinoma in patients with autoimmune hepatitis. World J Gastroenterol 2009;15:578-582. [ Links ]
13. Cavazza A, Caballería L, Floreani A, et al. Incidence, risk factors, and survival of hepatocellular carcinoma in primary biliary cirrhosis: comparative analysis from two centers. Hepatology 2009;50:1162-1168. [ Links ]
14. Evans AA, Chen G, Ross EA, et al. Eight-year follow.up of the 90,000-person Haimen city cohort: I. hepatocellular carcinoma mortality, risk factors, and gender differences. Cancer Epidemiol Biomark Prev 2002;11:369-376. [ Links ]
15. Di Bisceglie AM, Lyra AC, Schwartz M, et al. Hepatitis C-related hepatocellular carcinoma in the United States: influence of ethnic status. Am J Gastroenterol 2003;98:2060-2063. [ Links ]
16. Yang HI, Lu SN, Liaw YF, et al. Hepatitis B e antigen and the risk of hepatocellular carcinoma. N Engl J Med 2002;347:168-174. [ Links ]
17. Chen CJ, Yang HI, Su J, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA 2006;295:65-73. [ Links ]
18. Donato F, Tagger A, Chiesa R, et al. Hepatitis B and C virus infection, alcohol drinking, and hepatocellular carcinoma: a case-control study in Italy. Hepatology 1997;26:579-584. [ Links ]
19. Chuang WL, Chang WY, Lu SN, et al. The role of hepatitis B and C viruses in hepatocellular carcinoma in a hepatitis B endemic area. Cancer 1992;69:2052-2054. [ Links ]
20. Garcia-Samaniego X, Rodriguez M, Berenguer J, et al. Hepatocellular carcinoma in HIV-infected patients with chronic hepatitis C. Am J Gastroenterol 2001;96:179-183. [ Links ]
21. Hassan MM, Hwang LY, Hatten CJ, et al. Risk factors for hepatocellular carcinoma: synergism of alcohol with viral hepatitis and diabetes mellitus. Hepatology 2002;36:1206-1213. [ Links ]
22. Hassan MM, Frome A, Patt YZ, et al. Rising prevalence of hepatitis C virus infection among patients recently diagnosed with hepatocellular carcinoma in the United States. J Clin Gastroenterol 2002;35:266-269. [ Links ]
23. Shaib YH, El-Serag HB, Davila JA, et al. Risk factors of intrahepatic cholangiocarcinoma in the United States: a case control study. Gastroenterology 2005;128:620-626. [ Links ]
24. Khan SA, Davidson BR, Goldon R, et al. Guidelines for the diagnosis and treatment of cholangiocarcinoma: consensus document. Gut 2002:51;vi1-vi9. [ Links ]
25. McMahon BJ, Bulkow L, Harpster A, et al. Screening for hepatocellular carcinoma in Alaska natives infected with chronic hepatitis B. a 16-year population based study. Hepatology 2000;32:842-846. [ Links ]
26. Daniele B, Bencivenga A, Megna AS, et al. Α-fetoprotein and ultrasonography screening for hepatocellular carcinoma. Gastroenterology 2004;127:S109-S112. [ Links ]
27. Hsu HC, Jeng YM, Mao TL, et al. β-catenin mutations are associated with a subset of low-stage hepatocellular carcinoma negative for hepatitis B virus and with favourable prognosis. Am J Pathol 2000;157:763-770. [ Links ]
28. Nam SW, Park JY, Ramasamy A, et al. Molecular changes from dysplastic nodule to hepatocelular carcinoma through gene expression profile: Hepatology 2005; 42:809-818. [ Links ]
29. Llovet J, Chen Y, Wurmbach E, et al. A molecular signature to discriminate dysplastic nodules from early hepatocellular carcinoma in HCV cirrhosis. Gastroenterology 2006;131:1758-1767. [ Links ]
30. Terasaki S, Kanedo S, Kobayashi K, et al. Histological features predicting malignant transformation of non-malignant hepatocellular nodules: a prospective study: Gastroenterology 1998;115:1216-1222. [ Links ]
31. Kojiro M and Roskams T. Early hepatocellular carcinoma and dysplastic nodules. Semin Liver Dis 2005;25:133-142. [ Links ]
32. Donato MF, Arosio E, Del Ninno E, et al. High rates of hepatocellular carcinoma in cirrhotic patients with high liver cell proliferative activity. Hepatology 2001;34:523-528. [ Links ]
33. Bennett GL, Krinsky GA, Abitbol RJ, et al. Sonographic detection of hepatocellular carcinoma and dysplastic nodules in cirrhosis: correlation of pretransplantation sonography and liver explant pathology in 200 patients. Am J Roentgenol 2002;179:175-80. [ Links ]
34. Lim JH, Kim MJ, Park CK, et al. Dysplastic nodules in liver cirrhosis: detection with triple phase helical dynamic CT. Br J Radiology 2004;77:911-916. [ Links ]
35. Inoue T, Kudo M, Maenishi O, et al. Value of liver parenchymal phase contrast-enhanced sonography to diagnose premalignant and borderline lesions and overt hepatocellular carcinoma. Am J Roentgenol 2009;192:698-705. [ Links ]
36. Kojiro M. Focus on dysplastic nodules and early hepatocellular carcinoma: an eastern point of view. Liver Transpl 2004;10:S3-S8. [ Links ]
37. Nehls O, Gregor M, Klum B. Serum and bile markers for cholangiocarcinoma. Semin Liver Dis 2004;24:139-154. [ Links ]
38. Koopmann J, Thuluvath PJ, Zahurak ML, et al. Mac-2-binding protein is a diagnostic marker for biliary tract carcinoma. Cancer 2004;101:1609-1615. [ Links ]
39. Benvegnù L, Gios M, Boccato S, et al. Natural history of compensated viral cirrhosis: a prospective study on the incidence and hierarchy of major complications. Gut 2004;53:744-749. [ Links ]
40. Sangiovanni A, Prati GA, Fasani P, et al. The natural history of compensated cirrhosis due to hepatitis C virus: a 17-year cohort study of 214 patients: Hepatology 2006;43:1303-1310. [ Links ]
41. Fattovich G, Giustina G, Schalm SW, et al. Occurrence of hepatocellular carcinoma and decompensation in western European patients with cirrhosis type B. Hepatology 1995;21:77-82. [ Links ]
42. Fattovich G, Pantalena M, Zagni I, et al. Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis: a cohort study of 297 patients. Am J Gastroenterol 2002;97:2886-2895. [ Links ]
43. Simonetti SG, Cammà C, Fiorello F, et al. Hepatitis C virus infection as a risk factor for hepatocellular carcinoma in patients with cirrhosis. Ann Intern Med 1992;116:97-102. [ Links ]
44. Velosa J, Marinho R, Gouveia A, et al. Factores de risco para o carcinoma hepatocelular em doentes com cirrose hepática. J Port Gastrenterol 1994;1:3-13. [ Links ]
45. Chen CJ, Iloeje UH, Yang HI. Long term outcomes in hepatitis B: the REVEAL-HBV study. Clin Liver Dis 2007;11:797-816. [ Links ]
46. Velosa J, Serejo F, Marinho R, et al. Eradication of hepatitis C virus reduces de risk of hepatocellular carcinoma in patients with compensated cirrhosis. Dis Dis Sci 2011;56:1853-1861. [ Links ]
47. Yuen MF, Tanaka Y, Fong DY, et al. Independent risk factors and predictive score for the development of hepatocellular carcinoma in chronic hepatitis B. J Hepatol 2009;50:80-88. [ Links ]
48. Donato F, Tagger A, Gelatti U, et al. Alcohol and hepatocellular carcinoma: the effect of lifetime intake and hepatitis virus infections in men and women. Am J Epidemiol 2002;155:323-331. [ Links ]
49. Ganne-Carrié N, Chastang C, Chapel F, et al. Predictive score for the development of hepatocellular carcinoma and additional value of liver large cell dysplasia in Western patients with cirrhosis. Hepatology 1996;23:1112-1118. [ Links ]
50. Asahina Y, Tsuchiya K, Tamaki N, et al. Effect of aging on risk for hepatocellular carcinoma in chronic hepatitis C virus infection. Hepatology 2010;52:518-527. [ Links ]
51. Knisely AS, Strautnieks SS, Meier Y, et al. Hepatocellular carcinoma in ten children under five years of age with bile salt export pump deficiency. Hepatology 2006;44:478-486. [ Links ]
52. El-Serag. H, Tran T, Everhart JE. Diabetes increases the risk of chronic liver disease and hepatocellular carcinoma. Gastroenterology 2004;126:460-468. [ Links ]
53. Turlin B, Juguet F, Moirand R, et al. Increased liver iron stores in patients with hepatocellular carcinoma developed on a noncirrhotic liver. Hepatology 1995;22:446-450. [ Links ]
54. Elberg M, Hultcrantz R, Ekbom A, et al. Cancer risk in patients with hereditary hemochromatosis and in their first-degree relatives. Gastroenterology 2003;125:1733-1741. [ Links ]
55. Bugianesi E, Leone N, Vanni E, et al. Expanding the natural history of nonalcoholic steatohepatitis: from cryptogenic cirrhosis to hepatocellular carcinoma. Gastroenterology 2002;123:134-140. [ Links ]
56. Ming L, Thorgeirsson SS, Gail MH, et al. Dominant role of hepatitis B virus and cofactor role of aflatoxina in hepatocarcinogenesis in Qidong, China: Hepatology 2002;36:1214-1220. [ Links ]
57. Patel T, Steer CJ, Gores GJ. Apoptosis and the liver: a mechanism of disease, growth regulation, and carcinogenesis. Hepatology 1999;30:811-815. [ Links ]
58. El-Serag H, Rudolph K. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology 2007;132:2557-76. [ Links ]
59. Le Bail B, Bernard PH, Carles J, et al. Prevalence of liver cell dysplasia and association with HCC in a series of 100 cirrhotic liver explants. J Hepatol 1997;27:835-842. [ Links ]
60. Mion F, Grozel L, Boillot O, et al. Adult cirrhotic liver explants: precancerous lesions and undetected small hepatocellular carcinomas. Gastroenterology 1996;111:1587-1592. [ Links ]
61. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology 2009;49:658-664. [ Links ]
62. Bruix J, Sherman M. Management of hepatocellular carcinoma: an update. Hepatology 2011;53:1020-1022 (http://www.aasld.org/practiceguidelines) (Acesso em Outubro 2011). [ Links ]
63. Iavarone M, Sangiovanni A, Forzenigo LV, et al. Diagnosis of hepatocellular carcinoma in cirrhosis by dynamic contrast imaging. The importance of tumor cell differentiation. Hepatology 2010;52:1723-1730. [ Links ]
64. Takayama T, Makuuchi M, Hirohashi S, et al. Early hepatocellular carcinoma as an entity with a high rate of surgical cure. Hepatology 1998;28:1241-1246. [ Links ]
65. Bremner KE, Bayoumi AM, Sherman M, et al. Management of solitary 1 cm to 2 cm liver nodules in patients with compensated cirrhosis: a decision analysis: Can J Gastroenterol 2007;21:491-500. [ Links ]
66. International Working Party. Terminology of nodular hepatocellular lesions. Hepatology 1995;22:983-993. [ Links ]
67. Libbrecht L, Desmet V, Roskans T. Preneoplastic lesions in human hepatocarcinogenesis. Liver Int 2005;25:16-27. [ Links ]
68. Libbrecht L, Craninx M, Nevens F, et al. Predictive value of liver cell dysplasia for development of hepatocelular carcinoma in patients with non-cirrhotic and cirrhotic chronic viral hepatitis. Histopathology 2001;39:66-73. [ Links ]
69. Borzio M, Bruno S, Roncalli M, et al. Liver cell displasia is a major risk factor for hepatocellular carcinoma in cirrhosis: a prospective study. Gastroenterology 1995;108:812-817. [ Links ]
70. Aihara T, Noguchi S, Sasaki Y, et al. Clonal analysis of precancerous lesion of hepatocellular carcinoma. Gastroenterology 1996;111:455-461. [ Links ]
71. Sugitani S, Sakamoto M, Ichida T, 71. et al. Hyperplastic foci reflect the risk of multicentric development of hepatocellular carcinoma. J Hepatol 1998;28:1045-1053.
72. Borzio M, Fargion S, Borzio F, 72. et al. Impact of large regenerative, low grade and high grade dysplastic nodules in hepatocellular carcinoma development. J Hepatol 2003;39:208-214.
73. Theise ND. Macroregenerative (dysplastic) nodules and hepa73. tocarcinogenesis: theoretical and clinical considerations. Semin Liver Dis 1995;4:360-371.
74. Ferrell L, Wright T, Lake J, 74. et al. Incidence and diagnostic features of macroregenerative nodules vs small hepatocellular carcinoma in cirrhotic livers. Hepatology 1992;16:1372-1381
75. Theise ND, Schwartz M, Miller C, 75. et al. Macroregenerative nodules and hepatocellular carcinoma in forty-four sequential adult liver explants with cirrhosis. Hepatology 1992;16:949-955.
76. Hytiroglou P, Theise ND, Schwartz M, 76. et al. Macroregenerative nodules in a series of adult cirrhotic: issues of classification and nomenclature. Hepatology 1995;21:703-708.
77. Forner A, Vilana R, Ayuso C, 77. et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008;47:97-104.
78. Paradis V, Laurendeau I, Vidaud M, 78. et al. Clonal analysis of macronodules in cirrhosis. Hepatology 1998;28:953-959.
79. Bureau C, Péron JM, Bouisson M, 79. et al. Expression of the transcription factor Klf6 in cirrhosis, macronodules, and hepatocellular carcinoma. J Gastroenterol Hepatol. 2008;23:1-3.
80. Libbrecht L, Desmet V, Van Damme B, et al. The immunohistochemical phenotype of dysplastic foci in human liver: correlation with putative progenitor cells. J Hepatol 2000;33:76-84. [ Links ]
81. Park YN, Rocalli M. Large liver cell dysplasia: a controversialentity. J Hepatol 2006;45:734-743. [ Links ]
82. Ikeda H, Sasaki M, Sato Y, et al. Large cell change of hepatocytes in chronic viral hepatitis represents a senescent-related lesion. Human Pathology 2009;40:1774-1782. [ Links ]
83. Wiemann S, Satyanarayana A, Tsahuridu M, et al. Hepatocyte telomere shortening and senescence are general markers of human liver cirrhosis. FASEB J 2002;16:935-942. [ Links ]
84. Capurro C M, Wanless IR, Sherman M, et al. Glypican-3: a novel serum and histochemical marker for hepatocellular carcinoma. Gastroenterology 2003;125:89-97. [ Links ]
85. Libbrecht L, Severi T, Cassiman D, et al. Glypican-3 expression distinguishes small hepatocellular carcinomas from cirrhosis, dysplastic nodules, and focal nodular hyperplasia-like nodules. Am J Surg Pathol 2006;1405-1411. [ Links ]
86. Wang XY, Degos F, Dubois S, et al. Glypican-3 expression in hepatocellular tumors: diagnostic value for preneoplastic lesions and hepatocellular carcinomas. Hum Pathol 2006;37:1435-1441. [ Links ]
87. Wurmbach E, Chen Y, Khitrov G, et al. Genome-wide molecular profiles of HCV-induced dysplasia and hepatocellular carcinoma. Hepatology 2007;45:939-947. [ Links ]
88. Burri E, Steuerwald M, Cathomas G, et al. Hepatocellular carcinoma in a liver-cell adenoma within a non-cirrhotic liver. Eur J Gastroenterol Hepatol 2006;18:437-441. [ Links ]
89. Kogure T, Ueno Y, Sekiguchi S, et al. Liver cell adenoma showing sequential alteration of radiological findings suggestive of well-differentiated hepatocellular carcinoma. World J Gastroenterol 2009;15:1267-1272. [ Links ]
90. Weimann A, Ringe B, Kllempnauer J, et al. Critical issues in the diagnosis and treatment of hepatocellular carcinoma. HPB 2000;2:25-32. [ Links ]
91. Barthelmes L, Tait IS. Liver cell adenoma and liver adenomatosis. HPB 2005;7:186-196. [ Links ]
92. Cho SW, Marsh JW, Steel J, et al. Surgical management of hepatocellular adenoma: take it or leave it? Ann Surg Oncol 2008;15:2795-2803. [ Links ]
93. Dokmak S, Paradis V, Vilgrain V, et al. A single-center surgical experience of 122 patients with single and multiple hepatocellular adenomas. Gastroenterology 2009; 137:1698-1705. [ Links ]
94. Zucman-Rossi J, Jeannot E, Van Nhieu JT, et al. Genotype-phenotype correlation in hepatocelular adenoma: new classification and relationship with HCC. Hepatology 2006;43:515-524. [ Links ]
95. Bioulac-Sage P, Laumonier H, Couchy G, et al. Hepatocellular adenoma management and phenotypic classification: the Bordeaux experience. Hepatology 2009;50:481-489. [ Links ]
96. Bioulac-Sage P, Rebouissou S, Thomas C, et al. Hepatocellular carcinoma subtype classification using molecular markers and immunohistochemistry. Hepatology 2007;46:740-748. [ Links ]
97. Bioulac-Sage P, Rebouissou S, Cunha A, et al. Clinical, morphologic, and molecular features defining so-called telangiectatic focal nodular hyperplasias of the liver. Gastroenterology 2005;128:1211-1218. [ Links ]
98. Rebouissou S, Bioulac-Sage P, Zucman-Rossi J. Molecular pathogenesis of focal nodular hyperplasia and hepatocellular adenoma. J Hepatol 2008;48:163-170. [ Links ]
99. Bioulac-Sage P, Blanc JF, Rebouissou S, et al. Genotype phenotype classification of hepatocellular adenoma. World J Gastroenterol 2007;13:2649-2654. [ Links ]
100. Terada T, Nakanuma Y. Survey of iron-accumulative macroregenerative nodules in cirrhotic livers. Hepatology 1989;5:851-854. [ Links ]
101. Deugnier Y, Charalambous P, Le Quilleuc D, et al. Preneoplastic significance of hepatic iron-free foci in genetic hemochromatosis: a study of 185 patients. Hepatology 1993;18:1363-1369. [ Links ]
102. Terada T, Hoso M, Nakanuma Y. Mallory body clustering in adenomatous hyperplasia in human cirrhotic livers: report of four cases. Hum Pathol 1989;20:886-890. [ Links ]
103. Jain D, Nayak NC, Saigal S. Hepatocellular carcinoma arising in association with von-Meyenburgs complexes: an incidental finding or precursor lesions?. A clinicopathologic study of 4 cases. Ann Diagn Pathol 2010;14:317-320. [ Links ]
104. Malhi H, Gores GJ. Cholangiocarcinoma: modern advances in understanding a deadly old disease. J Hepatol 2006;45:856-867. [ Links ]
105. Okuda K, Nakanuma Y, Miyazaki M. Cholangiocarcinoma: recent progress. Part 1: epidemiology and etiology. J Gastroenterol Hepatol 2002;17:1049-1055. [ Links ]
106. Patel T. Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States. Hepatology 2001;33:1353-1357. [ Links ]
107. Shaib Y, Davila JA, McGlynn K, 107. et al. Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase? J Hepatol 2004;40:472-477
108. Enjoji M, Aishima S. Liver: intrahepatic cholangiocarcinoma. Atlas Genet Cytogenet Oncol Haematol. January 2008. [ Links ]
109. Ben-Menachem T. Risk factors for cholangiocarcinoma. Eur J Gastroentero Hepatol 2007;19:615-17. [ Links ]
110. Kuroki T, Tajima Y, Kanematsu T. Hepatolithiasis and intrahepatic cholangiocarcinoma: carcinogenesis based on molecular mechanisms. J Hepatobiliary Pancreat Surg 2005;12:463-466 [ Links ]
111. Song JS, Lee YJ, Kim KW, et al. Cholangiocarcinoma arising in von Meyenburg complexes: report of four cases. Pathol Internat 2008;58:503-512. [ Links ]
112. Kobayashi M, Ikeda K, Saitoh S, et al. Incidence of primary cholangiocellular carcinoma of the liver in Japanese patients with hepatitis C virus-related cirrhosis. Cancer 2000;2471-2477. [ Links ]
113. Yamamoto S, Kubo S, Hai S, et al. Hepatitis C virus infection as a likely etiology of intrahepatic cholangiocarcinoma. Cancer Sci 2004;95:592-595. [ Links ]
114. Shaib YH, El-Serag HB, Nooka AK, et al. Risk factors for intrahepatic and extrahepatic cholangiocarcinoma: a hospital-based case-control study. Am J Gastroenterol 2007;102:1016-1021. [ Links ]
115. Rosenfeld L, Corine B, Kallita M, et al. Les polykystoses hépatiques. Principales complications et prise en charge. Gastroenterol Clin Biol 2002;26:1097-1106. [ Links ]
116. Kornfeld D, Ekbom A, Ihre T. Survival and risk of cholangiocarcinoma in patients with primary sclerosing cholangitis. A population-based study. Scand J Gastroenterol 1997;32:1042-1045. [ Links ]
117. Bergquist A, Ekbom A, Olsson R, et al. Hepatic and extrahepatic malignancies in primary sclerosing cholangitis. J Hepatol 2002;36:321-327. [ Links ]
118. Broome U, Olsson R, Loof L, et al. Natural history and prognostic factors in 305 swedish patients with primary sclerosing cholangitis. Gut 1996;38:610-615 [ Links ]
119. Boberg KM, Bergquist A, Mitchell S, et al. Cholangiocarcinoma in primary sclerosing cholangitis: risk factors and clinical presentation. Scand J Gastroenterol 2002;37:1205-1211. [ Links ]
120. Serejo F, Velosa J, Carneiro de Moura M, et al. Caroli´s disease of the left hepatic lobe associated with hepatic fibrosis. J Clin Gastroenterol 1988;10:559-554. [ Links ]
121. Goto N, Yasuda I, Uematsu T, et al. Intrahepatic cholangiocarcinoma arising 10 years after the excision of congenital extrahepatic biliary dilation. J Gastroenterol 2001;36:856-862. [ Links ]
122. Thommesen N. Biliary hamatomas (von Meyenburg complexes) in liver needle biopsies. Acta Path Microbial Scand Sect 1978;86:93-99. [ Links ]
123. Redston MS, Wanless IR. The hepatic von Meyenburg complex with hepatic and renal cysts. Mod Pathol 1996;9:233-237. [ Links ]
124. Quentin M, Scherer A. The von Meyenburg complex. Hepatology 2010;52:1167-1168. [ Links ]
125. Xu AM, Xian ZH, Zhang SH, et al. Intrahepatic cholangiocarcinoma arising in multiple bile duct hamartomas: report of two cases and review of the literature. Eur J Gastroenterol Hepatol 2009;21:580-584. [ Links ]
126. Jain D, Sarode VR, Abdul-Karim FW, et al. Evidence for the neoplastic transformation of von Meyenburg complexes. Am J Surg Pathol 2000;24:1131-1139. [ Links ]
127. Patel T. Cholangiocarcinoma. Nat Cl Pract Gastroenterol Hepatol 2006;3:33-42. [ Links ]
128. Schlinkert RT, Nagorney DM, van Heerden JA, Adson MA. Intrahepatic cholangiocarcinoma: clinical aspects, pathology and treatment. Surgery 1992;5:95-102. [ Links ]
129. Claudon M, Cosgrove D, Albretch T, et al. Guidelines and good clinical practice recommendation for contrast enhanced ultrasound (CEUS) – update 2008. Ultraschall Med 2008;29:28-44. [ Links ]
130. Vilana R, Forner A, Bianchi L, et al. Intrahepatic peripheral cholangiocarcinoma in cirrhosis patients may display a vascular pattern similar to hepatocellular carcinoma on contrast-enhanced ultrasound. Hepatology 2010;51:2020-2029. [ Links ]
131. Zen Y, Adsay NV, Bardadin K, et al. Biliary intraepithelial neoplasia: an international interobserver agreement study and proposal for diagnostic criteria: Mod Pathol 2007;20:701-709. [ Links ]
132. Chen TC, Nakanuma Y, Zen Y, et al. Intraductal papillary neoplasia of the liver associated with hepatolithiasis. Hepatology 2001;34:651-658. [ Links ]
133. Nakanuma Y, Sasaki M, Sato Y, et al. Multisetep carcinogenesis of perihilar colangiocarcinoma arising in the intrahepatic large bile ducts. World J Hepatol 2009;31:35-42. [ Links ]
134. Lee JW, Han JK, Kim TK, et al. CT features of intraductal intrahepatic cholangiocarcinoma. AJR 2000;175:721-725. [ Links ]
135. Zen Y, Aishima S, Ajioka Y, et al. Proposal of histological criteria for intraepithelial atypical/proliferative biliary epithelial lesions of the bile duct in hepatolithiasis with respect to colangiocarcinoma: preliminary report based on interobserver agreement. Pathol Int 2005;55:180-188. [ Links ]
136. Shimonishi T, Sasaki M, Nakanuma Y. Precancerous lesions of intrahepatic cholangiocarcinoma. J Hepatobiliary Pancret Surg 2000;7:542-50. [ Links ]
137. Harada K, Zen Y, Kanemori Y, et al. Human REG I gene is up-regulated in intrahepatic cholangiocarcinoma and its precursor lesions. Hepatology 2001;33:1036-1042. [ Links ]
138. Tischoff I, Wittekind C, Tannapfel A. Role of epigenetic alterations in cholangiocarcinoma. J Hepatobiliary Pancreatic Surg 2006;13:274-279. [ Links ]
AGRADECIMENTO
O autor agradece encarecidamente à Dra. Adília Costa a cedência das imagens de histologia e a ajuda prestada na interpretação das mesmas.
Correspondência: Serviço de Gastrenterologia e Hepatologia, Hospital de Santa Maria, Faculdade de Medicina de Lisboa, Universidade de Lisboa; Av. Professor Egas Moniz – 1649-053 LISBOA
Recebido para publicação: 26/03/2011 e Aceite para publicação: 04/07/2011