Introdução
A perda de massa muscular é comum em doentes inter-nados em cuidados intensivos1-3e está associada a diversas consequências, entre as quais um aumento do tempo de internamento, do tempo de ventilação mecânica invasiva e da taxa de mortalidade.4-6Isto acontece devido ao stress metabólico a que o doente está sujeito.5 Existem múltiplos fatores associados ao desenvolvimento e progressão da atrofia muscular, tais como o inadequado suporte nutricional, períodos de imobilização prolongados, inflamação sistémica, sépsis e falência de órgãos.3,7-8Este declínio tem um impacto significativo no prognóstico do doente e é um dos fatores responsáveis pela diminuição das funções vitais e qualidade de vida dos doentes após a saída dos cuidados intensivos.3,9,10
No doente crítico, entende-se por suporte nutricional adequado o fornecimento por via entérica e/ou parentética de uma carga proteica e energética ajustada às necessidades metabólicas e nutricionais do doente.11 Refira-se que se trata de uma população muito heterogênea, e como tal a nutrição deve ser individualizada.12
Nos últimos anos, tem vindo a ser alvo de grande interesse o estudo sobre as alterações metabólicas, nomeadamente o estado hipermetabólico e hipercatabólico proteico a que os doentes em estado crítico estão sujeitos. Esta alteração no metabolismo vai ser responsável pela grande perda de massa muscular, através do catabolismo proteico, levando não só a um agravamento do estado nutricional do doente, mas também a uma maior atrofia muscular.12,13
De acordo com as guidelines da American Society for Parenteral and Enteral Nutrition (ASPEN), os requisitos de proteína variam no intervalo de 1,2-2 g/kg/dia. Os níveis de energia devem ser medidos através do uso de calorimetria indireta, mas pode-se recorrer à fórmula 25-30 kcal/kg/dia.14 Por outro lado, as guidelines de 2019 da European Society for Clinical Nutrition and Metabolism (ESPEN), ditam que o aporte proteico é de 1,3 g/kg/dia. Preconiza-se igualmente que os níveis de energia sejam medidos através do uso de calorimetria indireta, ou equações preditivas com VO2 e VCO2. Tal como as guidelines da ASPEN, também a ESPEN defende que a nutrição deve ser iniciada nas primeiras 48 horas. No entanto, é recomendado começar com uma nutrição hipocalórica (menos de 70% do gasto energético na fase aguda (dias 1-3 de ICU)). Após o terceiro dia de internamento a nutrição vai depender do método de medição do gasto energético. Se avaliado com calorimetria indireta, deve ser preferencialmente isocalórica (80%-100% do gasto energético), e com aumento progressivo. Quando calculado através de equações preditivas, deve-se manter uma nutrição hipocalórica (menos de 70%) durante a primeira semana.15
Assim, é importante a monitorização da massa muscular para avaliar a eficácia do suporte nutricional na tentativa de atenuar a atrofia da massa muscular. Nesta monitorização torna-se imprescindível a existência de ferramentas que nos possibilitem identificar quais os doentes em risco de desenvolver atrofia muscular, e que também nos permita monitorizar a sua evolução ao longo do internamento.3 Os métodos mais usados para avaliar a composição corporal do doente são as medições antropométricas, bioimpedância e técnicas imagiológicas: a absorciometria de energia dupla de raio X (DEXA), tomografia computorizada (TC), ressonância magnética (RM) e ecografia.16
A atrofia muscular no doente crítico é, muitas das vezes, camuflada por retenção de fluídos ou por excesso de tecido adiposo em doentes obesos.17 Perante estas circunstâncias, torna-se difícil a obtenção de resultados fiáveis quando utilizados como ferramenta de avaliação os dados antropométricos, que assumem um estado de hidratação normal18,19e não permitem diferenciar os diversos tecidos corporais.17
Vários estudos demonstraram que a ecografia apresenta uma correlação positiva com a TC e RM,20,21é ainda um método não invasivo, de fácil execução, de ferramenta de cabeceira, baixo custo, e sem radiação associada.5
Os objetivos deste estudo foram a avaliação da espessura muscular no bíceps braquial e no quadríceps femoral através da analise de medidas ecográficas durante as primeiras 72 horas da admissão e no quinto dia internamento e a verificação da relação entre o suporte nutricional fornecido e a perda de massa muscular, durante os cinco primeiros dias de internamento na unidade de cuidados intensivos (UCI).
Material e Métodos
Todos os procedimentos descritos neste estudo foram aprovados pela Comissão de Ética do Centro Hospitalar Universitário do Porto (CHUPorto) em Janeiro de 2020.
DESENHO DO ESTUDO E PARTICIPANTES
Trata-se de um estudo prospetivo observacional que inclui doentes que foram admitidos no Serviço de Cuidados Intensivos (SCI) do Centro Hospitalar Universitário do Porto entre Janeiro e Março de 2020.
Os critérios de inclusão foram a idade igual ou superior a 18 anos, primeira avaliação efetuada até às primeiras 72 horas de internamento no SCI e tempo de internamento superior a 5 dias. Foram excluídos indivíduos sob efeito de relaxantes neuromusculares, com doenças neuromusculares e aqueles que apresentavam alterações anatómicas consecutivas a atos cirúrgicos.
Os dados do doente foram obtidos através do registo clínico eletrónico após a admissão nos cuidados intensivos. Nestes registos sistematizaram-se informações demográficas (sexo e idade), antropométricas e dados clínicos que incluem motivo de admissão, espessura muscular por medidas ecográficas (nas primeiras 72 horas da admissão e no dia 5 de internamento), tempo de internamento no SCI, aporte nutricional diário e o score SOFA (Sequential Organ Failure Assessment) no momento da admissão, de modo a avaliar a severidade da doença e a extensão da falência de órgãos. Peso e altura foram usados para calcular Índice de massa corporal (IMC) através da fórmula: peso em quilos/altura em metros ao quadrado (kg/m2).22
AQUISIÇÃO DE IMAGEM ECOGRÁFICA
O dispositivo utilizado para a aquisição das imagens foi o Body MetrixTM BX2000 (Intela Metrix), um ecógrafo modo-A 2,5MHz. A aquisição das imagens foi feita por um único utilizador.
Os doentes estavam em posição supina, com os braços e as pernas relaxados e em extensão.23 A sonda é colocada na perpendicular em relação ao eixo corporal, sendo usada uma grande quantidade de gel de modo a melhorar o contacto e diminuir o atrito.24,25Na admissão e no quinto dia foi avaliada a espessura da massa muscular do bíceps braquial e quadríceps femoral, com três medições consecutivas, sendo o valor final a média das mesmas, de modo a permitir uma melhor estimativa da espessura muscular.23 Os dados da espessura muscular estão expressos em milímetros (mm).24
ANÁLISE DA IMAGEM ECOGRÁFICA
As imagens ecográficas foram analisadas no computador com recurso ao programa Body View ProFit. Nestas imagens, foram identificadas as interfaces tecido adiposo-músculo e músculo-osso. A distância medida entre estas duas corresponde à espessura muscular.24
SUPORTE NUTRICIONAL
Para a análise do suporte nutricional foi consultado os registos diários do doente. O cálculo das proteínas e da energia diária foi efetuada com base da composição da fórmula de nutrição artificial entérica e/ou parentética e volume administrado.
Para análise, a quantidade de energia que foi recebida está expressa em kcal/kg/dia e a de proteína em g/kg/dia. Posteriormente, procedeu-se ao cálculo do suporte nutricional ideal, tendo por base as recomendações da ASPEN.
ANÁLISE ESTATÍSTICA
Para o tratamento estatístico desta amostra utilizou-se a ferramenta SPSS versão 25.0 (SPSS Inc., na IBM Company, USA). Utilizou-se o teste Shapiro-Wilk para a avaliação da normalidade da distribuição das variáveis contínuas. Fez-se a análise descritiva das variáveis demográficas, clínicas, dos dados ecográficos e do suporte nutricional da amostra recolhida recorrendo-se a contagem e percentagens das variáveis categóricas e média ± desvio padrão (DP) nas variáveis que seguiam a distribuição normal e mediana com mínimo e máximo nas que não apresentavam uma distribuição normal. O teste-t para amostras emparelhadas foi utilizado para verificar se havia diferenças estatisticamente significativas nos valores da espessura da massa muscular no dia de admissão e no quinto dia de follow-up. Fez-se o cálculo do aporte proteico e energético em cada caso e comparou-se com o consumo recomendado destes parâmetros, tendo os resultados sido expressos em percentagem do ideal. Recorreu-se à correlação de Pearson para avaliar a existência de uma correlação entre a percentagem do consumo ideal de proteínas e energia e as medições ecográficas obtidas no bíceps e quadríceps dos doentes. Um valor de p < 0,05 foi considerado estatisticamente significativo. Todos os valores de p são bicaudais.
Resultados
DADOS DEMOGRÁFICOS E CLÍNICOS
As características clínicas e demográficas estão apresentadas na Tabela 1.
A amostra inicial era composta por 54 doentes, tendo sido excluído 19 doentes, pois 7 doentes morreram e 12 doentes não ficaram internados por um período superior a cinco dias, não sendo possível obter os dados da segunda medição.
Dos 35 doestes incluídos no estudo, 22 (62,9%) doentes são do sexo masculino. A idade média foi de 64 ± 15 anos, peso médio foi de 70,50 ± 12,55 kg. O IMC foi dividido em categorias, sendo que 45,7% dos doentes apresentavam normoponderabilidade, 34,3% Obesidade Classe I, 14,3%Obesidade Classe II e 5,7% Obesidade Classe III.
Tabela 1: Caracterização clínica e demográfica da amostra.
| Variáveis | |
|---|---|
| Sexo masculino (n, %) | 22 (62,9) |
| Idade (anos, média±DP) | 64 ± 15 |
| Peso (kg, média±DP) | 70,50 ± 12,55 |
| Altura (m, média±DP) | 1,63 ± 0,08 |
| IMC (kg/m2, média±DP) | 26,62 ± 5,16 |
| Médico (n, %) | 17(48,6) |
| Trauma (n, %) | 8 (22,9) |
| Cirúrgico urgente (n, %) | 6 (17,1) |
| Cirúrgico programado (n, %) | 4 (11,4) |
| Tempo de Internamento (dias, mediana, min-máx) | 11,00 (6-69) |
| SOFA score (média±DP) | 6 ± 3 |
ANÁLISE DA ESPESSURA DA MASSA MUSCULAR
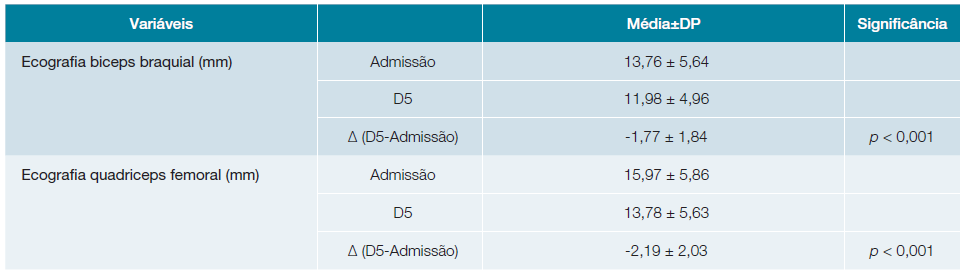
As avaliações dos dados ecográficos estão representa-dos na Tabela 2. Verificou-se uma diminuição de 1,77 mm (p <0,001) para o bíceps braquial e uma diminuição de 2,19 mm (p < 0,001) para o quadríceps femoral.
ANÁLISE DO SUPORTE NUTRICIONAL
Na Tabela 3 está representado o suporte nutricional que foi fornecido aos doentes durante o período de cinco dias de internamento.
Comparativamente aos valores das recomendações da ASPEN (1,2 g/kg/dia de proteína e 25 Kcal/kg/dia) verificou-se que nestes 5 dias de internamento os doentes receberam em média 20,00% das suas necessidades proteicas e 24,94% das suas necessidades energéticas por dia.
Tabela 3: Análise do suporte nutricional fornecido
| Recebido Média±DP | |
| Total g (prot)/kg/d | 0,240 ± 0,240 |
| Total kcal/kg/d | 6,234 ± 6,241 |
CORRELAÇÃO PELO MÉTODO DE PEARSON
Não se observou uma correlação significativa entre a variação da espessura muscular no bíceps braquial e o aporte energético (p = -0,096, p = 0,585) e o aporte proteico (p = -0,096, p = 0,585). Também não se observou uma correlação significativa entre a variação da espessura muscular do quadríceps femoral e o aporte energético (p = 0,016, p = 0,926) e O aporte proteico (p = 0,017, p = 0,924).
Discussão
O nosso estudo mostrou que é exequível avaliar ecograficamente a massa muscular do doente crítico e que houve perda significativa de massa muscular nos primeiros cinco dias de internamento, não relacionável com o suporte nutricional.
Neste estudo verificou-se que 34 dos 35 doentes sofreram uma perda da espessura muscular do bíceps braquial. Já no quadríceps femoral, 33 dos 35 doentes também sofreram uma perda da espessura muscular e em 2 doentes foi registado um ligeiro aumento da sua espessura, que podia corresponder a edema, atendendo a que a fase aguda é caracterizada por uma maior instabilidade hídrica, o que pode justificar uma maior entrada de fluidos no tecido muscular, ou até mesmo nas suas células.26
Estes resultados vão de encontro com outros estudos. Monk et al demonstrou que os doentes em estado crítico passam por um período de hipermetabolismo, sendo que neste período o catabolismo proteico é elevado. Para além disso, verificou que cerca de 2/3 do catabolismo proteico tinha origem na massa muscular. Assim, concluiu-se que esta perda de massa muscular será uma consequência inevitável do doente crítico e que pode variar de acordo com a patologia subjacente.27
Tendo por base as recomendações atuais da ASPEN, que ditam um aporte proteico de 1,2 g/kg/dia e um aporte energético de 25 kcal/kg/dia, verificou-se que nesta amostra o suporte nutricional fornecido foi consideravelmente inferior. No período inicial da doença crítica há uma série de factores que poderão justificar o atraso na implementação do alvo energético definido: instabilidade hemodinâmica, hipoxemia e acidose em agravamento, hemorragia digestiva activa, aspirado gástrico superior a 500 mL/6h, isquemia ou obstrução intestinal, síndrome de compartimento abdominal e fístula de alto débito.28
Neste estudo não se verificou uma relação entre o aporte energético e proteico e a diminuição da espessura da massa muscular, tanto no bíceps braquial como no quadríceps femoral. Na fase inicial da doença, a produção energética é maioritariamente endógena, através da neoglucogénese e catabolismo proteico.13 Em estados de elevado stress, a perda de massa muscular ocorre também de modo a fornecer precursores de aminoácidos essênciais para a síntese de proteínas de fase aguda.12
LIMITAÇÕES DO ESTUDO
Este estudo apresentou algumas limitações, nomeadamente carácter unicêntrico e dimensão reduzida da amostra, bem como a sua diversidade, tanto em dados demográficos como clínicos, e ainda o facto de se ter perdido um número importante de doentes para a segunda avaliação. Acresce que também seria importante uma análise da fluidoterapia fornecida, para tentar perceber melhor o estado hídrico do doente. Neste ponto, é importante referir que os doentes foram avaliados num período de apenas cinco dias e que seria vantajosa uma avaliação mais duradoura, tendo em conta as diversas fases metabólicas que o doente crítico passa. Importa ainda referir que a dose de nutrição administrada pode não ser a dose absorvida.
Conclusão
Neste estudo verificou-se que é possível avaliar de forma rápida, objectiva e não invasiva a massa muscular dos doentes críticos e verificou-se a perda significativa de massa muscular na fase inicial do internamento. O suporte nutricional fornecido foi consideravelmente inferior às recomendações.
Declaração de Contribuição / Contributorship Statement:
C.Vida, T. de Mendonça, R. Marinho - Conceptualização, Metodologia, Investigação, Recursos, Escrita.
D.Mano, R. Sousa - Conceptualização, Metodologia, Escrita.
M. Santos, J.P. Pinho
Conceptualização, Metodologia Escrita, Revisão e Edição