Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina Interna
versão impressa ISSN 0872-671X
Medicina Interna vol.23 no.4 Lisboa dez. 2016
CASOS CLÍNICOS / CASE REPORTS
A Sarcoma de Células Foliculares Dendríticas em Gânglio Mesentérico: A Propósito de um Caso Clínico
Follicular Dendritic Cell Sarcoma in Mesentery Lymph Node: A Case Report
Bruno Pedro1, Marina Boticário1, Vera L. Gomes1, Pedro Pereira Luís2, José Nunes Lima3, M. Filomena Roque1
1Serviço de Medicina III-B, Hospital de Santarém, Santarém, Portugal
2Serviço de Anatomia Patológica, Hospital de Santarém, Santarém, Portugal
3Serviço de Cirurgia, Hospital de Santarém, Santarém, Portugal
RESUMO
O sarcoma de células foliculares dendríticas é uma neoplasia extremamente rara, havendo pouco casos publicados. Permanecendo sub-reconhecida, os erros diagnósticos são frequentes. Considerada de potencial maligno intermédio, pode afetar gânglios linfáticos ou locais extraganglionares. Esta lesão é um desafio diagnóstico, que requer confirmação através de métodos imunohistoquímicos. O tratamento não está bem estabelecido devido à experiência clínica limitada, mas baseia-se na excisão cirúrgica. Descreve-se um caso de uma mulher de 50 anos de idade, saudável, com queixas progressivas de emagrecimento, anorexia, astenia, desconforto abdominal esquerdo e febre. O estudo complementar foi inconclusivo, até que por tomografia computorizada se identificou lesão nodular no flanco esquerdo ao nível do mesentério. Foi submetida a biópsia aspirativa insatisfatória, tendo-se optado por ressecção cirúrgica radical do tumor. O estudo histopatológico revelou neoplasia de células fusiformes, com acentuado pleomorfismo e abundantes figuras de mitoses, e o estudo imunohistoquímico permitiu chegar ao diagnóstico final.
Palavras-chave: Gânglio Linfático; Imunohistoquímica; Sarcoma de Células Foliculares Dendríticas.
ABSTRACT
Follicular dendritic cell sarcoma is an extremely rare neoplasm, with only few published cases. Remaining under-recognized, misdiagnosis is common. Considered of intermediate malignant potential, it can involve lymph nodes or extranodal sites. This tumor is a diagnostic challenge that requires confirmation through immunohistochemical methods. The treatment is not well established due to limited clinical experience, but is based on surgical excision. We describe a case of a 50-year-old-woman, previously healthy, with gradual complaints of weight loss, anorexia, asthenia, left abdominal pain and fever. The complementary study was inconclusive, until computed tomographic scan showed a nodular lesion on the left flank at the level of the mesentery. She was submitted to an aspiration biopsy with unsatisfactory results so the patient underwent successful surgical excision of the tumor. Histopathological examination revealed neoplasm composed of spindled cells, with marked pleomorphism and numerous mitotic figures and immunohistochemical study allowed the final diagnosis.
Keywords: Lymph Nodes; Immunohistochemistry; Follicular Dendritic Cells Sarcoma.
Introdução
O sarcoma de células foliculares dendríticas (SCFD) é uma proliferação neoplásica rara de células foliculares dendríticas (CFDs).1 Origina-se a partir de CFDs do tecido linfóide e afeta principalmente gânglios linfáticos, mas também pode surgir em locais extraganglionares. As CFDs neoplásicas exibem o mesmo perfil morfológico e imunofenotípico das CFDs não-neoplásicas que residem normalmente nos centros germinativos.2
As características clínicas e patológicas do SCFD continuam pouco conhecidas, principalmente devido ao número limitado de casos relatados na literatura.3-6
Os autores apresentam um caso deste tumor raro num gânglio linfático mesentério, discutindo o seu diagnóstico e tratamento.
Caso Clínico
Doente do sexo feminino, de 50 anos de idade, casada, sem antecedentes relevantes ou medicação habitual.
Referenciada ao Serviço de Urgência por queixas gradativas de perda ponderal (não quantificada), anorexia, astenia,vago desconforto abdominal esquerdo e febre, com cerca de 2 meses de evolução. Sem outra sintomatologia.
Ao exame objetivo destacava-se bom estado geral, mas magreza, discreta palidez mucocutânea, febrícula (37,7ºC) e abdómen discretamente doloroso à palpação nos quadrantes esquerdos, mas sem defesa e sem massas ou organomegalias palpáveis. Não eram evidentes adenopatias periféricas.
Analiticamente apresentava anemia (Hb 9,4 g/dL), leucocitose (leucócitos 11900/uL com fórmula leucocitária normal), trombocitose (plaquetas 624000/uL) e proteína C reativa (PCR) 20,98 mg/dL. As radiografias do tórax e abdómen, e o estudo ultrassonográfico abdominal e pélvico não mostravam alterações.
Foi decidido internamento no Serviço de Medicina para estudo etiológico.
Nas avaliações analíticas seriadas manteve as alterações no hemograma e velocidade de sedimentação e PCR persistentemente elevadas; as enzimas hepatocolestáticas, LDH, electroforese das proteínas séricas, eritropoetina, enzima conversora da angiotensina e marcadores tumorais (ß2-microglobulina, alfa-fetoproteína, CEA, CA15-3, CA19-9 e CA125), entre outros parâmetros, estavam dentro dos valores de referência normais.
Todos os estudos microbiológicos, assim como as serologias virais e o estudo de autoimunidade foram negativos.
O mielograma revelou celularidade normal e alterações reativas inespecíficas.
Realizou tomografia computorizada (TC) toraco-abdominopélvica que revelou formação nodular no flanco esquerdo, ao nível mesentérico, com 4,6 x 3,5 x 4,0 cm, com aspeto heterogéneo Fig. 1 e Fig. 2.
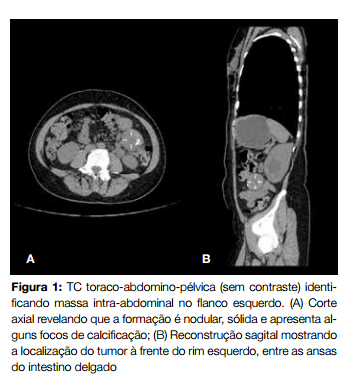
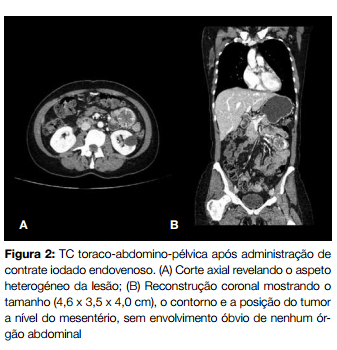
No seguimento do estudo procedeu-se a biópsia com agulha fina dirigida por TC que se mostrou inconclusiva.
Realizou ainda endoscopia digestiva alta e colonoscopia que não mostraram alterações relevantes.
Discutido o caso em consulta de decisão terapêutica multidisciplinar, foi decidida ressecção cirúrgica radical do tumor, que veio a ser efetuada com sucesso.
No exame macroscópico da peça cirúrgica identificou-se, no mesentério a 7,5 cm e 3 cm das margens longitudinais, livre da parede jejunal, a presença de tumor nodular com 6 x 5,5 cm, bem delimitado, com superfície de secção de cor branca com ponteado hemorrágico e áreas calcificadas, localizado a 0,8 cm da margem de ressecção radical Fig. 3.
Histologicamente, na dependência de gânglio linfático, identificou-se neoplasia maligna de padrão sólido, com áreas fasciculares de padrão vagamente estoriforme, constituída por células ovóides e fusocelulares, com núcleos ovais ou alongados com cromatina vesicular, com pequeno nucléolo, marcado pleomorfismo nuclear com multinucleações e células bizarras, com extensas áreas de necrose (25%) e 2-3 mitoses/ campo de grande ampliação, com mitoses atípicas Fig. 4.
No estudo imunocitoquímico as células neoplásicas foram positivas para CD21, CD23, vimentina e podoplanina (D240), e foram negativas para CD45, CD20, CD79a, CD2, CD3, CD30, ALK, CD117, DOG1, CD34, CD68, actina-ml, desmina, caldesmona, pS100, CD10, Cam 5.2, calponina e EMA Fig. 5.
Os restantes gânglios linfáticos isolados na peça (13) mostravam apenas alterações reativas inespecíficas.
Perante estes achados morfológicos e imunohistoquímicos foi estabelecido o diagnóstico de SCFD.
A paciente teve um período pós-operatório curto e recuperou bem, com normalização das alterações laboratoriais.
Foi encaminhada para acompanhamento no Instituto Português de Oncologia, não tendo efetuado outros tratamentos até ao momento. Mantém também seguimento em consulta de Medicina Interna e, atualmente, com mais de um ano de follow-up, a doente está assintomática, sem alterações analíticas e sem evidência de doença.
Discussão
As CFDs são células imunitárias acessórias, não-linfóides e não-fagocíticas, que desempenham um papel essencial na apresentação de antigénios às células B e na regulação das reações nos centros germinativos. Estão presentes em órgãos linfóides e não-linfóides.2,7
A proliferação de CFDs pode ocorrer em várias condições benignas reativas ou em lesões neoplásicas.2
A neoplasia primária de CFDs foi descrita pela primeira vez em 1986 por Monda et al.8 Os sarcomas de células foliculares dendríticas (SCFDs) são neoplasias raras que mostram um grau de malignidade intermédio.1,3 Existem pouco casos reportados na literatura pelo que as suas características clínicas e patológicas continuam pouco conhecidas, sendo possível que numerosos casos sejam confundidos com outros tumores na avaliação inicial.3-5
O SCFD afeta ambos os sexos sem predileção, e os pacientes têm uma ampla variação etária, mas com predomínio em adultos.2,9
Embora a etiologia do SCFD seja desconhecida, tem sido descrita associação com a doença de Castleman1,2 e com o vírus Epstein-Barr.10
Pode ter uma localização ganglionar ou extraganglionar, sendo mais frequente a primeira. O envolvimento ganglionar é observado em quase dois terços dos casos, sendo os gânglios cervicais os mais atingidos, seguidos dos gânglios axilares, supraclaviculares, mediastínicos, mesentéricos e retroperitoneais.1 Entre as localizações extraganglionares mais comummente envolvidas surgem as amígdalas palatinas, cavidade oral, parótidas, tiróide, baço, fígado, trato gastrointestinal, pulmão, tecidos moles, pele e mama.1,5,6,11,12
A maioria dos pacientes apresenta doença localizada no momento de diagnóstico, no entanto tem sido descrita metastização em cerca de 25% dos casos, sendo que esta mais frequentemente se faz para gânglios regionais, pulmão e fígado.3,5
Clinicamente tem um curso variável, geralmente com um prognóstico favorável, apresentando-se como uma massa indolor, bem delimitada e de crescimento lento. Os sintomas sistémicos são geralmente raros,9 embora os pacientes com doença abdominal possam apresentar dor/desconforto abdominal, febre e emagrecimento,11 como ocorreu na nossa doente.
O diagnóstico de SCFD é estabelecido com base nos achados morfológicos e imunohistoquímicos.1,3-5
Macroscopicamente as lesões variam de 1 a 20 cm, dependendo o tamanho da localização. Os tumores mais pequenos têm sido descritos em gânglios, e os maiores em massas tumorais intra-abdominais ou mediastínicas.4 São lesões sólidas que ao corte apresentam uma coloração castanho-acinzentada e podem encontrar-se áreas calcificadas ou hemorrágicas.4,11
Microscopicamente, esta neoplasia é composta por células fusiformes ou ovais dispostas num arranjo estoriforme ou em remoinho. As células tumorais têm abundante citoplasma e o sinofílico, em parte fibrilhar, e ocasionalmente, principalmente em tumores recorrentes, observa-se acentuado pleomorfismo nuclear, figuras mitóticas atípicas e áreas de necrose.3,5,13
O padrão imunohistoquímico é essencial para o diagnóstico e permite fazer o diagnóstico diferencial com outras entidades, nomeadamente lesões fusocelulares, linfomas, miofibroblastoma em paliçada, tumor do estroma gastrointestinal (GIST) e metástase ganglionar de um sarcoma, melanoma ou carcinoma sarcomatóide.1,4,12
As células neoplásicas têm imunofenotipo idêntico ao das CFDs normais, sendo os recetores CD21, CD23 e/ou CD35 os marcadores imunohistoquímicos mais específicos.1Os SCFDs expressam pelo menos um destes marcadores e a maioria dos casos expressa dois ou mais, sendo a imunomarcação habitualmente focal, mas podendo ser difusa.9,13 Este perfil é também importante na diferenciação entre o SCFD e os sarcomas originados de outras células dendríticas: os sarcomas de células de Langerhans são negativos para CD21 e CD23 e positivos para pS100, apresentando, por microscopia eletrónica, grânulos de Birbeck; os sarcomas de células dendríticas interdigitantes são negativos para CD21 e CD23 e expressam CD68.
As células neoplásicas do SCFD podem também ser positivas para desmoplaquina, vimentina, fascina e HLA-DR, e raramente para pS100 e EMA. São habitualmente negativas para CD20, CD1a, lisosima, mieloperoxidase, CD34, CD3, CD79a, CD30, HMB45, desmina, CD117 e citoqueratinas.7,9,13
No presente caso, os achados histológicos e imunocitoquímicos foram consistentes com os mencionados acima e permitiram chegar ao diagnóstico final de SCFD.
Na doente apresentada os exames laboratoriais mostraram alterações hemato-inflamatórias inespecíficas que, eventualmente, poderão ter estado relacionadas com uma atividade anormal das CFDs em proliferação e/ou com a extensa necrose tumoral, como é sugerido pela sua regularização no pós-operatório, destacando-se também o desaparecimento da febre e da anemia.
Embora a modalidade terapêutica ideal para o SCFD ainda não esteja bem definida devido à raridade da condição, as guidelines atuais remetem para a abordagem terapêutica utilizada para os sarcomas de tecidos moles de alto grau, incluindo a ressecção radical com ou sem quimioterapia e/ou radioterapia.5
A cirurgia continua a ser a base do tratamento para a doença localizada, e o benefício da terapia adjuvante permanece controverso.3,5 A quimioterapia sistémica tem sido reservada para pacientes com doença metastática e/ou depois de uma falência do tratamento primário.10
No caso aqui apresentado o tumor foi eficazmente tratado por cirurgia, com documentação de margens cirúrgicas livres de tumor, sem necessidade de radioterapia ou quimioterapia após a sua excisão radical.
Embora a maioria dos pacientes responda bem ao tratamento inicial, têm sido reportadas recidivas locais em 40 a 50% dos casos, e uma taxa de mortalidade de 10 a 20%,3-5 sendo recomendado o seguimento clínico prolongado num centro oncológico, como fizemos com a nossa paciente.
Em conclusão, os SCFDs são neoplasias malignas extremamente raras e, devido à escassez de casos relatados na literatura, são provavelmente sub-reconhecidas e comummente mal diagnosticadas. Com o desenvolvimento dos métodos imunohistoquímicos a precisão diagnóstica tem melhorado. Portanto, quando há suspeita histológica, deve realizar-se imunohistoquímica para SCFD por forma a evitar possíveis erros de diagnóstico.
Referências
1. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Geneva: WHO/IARC Press; 2008. [ Links ]
2. Weiss LM, Chang KL. Histiocytic and dendritic cell proliferations. In: Weiss LM,editor. Pathology of lymph nodes. New York: Churchill Livingstone Inc; 1996. p.413-6. [ Links ]
3. Chan JK, Fletcher CD, Nayler SJ, Cooper K. Follicular dendritic cell sarcoma - Clinicopathologic analysis of 17 cases suggesting a malignant potential higher than currently recognized. Cancer. 1997;79:294-313. [ Links ]
4. Perez-Ordonez B, Erlandson RA, Rosai J. Follicular dendritic cell tumor: Report of 13 additional cases of a distinctive entity. Am J Surg Pathol. 1996;20:944-55. [ Links ]
5. Shia J, Chen W, Tang LH, Carlson DL, Qin J, Guillem JG, et al. Extranodal follicular dendritic cell sarcoma: Clinical, pathologic and histogenetic characteristics of an underrecognized disease entity. Virchows Arch. 2006;449:148-58. [ Links ]
6. Li Z, Jin K, Yu X, Teng X, Zhou H, Wang Y, et al. Extranodal follicular dendritic cell sarcoma in mesentery: A case report. Oncol Lett. 2011;2:64952. [ Links ]
7. Fonseca R, Yamakawa M, Nakamura S, van Heerde P, Miettinen M, Shek TW, et al. Follicular dendritic cell sarcoma and interdigitating reticulum cell sarcoma: A Review. Am J Hematol. 1998;59:161-7. [ Links ]
8. Monda L, Warnke R, Rosai J. A primary lymph node malignancy with features suggestive of dendritic reticulum cell differentiation - A report of 4 cases. Am J Pathol. 1986;122:562-72. [ Links ]
9. Pileri SA, Grogan TM, Harris NL, Banks P, Campo E, Chan JK, et al. Tumours of histiocytes and accessory dendritic cells: An immunohistochemical approach to classification from the International Lymphoma Study Group based on 61 cases. Histopatology. 2002;41:1-29. [ Links ]
10. Choi BS, Baek JH, Shin YM, Kim JH, Kim HW, Lee SJ, et al. Follicular dendritic cell sarcoma: A case report and review of the literature. Cancer Res Treat. 2010;42:121-4. [ Links ]
11. Wang J, Kong Y, Lu H, Xu Y. Two cases of extranodal follicular dendritic cell sarcoma. Chin Med J. 2003;116:794-7. [ Links ]
12. Chang KC, Jin YT, Chen FF, Su IJ. Follicular dendritic cell sarcoma of the colon mimicking stromal tumour. Histopathology. 2001;38:25-9. [ Links ]
13. Chang KL, Weiss LM. Other histiocytic and dendritic cell neoplasms. In: Jaffe, ES, Harry NL, Vardiman JW, Campo E, Arber DA,editors. Hematopathology. 1st ed. Amsterdam: Elsevier Saunders; 2011. p.829-33. [ Links ]
Correspondência: Bruno Pedro brunpedr@gmail.com
Serviço de Medicina III-B, Hospital de Santarém, EPE, Santarém, Portugal
Protecção de Seres Humanos e Animais: Os autores declaram que não foram realizadas experiências em seres humanos ou animais
Direito à Privacidade e Consentimento Informado: Os autores declaram que nenhum dado que permita a identificação do doente aparece neste artigo.
Conflitos de Interesse: Os autores declaram a inexistência de conflitos de interesse na realização do presente trabalho
Fontes de Financiamento: Não existiram fontes externas de financiamento para a realização deste artigo
Recebido: 25/08/2016
Aceite: 04/10/2016