INTRODUÇÃO E EPIDEMIOLOGIA
As reações cutâneas a fármacos são eventos adversos muito frequentes com uma incidência reportada de 1-8% para alguns grupos de fármacos, entre os quais se destacam os antibióticos e os anti-inflamatórios não esteroides (AINE) 1-6.
Em doentes hospitalizados a incidência das reações cutâneas é de 2 a 8 %, no entanto a maioria das reações são ligeiras com um predomínio do exantema maculopapular e de urticária 6-11.
O eritema pigmentado fixo (EPF) é frequentemente reportado em estudos de reações cutâneas a fármacos de países asiáticos e africanos, representando até 22% das reações cutâneas descritas, sendo menos frequente nos estudos europeus 2,3,8-15.
A lista de fármacos que podem causar EPF é extensa, entre os mais vezes implicados encontram-se os antibióticos (sulfamidas, nitroimidazois, fluoroquinolonas e tetraciclinas) e os AINE, sendo de realçar o paracetamol, salicilatos, piroxicam e o ácido mefenâmico16-27.
Num estudo realizado em Singapura, os AINE foram identificados como responsáveis em metade dos casos de EPF, sendo o etoricoxibe implicado em 38% dos casos detetados 24. Também num trabalho retrospetivo tunisino em que foram englobados 41 casos recolhidos ao longo de 14 anos, os AINE representaram 51% dos casos, seguidos dos antibióticos em 24% e analgésicos em 19% 21. No que respeita aos AINE, neste estudo, os mais comummente implicados foram o ácido mefenâmico (24%), seguido do piroxicam (22%) e do paracetamol (17%) 21.
Em Portugal numa série de 52 doentes os AINEs (nimesulide, piroxicam e etoricoxibe) foram os fármacos suspeitos em 90% dos casos e os antibióticos implicados em 29% das reações 28.
Em contrapartida, noutras séries, os AINE representam apenas uma minoria dos casos reportados, havendo um claro predomínio dos antibióticos, como acontece na maior série publicada englobando 450 casos de EPF 20.
Esta variabilidade poderá estar associada a eventuais fatores genéticos, mas será sobretudo afetada pelos padrões de prescrição. Há, no entanto, um provável declínio dos casos associados a antibióticos tradicionalmente relacionados, como o cotrimoxazol, por decréscimo do seu uso, e um aumento de casos associados a AINE. Tal é ilustrado num estudo retrospetivo recente que incluiu 191 doentes com EPF em que o cotrimoxazol foi o fármaco mais vezes implicado (79 casos), mas com decréscimo acentuado ao longo dos anos estudados, seguido do naproxeno com aumento progressivo de casos detetados (67 casos), do ornidazol/metronidazol (10 casos), piroxicam/tenoxicam (9 casos), dipirona (9 casos), etodolac (5 casos) e paracetamol (3 casos) 14,25.
O EPF pode raramente surgir associado à exposição solar ou à ingestão de certos alimentos, como os frutos secos 29,30.
O EPF pode surgir em qualquer idade, mesmo na infância, tendo uma maior frequência entre adultos jovens 11. Não se demonstra, na maior parte dos estudos, um predomínio do género feminino, ao contrário de outras reações de hipersensibilidade a fármacos 10,11,18,20,21.
Como em outros tipos de reações de hipersensibilidade retardada por fármacos, também no caso da EPF foi possível estabelecer a associação com certos haplótipos HLA e fármacos específicos, sendo exemplo o HLA-B22 com AINE como a feprazona e o HLA-A30 com o cotrimoxazol31,32.
ASPETOS CLÍNICOS E PATOFISIOLOGIA
O EPF manifesta-se entre dois dias a uma semana após a exposição inicial ao fármaco e no caso de reexposição pode reaparecer 30 minutos a 8 horas após o contacto 33. Em alguns casos, devido ao período refratário, algumas reexposições poderão não estar associadas ao reaparecimento de lesões 33,34.
Tendo em conta a apresentação clínica e morfologia das lesões o EPF poderá classificar-se em localizado pigmentado (o mais comum), localizado bolhoso, o não pigmentado, o EPF generalizado e o EPF bolhoso generalizado (apresentação rara a necessitar de diagnóstico diferencial com síndrome de Stevens-Johnson (SSJ) e necrólise epidérmica tóxica (NET) 16-22,33-35.
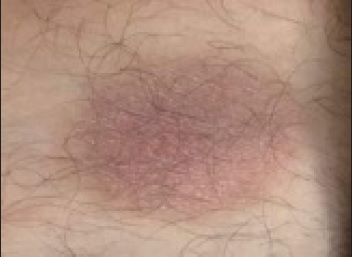
Mais frequentemente o EPF apresenta-se como lesões maculares ou em placa arredondadas/ovaladas, bem circunscritas e de coloração avermelhada/violácea na pele ou nas mucosas, como o apresentado na Figura 1 16-22.
As suas dimensões variam, podendo atingir os 10 mm de diâmetro 36. Alguns doentes poderão referir dor, prurido e sensação de queimadura no local das lesões (36). Poderá apenas surgir uma lesão, sendo um EPF localizado, ou se surgirem várias será um EPF generalizado 54.
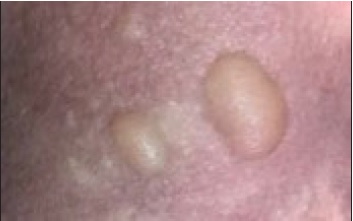
Raramente, sobreposta à lesão macular poderá existir a formação de bolha, dando origem à variante EPF bolhoso, como o apresentado na Figura 2 que, caso se estenda para além de três áreas corporais (cabeça, pescoço, tronco, membros superiores, membros inferiores e genitais), se classifica como EPF bolhoso generalizado34,35.
Em casos de envolvimento cutâneo mais extenso podem também surgir outras queixas, como febre, náusea, mal-estar geral, artralgias, dor abdominal, diarreia e disúria19-21,33.
Após o episódio agudo a maior parte das lesões resolve, deixando uma hiperpigmentação residual pós inflamatória que poderá durar entre semanas a meses33,34,36. No EPF não pigmentado esta característica não se verifica, existindo uma resolução da lesão em 2- 3 semanas sem hiperpigmentação residual 33.
O EPF pode ocorrer em qualquer região da pele e/ou mucosas 26. As localizações mais comuns das lesões são os membros superiores e lábios 26,27. É, também, frequente o envolvimento de regiões da pele com menor espessura, como a região genital e perianal, e regiões previamente fragilizadas por trauma, picada de inseto ou outro tipo de lesões cutâneas 26,27.
No caso dos AINE, parece que este padrão também se verifica, sendo que numa série de casos 67% dos doentes apresentaram lesões nos membros superiores e lábios 26,27.
Alguns autores sugerem a possibilidade de associação entre o fármaco causador e a presença de lesões em localização ou com morfologia específicas, nomeadamente a implicação do naproxeno em reações com aparecimento de lesões da mucosa labial e do paracetamol no aparecimento de lesões bolhosas Figura 3 26-28.
O EPF é uma manifestação de hipersensibilidade retardada tipo IV em que as células T CD8+ epidérmicas têm um papel fundamental na patogenia das lesões 37.
Nas primeiras horas após exposição sistémica ao fármaco ocorre ativação das células T CD8+ e são libertados mediadores citotóxicos que promovem lesão local 37-39.
Numa fase mais tardia existe o recrutamento de células T CD4+ e de neutrófilos que amplificam a resposta inflamatória39.
Após descontinuação do fármaco implicado inicia-se um processo de reconstrução tecidular, sendo que a fagocitose da melanina por parte dos macrófagos dérmicos nos locais das lesões explica o aparecimento de manchas residuais hiperpigmentadas que se podem manter durante vários dias/semanas 40. Durante a regeneração dos queratinócitos é libertada IL-15 que leva à formação de células T CD8+ de memória implicadas na recorrência das lesões aquando nova exposição ao fármaco implicado40.
INVESTIGAÇÃO DIAGNÓSTICA
As características das lesões, a associação temporal das mesmas com a administração de fármacos AINE e os episódios recorrentes aquando de reexposição a AINE tornam o diagnóstico de EPF provável, devendo o mesmo ser confirmado usando meios complementares de diagnóstico e após exclusão de outros diagnósticos possíveis16,17,33.
As lesões de EPF podem assemelhar-me a outras patologias cutâneas, pelo que na observação de um doente será necessário ter em conta vários diagnósticos diferenciais.
Para diferenciação é importante uma caracterização minuciosa da história clínica, descrição da morfologia e extensão das lesões e avaliar a presença de queixas sistémicas15,16,21,33,36.
De acordo com a manifestação clínica do EPF, a Tabela 1 apresenta os diagnósticos diferenciais mais comuns.
Tabela 1 Diagnósticos diferencias do EPF
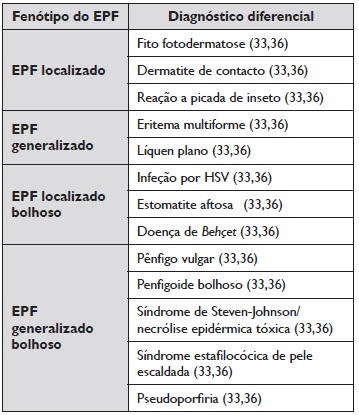
Nota: Esta tabela foi criada pelos autores tendo em conta a informação disponível nas diferentes referências identificadas
Testes epicutâneos
Na investigação de reações cutâneas tardias, a realização dos testes epicutâneos deve ser sempre ponderada tendo em conta a facilidade, rapidez e segurança da sua execução 21,22,41-46.
Estes testes consistem na aplicação do alergénio suspeito em oclusão na pele, segundo condições padronizadas44-46. O teste deverá ser efetuado no mínimo 4 semanas e idealmente até 1 ano após o episódio agudo 46.
No eritema pigmentado fixo, por norma utiliza-se o fármaco suspeito na sua formulação em pó, dissolvido em vaselina 47,48. As concentrações utilizadas variam de acordo com o fármaco implicado, sendo as mais usuais 10%, mas que podem variar entre 1%-20% 45,46. As concentrações mais comuns em uso, reportadas na literatura consultada, para os testes epicutâneos com AINE estão compilados na Tabela 2. Alguns autores utilizam também fármacos quimicamente semelhantes, para avaliar a presença de reatividade cruzada, embora a sua realização dependa do número e tamanho das lesões hiperpigmentadas residuais 47-51. Na literatura, relativamente aos AINE, estão descritos casos de reatividade cruzada entre piroxicam com tenoxicam e meloxicam e ácido mefenâmico com diclofenac, embora os últimos pertençam a classes de fármacos quimicamente distintas42,51,52.
Tabela 2 Concentrações recomendadas para testes epicutâneos com AINE
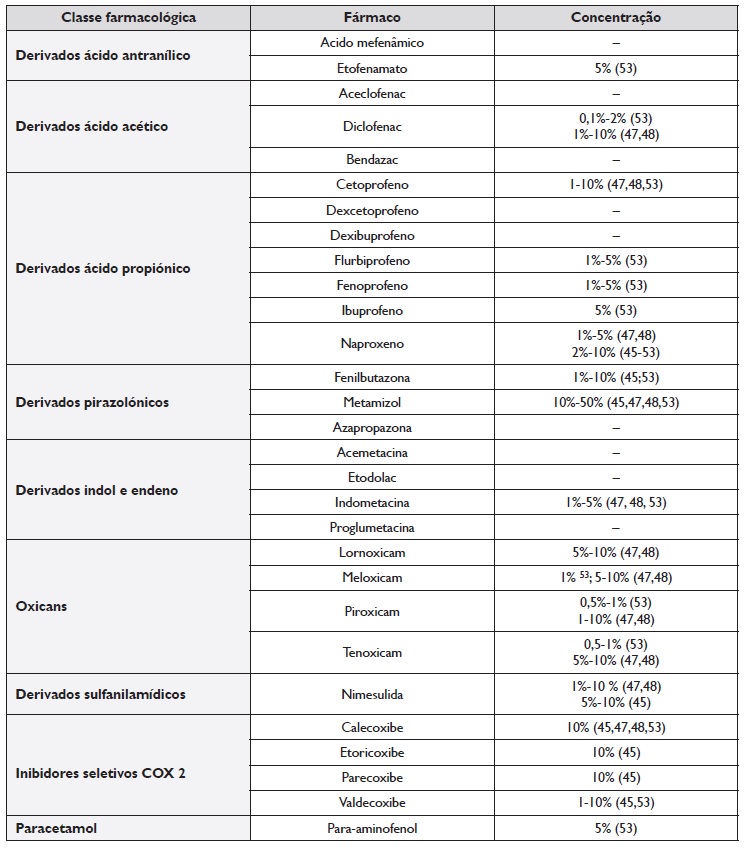
Nota: Esta tabela foi criada pelos autores tendo em conta a informação disponível nas diferentes referências identificadas
Biópsia cutânea
A biópsia da lesão cutânea como meio de diagnóstico está indicada em casos que suscitem dúvida diagnóstica. Histologicamente está descrito atingimento da epiderme e das camadas superiores da derme, nomeadamente degeneração da camada basal epidérmica, espongiose, necrose dos queratinócitos, degeneração pigmentar e infiltrado perivascular linfocítico/eosinofílico, sendo estes achados compatíveis com o diagnóstico, mas não patognomónicos 29,39,52.
A aplicação do teste epicutâneo deverá ser feita na lesão hiperpigmentada residual e no dorso, em região de pele não envolvida na reação, funcionando como um controlo44-46.
A leitura dos testes deverá ser efetuada às 48h, 72h e por vezes aos 7 dias 44-46. A interpretação de resultados deverá ser efetuada segundo as guidelines do grupo de investigação em dermatite de contacto, sendo consideradas positivas se existe eritema infiltrativo da lesão hiperpigmentada 44.
Os testes epicutâneos no EFP apresentam uma sensibilidade de 40-60%, mas um resultado negativo não excluiu o diagnóstico 47,48. Os falsos negativos podem estar associados a fraca penetração do fármaco na pele ou à necessidade de o fármaco ser metabolizado 44-46.
Prova de provocação oral
A realização de prova de provocação oral (PPO) com o fármaco implicado é o gold standard para estabelecimento do diagnóstico e poderá ser proposta nos casos em que o teste epicutâneo seja negativo 52,53. A sua realização deverá ser ponderada caso a caso, estando contraindicada nos casos de eritema pigmentado fixo generalizado bolhoso pelo risco de progressão das lesões para quadros clínicos mais graves com eventual risco vital 52,53.
A execução da PPO como teste de diagnóstico deverá ser feita pelo menos quatro semanas após a última reação e consiste na administração gradual do fármaco suspeito 33.
Existem diversos protocolos em uso, não havendo guidelines consensuais. Alguns autores defendem PPO com duração de um dia com doses sucessivamente crescentes de 25% a 100% da dose recomendada e outros defendem administração de 25% da dose recomendada num primeiro dia, e na ausência de reação, progredir nos dois dias seguintes para 100% da dose recomendada 33,52.
A prova é considerada positiva se existir recrudescimento das lesões hiperpigmentadas ou início de novas lesões nas 24h subsequentes à PPO 33,52.
Estudos laboratoriais
A utilidade diagnóstica da execução de testes laboratoriais para o diagnóstico de EFP, nomeadamente o teste de transformação linfocitária (TTL) e o teste de libertação de interferão gama, continuam a estar em discussão, já que os resultados encontrados são contraditórios 54-56.
Estes testes não se encontram ainda validados e na literatura existem apenas resultados referentes a casos clínicos individuais 54-56.
Nos raros casos clínicos referentes à utilidade do TTL no diagnóstico de EPF causado por fármacos, apenas dois envolvem AINE 54,55. Em ambos os casos, EPF generalizado e eritema fixo não pigmentado associados a etoricoxibe e paracetamol, respetivamente o TTL demonstrou resultados positivos para os fármacos testados, mas, como referido este resultado não foi corroborado com o recurso a outra técnica de diagnóstico 54,55. Kaplan e associados decidiram avaliar e comparar o uso de testes epicutâneos com a avaliação da libertação de interferão gama em doentes com suspeita de reações cutâneas de hipersensibilidade a fármacos. Foram incluídos um total de 51 doentes, 4 doentes com EPF 56. Em todos os doentes os testes epicutâneos foram negativos e apenas 15,6% apresentaram resultados positivos para o ensaio de libertação de interferão gama, sendo que a probabilidade de resultados positivos foi superior nos doentes com EPF 56.
Os testes identificados, no futuro poderão revelar-se de particular interesse na investigação do EPF, em especial nas formas bolhosas; neste momento carecem ainda da necessidade de validação.
TRATAMENTO E ORIENTAÇÃO
O tratamento adequado das lesões depende da apresentação e extensão das mesmas. Em todos os doentes está recomendada a descontinuação imediata do fármaco suspeito pela possibilidade do aparecimento de novas lesões ou apresentação generalizada de maior gravidade33,34,36,52. Em algumas séries de casos em que foi utilizada prova de provocação oral para diagnóstico do EPF, após a reexposição, alguns doentes desenvolveram novas lesões em outras localizações e, por vezes, desenvolveram EPF bolhoso 21,23, no entanto os dados existentes não permitem quantificar de forma exata o risco associado a uma nova reexposição.
Os EPF localizados normalmente são uma entidade benigna e autolimitada. Nestes casos, para o tratamento de lesões poderão ser utilizados corticoides tópicos. Nas lesões localizadas bolhosas, se existir perda da integridade cutânea e consequentemente ulceração, poderão ser utilizadas compressas humedecidas para promover a reepitilização33,34,36,52.
Os EPF generalizados podem ser ameaçadores de vida, com uma taxa de mortalidade que pode atingir os 20%34. Estes doentes, dado a perda de integridade cutânea, risco de instabilidade hemodinâmica e risco infecioso, deverão ser internados em unidades de cuidados intensivos ou em unidades especializadas em tratamento de queimados, como nos casos de SSJ/ NET 34,35. No caso particular do EPF generalizado bolhoso poderá ser necessário tratamento sistémico com corticoide e, em alguns casos, o uso de ciclosporina apresentou efeitos benéficos 34,35. Nos locais de lesão poderão ser aplicadas compressas com soluções antisséticas (36). Adicionalmente, uma vez que os doentes poderão apresentar-se com hipovolemia, distúrbios hidroeletrolíticos e perda da regulação da temperatura corporal, deverão ser mantidos cuidados gerais de suporte: fluidoterapia, manutenção da temperatura ambiente entre 25°C e 30°C, aporte dietético adequado e controlo da dor 36.
Após resolução da fase aguda, o doente deverá ser reencaminhado à consulta de Imunoalergologia para estudo diagnóstico e investigação de alternativa terapêutica segura 9,11,53. Até conclusão do estudo é recomendada evicção de todos os AINE pelo risco de reatividade cruzada entre substâncias quimicamente semelhantes 34,36,53.
Neste processo, para o EPF não existem protocolos consensuais. Numa primeira abordagem, poderão ser utilizados os testes epicutâneos aplicados no local das lesões remanescentes, já tendo sido identificada reatividade cruzada entre fármacos do mesmo grupo, como o piroxicam e o meloxicam, mas também entre entre fármacos de classes distintas mas com estrutura semelhante 42,47,48.
Os testes epicutâneos podem também ser realizados com fármacos alternativos, mas o gold standard será a execução da prova de provocação oral, sendo recomendado o uso de AINE quimicamente diferentes do implicado, de preferência após resultado negativo nos testes epicutâneos 53.
O conhecimento da possibilidade de reatividade cruzada é importante para o correto aconselhamento dos doentes, de forma a evitar recorrência 53.
CONCLUSÃO
O EPF é uma manifestação comum de reação de hipersensibilidade a fármacos, nomeadamente AINE. O diagnóstico é fundamentalmente clínico, sendo que no caso dos AINE além das lesões pigmentadas fixas clássicas localizadas nas extremidades, poderá existir também o aparecimento de lesões bolhosas e envolvimento das mucosas. O tratamento deve ter em conta o tipo de lesões e a sua extensão, não esquecendo que no caso de EPF bolhoso generalizado existe associada uma taxa de mortalidade relevante.
O envio dos doentes à consulta de Imunoalergologia é fundamental para execução de procedimentos de diagnóstico, como testes epicutâneos e testes de provocação, de forma a estabelecer um diagnóstico e aconselhamento de fármaco alternativo para utilização futura.