INTRODUÇÃO
Em 1979, Maulitz et al descreveu o primeiro caso de anafilaxia em contexto de alergia alimentar dependente de exercício 1. A designação “anafilaxia induzida pelo exercício e dependente de alimentos”, em inglês food‑dependent, exercised‑induced anaphylaxis (FDEIA), surgiu anos mais tarde para descrever formas graves de alergia relacionadas com a ingestão de um alimento específico nas duas horas que precedem ou sucedem atividade física 2. Na literatura, são vários os alimentos envolvidos na FDEIA, sendo a “anafilaxia induzida pelo exercício dependente de trigo”, em inglês wheat‑dependent, exercise‑induced anaphylaxis (WDEIA), a síndrome melhor caracterizada 3,4,5,6.
A designação atualmente aceite, Alergia alimentar exacerbada por cofator ou em inglês Co‑factor enhanced food allergy (CEFA), engloba as várias manifestações de alergia alimentar e não apenas a anafilaxia que são dependentes ou amplificadas na presença de determinadas circunstâncias (cofatores) 5,6.
Os cofatores podem ser definidos como circunstâncias do próprio doente ou externas a este, que se associam a maior gravidade das reações alérgicas ou diminuição do limiar de tolerância do doente ao alergénio (doses mais baixas do alergénio podem causar reações alérgicas 2‑6 vezes mais graves na presença de cofatores, dependendo das séries) 3,4,7,8. O exercício foi dos primeiros cofatores identificados e é o principal em todas as faixas etárias 3,4.
Contudo, outros cofatores foram identificados; em adultos, salientam‑se os fármacos (principalmente anti‑inflamatórios não esteroides [AINE]) e o álcool, e em crianças as intercorrências infeciosas. O stress, a menstruação e condições climáticas extremas (frio e/ou calor) estão também descritos como cofatores de reações alérgicas a alimentos 9.
A prevalência da CEFA varia entre estudos; em algumas séries, até 58% das anafilaxias a alimentos têm cofatores associados, e aproximadamente 30% das anafilaxias em adultos têm cofatores, comparativamente a 14%‑18,3% das anafilaxias em idade pediátrica 3,4,5,6. Existe evidência limitada sobre os mecanismos imunes subjacentes aos cofatores nas reações alérgicas a alimentos 2,3,4,9,10. No geral, os cofatores parecem ser responsáveis por aumentar a absorção intestinal do alergénio e diminuir o limiar de resposta imune. Vários mecanismos foram propostos, mas a evidência que suporta cada um deles é limitada pelo baixo número de doentes avaliados e pela qualidade dos estudos 9.
A já mencionada WDEIA é a forma de CEFA mais bem descrita, sendo o trigo o alimento envolvido. Este é um dos cinco alimentos mais comuns a desencadear reações alérgicas em crianças. Já nos adultos a alergia a trigo é particularmente prevalente em países asiáticos, como o Japão 11. Desconhece‑se contudo a prevalência desta alergia em adultos de populações europeias e a maioria dos dados relativos a esta patologia é fornecida pelo estudo inglês de Kennard et al 12. Nos adolescentes e adultos prevalecem as formas mais graves de alergia, podendo ocorrer sintomas de anafilaxia em 40%‑50% dos casos 11,12,13,14. O exercício é o cofator mais frequentemente implicado na alergia a trigo dependente de cofatores, mas outros podem estar implicados 12.
As albuminas, globulinas e gliadinas são as proteínas mais relevantes na alergia a trigo 15. A molécula alergénica mais bem compreendida é a ω‑5‑gliadina (Tri a 19), uma proteína de armazenamento do trigo, identificada em quase 100% dos doentes com anafilaxia induzida pelo exercício após ingestão de trigo 16. O valor diagnóstico da IgE específica a Tri a 19 foi demonstrado em vários estudos, alguns dos quais mostrando que este doseamento pode dispensar provas de provocação 16,17. O valor de corte arbitrário utilizado por muitos laboratórios para o doseamento por imunoensaio de IgE‑específica sérica é geralmente de 0,35 kU/L; contudo, vários estudos mostram que valores de IgE a Tri a 19 mais baixos podem ter significado clínico, traduzido no valor preditivo positivo (VPP) de 100% e valor preditivo negativo (VPN) de 88% para a alergia IgE mediada a trigo quando a IgE a Tri a 19 é ≥ 0,04 kU/L 18,19,20.
Os testes cutâneos por picada (TCP) com extratos comerciais de farinha de trigo têm uma especificidade muito baixa, sendo que esta poderia ser aumentada utilizando extratos de gliadina e, se possível, ω‑5‑gliadina, embora não se conheça a sua real aplicabilidade clínica. Outros alimentos podem estar envolvidos na CEFA e geralmente estes são os mais prevalentes nas alergias alimentares na população portuguesa 5. A alergia a alimentos vegetais por non‑specific Lipid transfer proteins (LTP) é um exemplo de alergia alimentar com alta prevalência em adultos no Sul da Europa, onde 70% da população está sensibilizada a estas proteínas 21,22,23.
Portugal é um destes países e o pêssego é geralmente o alimento mais implicado 5,22,24,25. Assim, na região do Mediterrâneo, cerca de 92% das CEFA devem‑se a LTP 5,22,24. O exercício e os AINE parecem ser os cofatores mais frequentes 5,22.
As LTP são panalergénios presentes em frutos, incluindo frutos de casca rija e amendoim, vegetais, sementes, látex e pólenes de árvores e ervas, cuja sensibilização pode acontecer por via oral, inalatória ou cutânea, com possibilidade de reatividade cruzada entre os vários alimentos de origem vegetal e entre estes e pólenes 21,22,23,26,27. Apesar de serem proteínas muito estáveis, resistentes à temperatura e digestão enzimática, as LTP nem sempre causam reações sistémicas, podendo inclusivamente causar reações ligeiras como síndrome de alergia oral 23,24,26,27,28.
A Pru p 3, a LTP do pêssego, é o principal marcador de alergia a LTP; contudo, é impossível predizer se um dado doente terá alergia a alimentos de outras famílias que não a Rosaceae (família à qual pertence o pêssego) com base apenas na IgE a Pru p 3 27,29. O diagnóstico molecular com LTP de outras fontes pode ajudar, contudo estão disponíveis apenas Ara h 9 (amendoim), Cor a 8 (avelã), Jug r 3 (noz), Mal d 3 (maçã) e Tri a 14 (trigo)27. Como descrito para a Tri a 19, também o valor de corte da IgE a Pru p 3 vem sendo descrito como inferior ao convencionalmente usado 0,35 kU/L e em alguns estudos o valor de corte de 0,10 KU/L é apontado como tendo significado clínico 30,31,32.
A especificidade dos TCP com extratos comerciais de frutos frescos e secos é baixa, mas pode contudo ser aumentada pela adição de extrato comercial de Pru p 3 26. O objetivo deste trabalho é caracterizar e comparar as características clínicas, demográficas e laboratoriais dos doentes diagnosticados com CEFA a LTP e dos com CEFA a ω5G.
MATERIAIS E MÉTODOS
População e desenho do estudo
Estudo observacional retrospetivo em doentes seguidos em consulta de Alergia Alimentar de um hospital no Norte de Portugal, diagnosticados com CEFA a ω‑5‑gliadina (ω5G) e/ou LTP, entre 01/2012 e 12/2020. O diagnóstico foi estabelecido com base na história clínica sugestiva de CEFA após a ingestão de trigo e /ou alimentos contendo LTP, nomeadamente frutos frescos, secos e amendoim, e corroborada pela presença de IgE específicas para componentes moleculares, Tri a 19 (para o trigo, ω5G) e Pru p 3 (LTP do pêssego e principal marcador de sensibilização a LTP), medidos por método singleplex (ImmunoCAP™ Thermofisher, Uppsala, Suécia) ou multiplex (ImmunoCAP™ ISAC™, Thermofisher, Uppsala, Suécia). Valores de IgE a Tri a 19 e a Pru p 3 ≥ 0,10 kU/L, medidos por método singleplex, ou ≥ 0,3 ISU (ISAC Standardadized Units), por método multiplex, foram considerados positivos 18‑20,30‑32.
Os doentes foram caracterizados de acordo com dados demográficos (idade e sexo), sintomatologia, gravidade e número de reações até ao diagnóstico, alimentos envolvidos, cofatores implicados, modificações na dieta após o diagnóstico e frequência de reações após as alterações dietéticas. Para caracterização do padrão sensibilização foram incluídos, quando disponíveis, os TCP para aeroalergénios (Dermatophagoides farinae, Dermatophagoides pteronyssinus, Lepidoglyphus destructor, Tyrophagus putrescentiae, gato, cão, bétula, parietária, gramíneas, cynodon, plátano, oliveira, profilina da palmeira, artemísia, Cladosporium, Aspergillus fumigatus, alternaria), farinhas (milho, trigo, aveia, centeio, cevada, farinha de arroz, arroz inteiro, malte, glúten e gliadina), frutos frescos (kiwi, melão, banana, figo, ananás, abacate, papaia, manga, maracujá, laranja, melancia, uva branca, uva preta, pêssego (pele), pêssego (polpa), alperce (pele), nêspera, ameixa, cereja, maçã (pele), maçã (polpa), pera (pele), pera (polpa), romã, dióspiro, morango, bétula), secos e leguminosas (amêndoa, amendoim, avelã, pinhão, pistacho, noz, caju, soja) e extratos moleculares (LTP do pêssego e profilina da palmeira) [Roxall‑Aristegui, Bilbao]. A metodologia retrospetiva deste trabalho justifica a ausência de resultados de TCP para todos os extratos em alguns doentes. Os TCP para aeroalergénios foram realizados em 78% dos doentes, para frutos frescos e secos esta percentagem é variável em ambos os grupos, embora todos os 34 doentes com CEFA‑LTP
tenham TCP para a LTP do pêssego e 85% para o pêssego, valores inferiores no grupo CEFA‑ω5G de 73% e 60% respetivamente. Os TCP com farinhas foram realizados em 80% dos doentes com CEFA‑ω5G e em aproximadamente 60% dos com CEFA‑LTP.
A gravidade da reação foi classificada de acordo com a escala de Brown, Tabela 2 33. O estudo foi conduzido de acordo com a Declaração de Helsínquia e aprovado pela comissão de ética local.
Análise estatística
A análise estatística foi executada com o software IBM SPSS® v.20.0 (IBM Co, Armonk, EUA). As variáveis categóricas foram expressas como número e percentagem e comparadas usando o teste quiquadrado ou o teste exato de Fisher, conforme apropriado. As variáveis contínuas foram expressas como media e desvio‑padrão, ou mediana e amplitude interquartil (AIQ) para variáveis com distribuição não normal. Para comparar variáveis contínuas foi usado o teste t‑Student, para variáveis com distribuição normal, e o teste de Mann‑Whitney, para variáveis de distribuição não normal.
Todos os valores p mencionados são bicaudais, com o valor de p <0,05 indicando significância. Foi calculado o valor do coeficiente de concordância kappa de Cohen (k) ajustado aos intervalos de confiança de 95%, sendo que os valores foram considerados significativos para p <0,05.
RESULTADOS
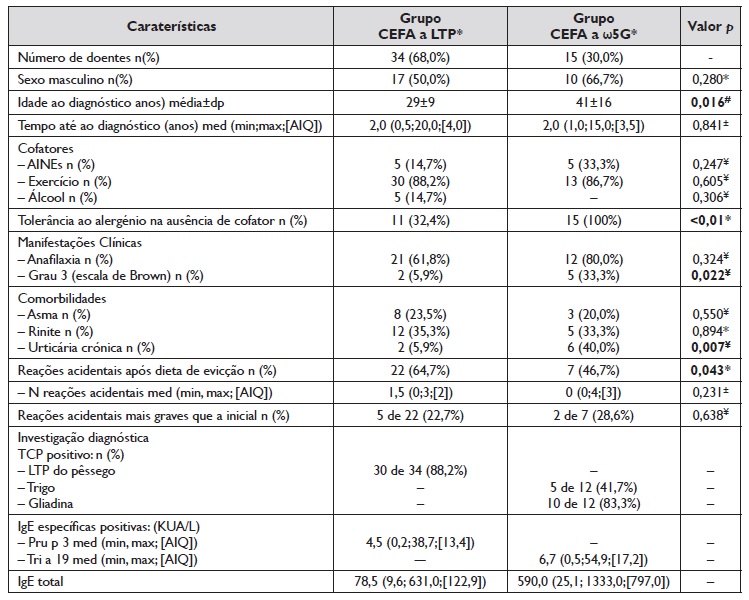
Foram incluídos 49 doentes, 27 (55,1%) do sexo masculino, a idade mediana da amostra foi de 50 anos (14, 69; [AIQ] 15), relativamente ao período de análise de 9 anos. Destes, 34 doentes (69,4%) tinham diagnóstico de CEFA a LTP e 15 (30,6%) a ω5G.
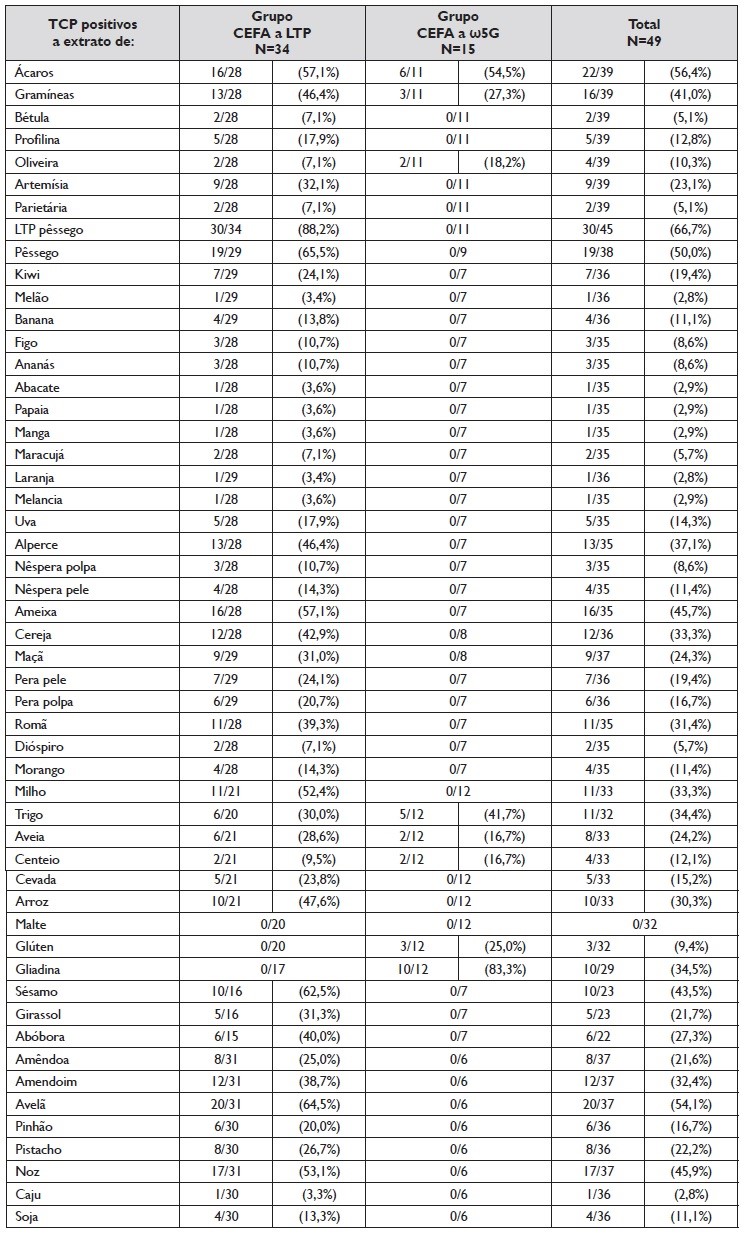
A descrição das características dos doentes, distribuídos de acordo com o tipo de CEFA, encontra‑se na Tabela 3. Os resultados dos TCP a aeroalergénios e alimentos estão descriminados na Tabela 1.
Tabela 2 Classificação da gravidade da reação segundo a escala de Brown
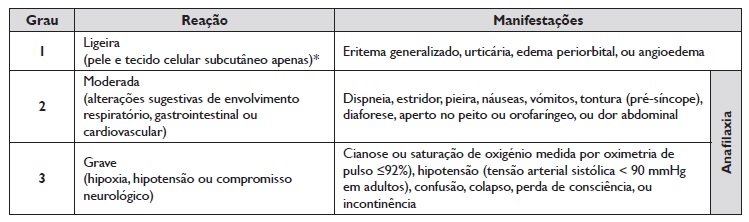
* As reações ligeiras podem ainda ser subclassificadas mediante a presença/ausência de angioedema
Tabela 3 Características dos doentes: CEFA a LTP vs CEFA a ω5G
AINE: Anti‑inflamatórios não esteroides; AIQ: Amplitude interquartil; CEFA: Co‑factor enhanced food allergy; dp: Desvio‑padrão; FR: fatores de risco; IgEs: Imunoglobulinas E específicas; LTP: Lipid transfer proteins; max: máximo; med: mediana; min: mínimo; n: número; TCP: Testes cutâneos por picada; ω5G: ómega 5 gliadina
*Teste quiquadrado; #Teste T‑Student; ± Testes de Mann‑Whitney; ¥ Teste de Fishe
CEFA a LTP (CEFA‑LTP)
A média de idade no grupo dos 34 doentes com CEFA‑LTP foi de 29±9 anos, com igual distribuição por ambos os sexos. A mediana de tempo desde a primeira reação até ao diagnóstico foi de 2 anos, com um mínimo de 6 meses e máximo de 20 anos (AIQ 4,0).
Onze dos doentes com CEFA‑LTP (32,4%) toleravam os alimentos implicados nas reações prévias, se ingeridos na ausência de cofatores. Os frutos frescos (sobretudo o pêssego) foram os principais alimentos envolvidos nas reações (n=16, 47,1%), seguidos dos frutos secos e amendoim em 10 (29,9%) e frutos frescos e secos em 6 doentes (17,6%).
O exercício foi o cofator mais frequente neste grupo (n=30, 88,2%), seguido dos AINE e álcool (n= 5, 14,7%). Cinco doentes tinham reações com envolvimento de mais de um cofator (3 com AINE e exercício, 1 com álcool e exercício e 1 com os três cofatores referidos). Pela história clínica, nenhum outro cofator esteve implicado nas reações. A primeira manifestação clínica foi ligeira (grau 1 na escala de Brown) em 13 doentes (38,2%) e anafilaxia em 21 doentes (61,8%); destes, 19 (90,5%) apresentavam reação grau 2 na escala de Brown e 2 doentes (9,5%) tinham anafilaxia com choque à apresentação (grau 3).
A rinite, seguida de asma, foram as comorbilidades mais frequentes neste grupo, com 12 (35,3%) e 8 (23,5%) doentes, respetivamente.
Todos os doentes com CEFA‑LTP tiveram doseamentos de IgE a Pru p 3 por método singleplex; a mediana da IgE a Pru p 3 de 4,49 (0,19; 38,70; [AIQ] 7,08) kU/L. Os perfis de sensibilização a alimentos por testes cutâneos encontram‑se na Tabela 1. Os TCP com a LTP do pêssego foram positivos em 30/34 (88,2%) doentes. Os TCP com extratos de frutos frescos com maior percentagem de positivos nos doentes testados foram os frutos da família Rosaceae, nomeadamente pêssego (55,9%), ameixa (47,1%), alperce (38,2%) e cereja (35,3%), seguidos pela romã (32,4%). No que respeita aos extratos de frutos secos, a avelã (58,8%) e a noz (54,8%) foram os TCP com maior percentagem de positividades.
De acordo com a clínica, alimento envolvido e sensibilizações encontradas nos TCP, outras LTP foram pesquisadas em alguns doentes. A Jug r 3 (LTP da noz) foi positiva em 6/6 doentes testados, com uma mediana de 0,98 (0,47; 23,80; [AIQ] 7,48) kU/L, a Cor a 8 (LTP da avelã) foi positiva em 21/25 testados, mediana de 0,74 (0; 8,3; [AIQ] 1,90) kU/L. O método multiplex ISAC™ foi usado em 3 doentes, em todos a Pru p 3 e a Jug r 3 foram positivas e em 2 a Cor a 8 foi também positiva.
Depois de estabelecido o diagnóstico, estes doentes iniciaram dieta de evicção dos alimentos implicados nas reações, mas não dos alimentos aos quais estavam apenas sensibilizados. Foram reportadas ingestões acidentais em 22 doentes (64,7%), sendo que em 5 esta foi mais grave do que a reação prévia ao diagnóstico.
CEFA a ω5G (CEFA‑ω5G)
A média de idade no grupo de 15 doentes com diagnóstico de CEFA a ω5G foi de 41±16 anos, 66,7% do sexo masculino (n=10). A mediana de tempo desde a primeira reação até ao diagnóstico foi de 2 anos, com um mínimo de 1 ano e máximo de 15 anos (AIQ 3,5).
O pão foi o alimento mais frequentemente envolvido na reação (n=11, 73,3%); 2 doentes (13,3%) referiram as bolachas e massas e outros 2 (13,3%) não identificaram o alimento envolvido. O exercício e os AINEs foram os únicos cofatores apurados neste grupo. O exercício foi implicado em 86,7% (n=13 doentes) e os AINE em 33,3% (n=5 doentes), sendo que 3 destes doentes (30%) tinham reações na presença de exercício e de AINE. Nos 5 doentes com AINE como cofator, 3 toleraram posteriormente o mesmo AINE na ausência de alimentos contendo trigo e 2 suspenderam o consumo destes fármacos após a reação e foram posteriormente submetidos a provas de provocação com os fármacos suspeitos, negativas em ambos. Todos os doentes toleravam a ingestão de trigo na ausência de cofatores.
A anafilaxia foi a manifestação clínica inicial em 12 doentes (80,0%), 5 destes (33,3% dos doentes com CEFA‑ω5G) com choque (grau 3 na escala de Brown); os restantes 3 doentes (20,0%) tiveram reações ligeiras, com um único sistema afetado à apresentação.
A urticária crónica (UC), seguida da rinite, foram as comorbilidades mais frequentes neste grupo, em 6 (40,0%) e 5 (33,3%) doentes, respetivamente. Foi encontrada uma associação entre o alergénio envolvido na CEFA (LTP vs ω5G) e UC (p=0,007); 8 doentes na amostra tinham UC, a maioria pertencente ao grupo CEFA‑ω5G (N=6, 75%).
Em todos os doentes com CEFA‑ω5G a IgE a Tri a 19 foi doseada por método singleplex; a mediana foi de 6,69 (0,53; 54,90; [AIQ] 14,17) kU/L, correspondente ao d (método singleplex).
Para caracterizar a alergia a ω5G, os doentes com história sugestiva realizaram também TCP com extratos comerciais de farinhas. Os perfis de sensibilização encontram‑se na Tabela 3. Os TCP com gliadina foram positivos em 10/12 (83,3%) doentes, a trigo em 5/12 (41,7%), a glúten em 3/12 (25,0%) e à aveia e centeio em 2/12 (16,7%). O VPP do TCP com gliadina foi de 90,9% e do TCP com trigo de 45,5%.
Após o diagnóstico de CEFA a ω5G, foi proposto a todos os doentes que iniciassem uma dieta isenta de glúten (para facilidade de reconhecimento de ω5G nos alimentos) nas 6 horas anteriores e 2 horas posteriores à prática de exercício, tão intenso tanto quanto o mínimo de atividade que causou reações e aquando da toma de AINE. Foram reportadas reações após as alterações alimentares referidas em 7 doentes (46,7%) e em 2 a reação durante a ingestão acidental foi mais grave do que as prévias ao diagnóstico.
DISCUSSÃO
Neste trabalho é possível comparar as características dos doentes com CEFA a ω5G e a LTP. O grupo de doentes com CEFA‑LTP tem maior representatividade nesta amostra (68,0% vs 30,0%), como esperado numa população de um país do Sul da Europa, com alta prevalência estimada de alergia a LTP 24,35). Apesar de muito descrita em populações asiáticas, desconhece‑se a prevalência da alergia a ω5G no Sul da Europa e este trabalho mostrou que a ω5G terá particular importância enquanto alergénio implicado na CEFA, mesmo numa população com grande sensibilização a LTP.
Não foi encontrada diferença na distribuição por sexo nos doentes com CEFA‑LTP; já no grupo de doentes CEFA‑ω5G o sexo masculino foi ligeiramente mais pre‑valente (50,0% vs 66,7%), como no trabalho de Kennard L, et al. 12.
Nesta amostra, os doentes com CEFA‑ω5G são significativamente mais velhos (p=0,016), com uma idade média ao diagnóstico de cerca de 11 anos superior à dos doentes com CEFA‑LTP (idade média de 41±16 anos versus 29± 9 anos). Devem, porém, ser tidas em conta as limitações inerentes ao reduzido tamanho amostral, às diferenças na distribuição do número de doentes (2,3 vezes mais doentes no grupo CEFA‑LTP), e à dificuldade na suspeição e diagnóstico, muitas vezes tardio, da CEFA‑ω5G.
Como esperado, o exercício foi o cofator mais frequente em ambos os grupos: 88,2% dos doentes do grupo CEFA‑LTP e 86,7% dos do grupo CEFA‑ω5G 3,4. Ao contrário do clássico conceito de WDEIA, no qual o exercício é o único cofator na alergia a ω‑5‑gliadina, nesta amostra foram também identificados os AINE, em 3 doentes, como cofator isolado relevante. No grupo CEFA‑LTP, além do exercício e AINE, o álcool foi também um cofator relevante 5,12.
A tolerância ao alergénio na ausência de cofatores associou‑se com a CEFA‑ω5G (p<0,01); todos os doentes com CEFA‑ω5G toleravam trigo quando os cofatores estavam ausentes; já nos com CEFA‑LTP, apenas uma minoria de doentes (32,4%) apresentava tolerância ao alimento na ausência de cofatores. Este dado poderá permitir dietas menos restritivas no grupo de doentes com CEFA‑ω5G.
A rinite, seguida da asma, foram as comorbilidades mais frequentes no grupo CEFA‑LTP.
A UC foi a principal comorbilidade nos doentes com CEFA‑ω5G, encontrando‑se uma associação entre a estas duas entidades (p=0,007); este dado vai de encontro a estudos que abordam o papel da ω5G na UC 34.
Foi descrita anafilaxia em 21 doentes (61,8%) com CEFA‑LTP, 2 destes com choque anafilático, e em 12 doentes (80,0%) com CEFA‑ω5G, 5 dos quais com choque.
Nesta amostra foi encontrada uma associação entre o alergénio envolvido na reação (LTP vs ω5G) e a gravidade da reação (p=0,02). Na literatura, a alergia a ω5G está associada a reações mais graves do que a alergia a LTP, o que se verificou na presente população; os doentes com CEFA‑ω5G tiveram 8 vezes a odd de choque anafilático dos doentes do grupo CEFA‑LTP (OR=8,0, IC 95% [1,34‑47,7] (p=0,02) 5,9,10.
Após instituição das dietas de evicção, verificaram‑se diferenças no número de reações acidentais entre grupos; 64,7% dos doentes com CEFA‑LTP e 46,7% dos com CEFA‑ω5G tiveram reações acidentais durante a dieta de evicção. Assim, as reações acidentais associaram‑se com a CEFA‑LTP (p=0,043). A reação acidental foi mais grave que a primeira em 22,7% e 28,6% dos doentes, respetivamente.
Quando avaliamos o valor diagnóstico dos TCP, na CEFA‑LTP, os TCP com LTP revelaram‑se particularmente importantes, sendo positivos em 30 dos 34 doentes com CEFA‑LTP testados, apresentando assim uma sensibilidade de 88,2%. O mesmo não foi verificado para TCP com outros frutos frescos ou secos. No grupo de doentes com CEFA‑ω5G, os TCP com trigo não se mostraram particularmente úteis (positivos em 5 dos 12 testados, 41,7%), porém, os TCP com gliadina foram positivos em 10 dos 12 doentes testados (83,3%). O VPP do TCP com gliadina foi, assim, de 90,9%, sendo 45,5% com o extrato de trigo. Nesta amostra, o TCP com gliadina revelou‑se o mais útil no diagnóstico de CEFA‑ω5G, corroborando o facto de o uso de gliadina aumentar a rentabilidade diagnóstica dos TC na CEFA‑ω5G15.
Apesar de não haver significância estatística, os doentes com CEFA‑LTP tiveram medianas de IgEs a Pru p 3 mais baixas que as IgE a Tri a 19 dos doentes com CEFA‑ω5G (4,5 kU/L vs 6,7 kU/L), também refletida na IgE específica mínima e máxima (ver Tabela 3). É importante referir que, se utilizado cutt‑off arbitário de 0,35 kU/L falharíamos o diagnóstico de apenas um doente com CEFA‑LTP, embora em ambos os grupos os valores de IgE específica a ω5G e a LTP sejam baixos (medianas de 4,5 e 6,7 kU/L). Este doente, com IgE específica para Pru p 3 <0,35 kU/L e clínica da anafilaxia a noz com exercício como cofator, apresentava valores de IgE específica para Jug r 3 e Cor a 8 de 0,47 e 0,35 kU/L, respetivamente, confirmando o diagnóstico de CEFA‑LTP, apesar de o “marcador” de alergia a LTP (Pru p 3) ter o valor mais baixo de entre os três alergénios moleculares da família LTP doseados 27,29.
Existem várias limitações ao presente estudo que devem ser referidas, começando pelo reduzido tamanho amostral e análise retrospetiva. Outra importante limitação, alvo de alguma controvérsia, reside no facto de não terem sido realizadas provas de provocação com os alimentos suspeitos na presença e na ausência dos cofatores.
Neste trabalho, o diagnóstico baseou‑se na deteção de IgE especficas a Tri a 19 e Pru p 3, corroborado por alguns trabalhos que discutem a necessidade de provas de provocação nestes doentes, considerando o risco associado à sua realização (particularmente na alergia a ω5G), os custos diretos e indiretos e o elevado VPP da IgE específica a Tri a 19 e Pru p 3 no contexto de CEFA 16,17,30,31,32.
A tolerância aos alimentos na ausência dos cofatores em questão, bem como a tolerância dos cofatores na ausência destes alimentos, corroboram também o diagnóstico.
O único doente com CEFA a ambos os alergénios não apresentava reações mais graves do que os restantes e tolerava cofatores e alimentos quando ingeridos em separado.
A limitada descrição na literatura sobre CEFA a múltiplos alimentos não permite inferir comparações.
CONCLUSÕES
O diagnóstico de CEFA exige um alto índice de suspeição clínica, pois a tolerância posterior a um alimento suspeito não permite excluir o diagnóstico e a identificação de cofatores pode ser difícil. Deste modo, a anamnese cuidada com alto índice de suspeição é o primeiro passo para aumentar a acurácia do diagnóstico. Na nossa população, as LTP foram o alergénio mais frequente, e o exercício o cofator mais identificado. Contudo, a ω5G foi identificado como o alergénio envolvido na CEFA em 30% dos doentes e associou‑se a reações mais graves (anafilaxia com choque). Assim, nos doentes com história clínica sugestiva de CEFA, mesmo em áreas com alta prevalência de sensibilização a LTP, deve ser considerado o trigo (ω5G) como possível suspeito e a alergia a ω5G deve ser ativamente pesquisada.
Neste trabalho, os TC a gliadina revelaram utilidade no diagnóstico de alergia a ω5G, contrariamente ao TC com trigo; um teste negativo ao trigo não exclui a alergia a Tri a 19. O diagnóstico molecular com IgE específicas a Pru p 3 e Tri a 19 parece ser uma ferramenta essencial na abordagem diagnóstica de doentes com suspeita de CEFA. O elevado VPP da IgE a Tri a 19 permite estabelecer o diagnóstico definitivo de CEFA‑ω5G, evitando provas de provocação, que acarretam elevado risco e custos diretos e indiretos.
A relevância da ω5G e da LTP na CEFA parece variar entre populações. Por oposição às LTP, pouco se sabe sobre a alergia a ω5G no Sul da Europa e fica por determinar qual destes alergénio é mais relevante nestas populações.
Por estas razões, a alergia a Tri a 19 deve ser ativamente pesquisada, sobretudo quando na presença de cofatores.