INTRODUÇÃO
A rinossinusite crónica com polipose nasal (RSCcPN) no adulto é definida pela presença de inflamação do nariz e seios perinasais e caracterizada pela presença de pelo menos dois dos seguintes sintomas: 1) obstrução nasal, 2) rinorreia (anterior ou posterior), 3) pressão ou dor facial e/ou 4) hiposmia ou anosmia, sendo um dos quais obrigatoriamente o sintoma 1) ou 2), com duração de pelo menos 12 semanas, acompanhados de pólipos bilaterais no meato médio visualizados na endoscopia nasal 1.
A RSCcPN grave e não controlada tem um elevado impacto na qualidade de vida dos doentes e acarreta uma exposição aumentada a corticoides sistémicos e/ou a procedimentos cirúrgicos com necessidade frequente de reintervenção 2.
Num estudo de Ghent e colaboradores, de entre os 140 doentes com RSCcPN estudados, 84,3% tinham um perfil de inflamação do tipo 2 (T2) (determinado pela presença de interleucina 5 (IL-5) no tecido dos pólipos). A presença de comorbilidades como a asma, alergia ou hipersensibilidade a anti-inflamatórios não esteroides (AINE) estava associada a perfil T2 em 94,2% destes doentes, a presença de ≥300 eosinófilos/L no sangue periférico, mesmo na ausência destas comorbilidades, estava associada ao perfil T2 em 95,5% dos doentes e a presença das comorbilidades referidas e de eosinofilia simultaneamente identificou 98,3% dos doentes com RSCcPN T2 2.
Estão atualmente disponíveis em Portugal cinco fármacos biológicos com indicação para diferentes patologias com inflamação do tipo 2: anti-imunoglobulina E (IgE): omalizumab 3, anti-IL-5/recetor da IL-5 (IL-5R): mepolizumab 4, reslizumab 5 e benralizumab 6, e antirrecetor da interleucina 4 (IL4R): dupilumab 7.
O dupilumab teve em 2019 autorização de introdução no mercado (AIM) para a RSCcPN não controlada, sustentada pelos estudos LIBERTY NP SINUS-24 e -52 8, o omalizumab obteve a sua AIM em 2020, apoiada nos estudos POLYP 1 e POLYP 2 9 e o mepolizumab tem AIM desde janeiro de 2022, tendo como base o estudo SYNAPSE 10. Foram também realizados ensaios clínicos com o reslizumab 11 e o benralizumab 12, atualmente sem aprovação nesta indicação.
Para além dos estudos pivotais de cada fármaco, foram até à data publicadas duas revisões sistemáticas da eficácia e segurança do tratamento com biológicos na RSCcPN 13,14.
Visto que:
1) Existem atualmente três fármacos biológicos, com indicação na RSCcPN, aprovados em Portugal;
2) Existem doentes com RSCcPN e outras comorbilidades, nomeadamente a asma T2, em tratamento com qualquer um dos fármacos mencionados;
3) Não existem estudos comparativos diretos de eficácia dos diferentes biológicos na RSCcPN;
4) Não existem atualmente recomendações nacionais para a monitorização de eficácia dos biológicos na RSCcPN.
Foi constituído um grupo multidisciplinar que inclui médicos especialistas em Imunoalergologia, Otorrinolaringologia e Pneumologia e um farmacêutico hospitalar, de forma a propor critérios para a prescrição de biológicos em doentes com RSCcPN, bem como medidas de avaliação de eficácia transversais, independentemente do biológico administrado, que permitam uma colheita de dados padronizada e a realização de estudos de vida real multicêntricos prospetivos e/ou retrospetivos.
METODOLOGIA
Foram revistas as propostas dos dois principais grupos de trabalho internacionais sobre este tema: European Position Paper on Rhinosinusitis and Nasal Polyps (EPOS) 2020 1 e European Forum for Research and Education in Allergy and Airway Diseases (EUFOREA) 2021 2, bem como as metodologias utilizadas nos vários ensaios clínicos de biológicos na RSCcPN e avaliada a pertinência, bem como a exequibilidade na prática clínica dos vários outcomes.
A proposta inclui:
1) Dados demográficos e clínicos que devem constar no processo clínico;
2) Escalas de avaliação e forma de aplicação;
3) Critérios de gravidade e de controlo com indicação para tratamento com biológico;
4) Avaliações sugeridas no seguimento;
5) Critérios de eficácia.
PROTOCOLO CLÍNICO:
Dados demográficos e clínicos
Como informação obrigatória basal consideramos que deve constar: data de nascimento, género, presença e caracterização de asma, de atopia e/ou de hipersensibilidade a AINE, ano de diagnóstico de RSCcPN, número, data e caracterização (quanto à técnica e extensão) de cirurgias naso-sinusais prévias, número de ciclos de corticoide sistémico nos dois anos anteriores (incluindo, se conhecido, fármaco, dose e duração), patologias concomitantes (com particular enfase em patologias decorrentes de utilização frequente ou prolongada de corticoides sistémicos ou com implicações em termos de risco cirúrgico), medicação atual, escalas de avaliação da gravidade da rinossinusite e da polipose nasal e a quantificação de eosinófilos no sangue periférico no ano anterior, em doente sem tratamento com corticoides sistémicos e/ou o valor máximo prévio em doente sob corticoterapia sistémica.
Escalas de avaliação
Pontuação endoscópica dos pólipos nasais (NPS - Endoscopic nasal polyps score)
Pontuação entre 0 e 4 para cada lado, de acordo com o tamanho dos pólipos avaliado por endoscopia nasal (Tabela 1), resultando numa pontuação máxima de 8 pontos (15). Um NPS ≥ 5 (e ≥ 2 para cada um dos lados) foi utilizado como critério de inclusão em todos os ensaios clínicos de biológicos na RSCcPN 8-10,12.
Tabela 1 Pontuação endoscópica dos pólipos nasais - Nasal polyp score (NPS). Sistema de pontuação dos pólipos nasais usado para avaliar o tamanho dos pólipos em cada cavidade nasal através de endoscopia nasal (adaptado de Gaevert et al 15

No EPOS não é definido um tamanho mínimo dos pólipos para indicação para biológico, mas refere a necessidade da presença de pólipos bilaterais, sendo a diminuição do tamanho dos pólipos um dos critérios para avaliação de eficácia 1. No EUFOREA um NPS ≥ 4 com pólipos bilaterais é um dos critérios de gravidade e a diminuição do tamanho dos pólipos para um NPS < 4 aos 12 meses é um dos critérios essenciais para considerar a resposta ao tratamento como adequada (Figura 1) 2.
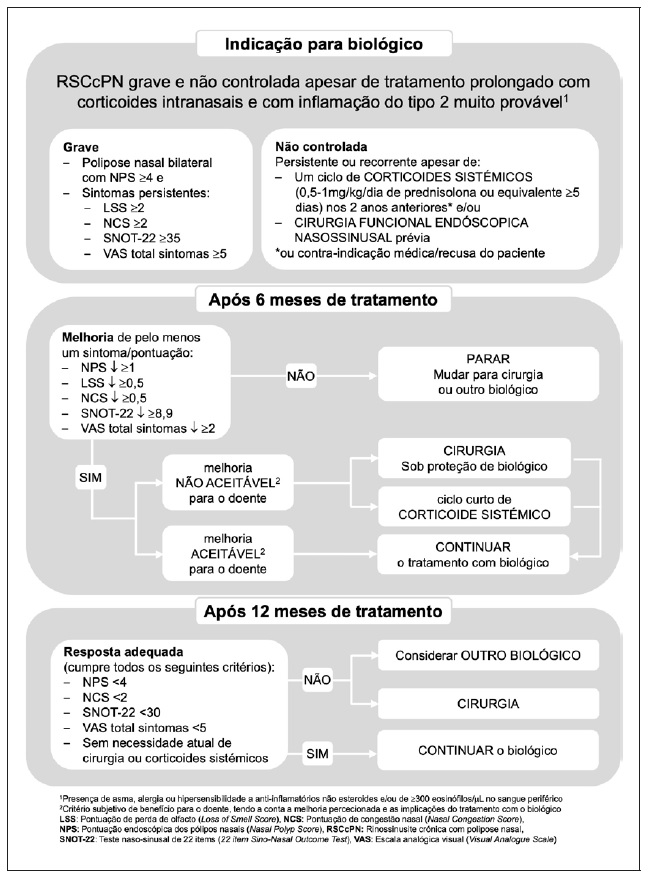
Figura 1 Proposta de critérios para início de biológico e de monitorização de eficácia no tratamento da RSCcPN (Adaptado de Bachert et al 2)
Pontuação de perda de olfato
(LSS - Loss of smell score)
Avaliação diária da perda de olfato em 4 categorias: 0 - sem perda de olfato - normosmia, 1 - hiposmia ligeira, 2 - hiposmia moderada, 3 - perda de olfato grave - anosmia 16. Nos ensaios clínicos e em alguns centros especializados esta avaliação é feita com recurso a aplicações/registo informatizado. Sendo esta abordagem de difícil exequibilidade na prática clínica propõe-se aplicar esta escala questionando a média da gravidade da perda de olfato na última semana, tal como realizado na fase de screening de um dos ensaios clínicos (Figura 2) 9.
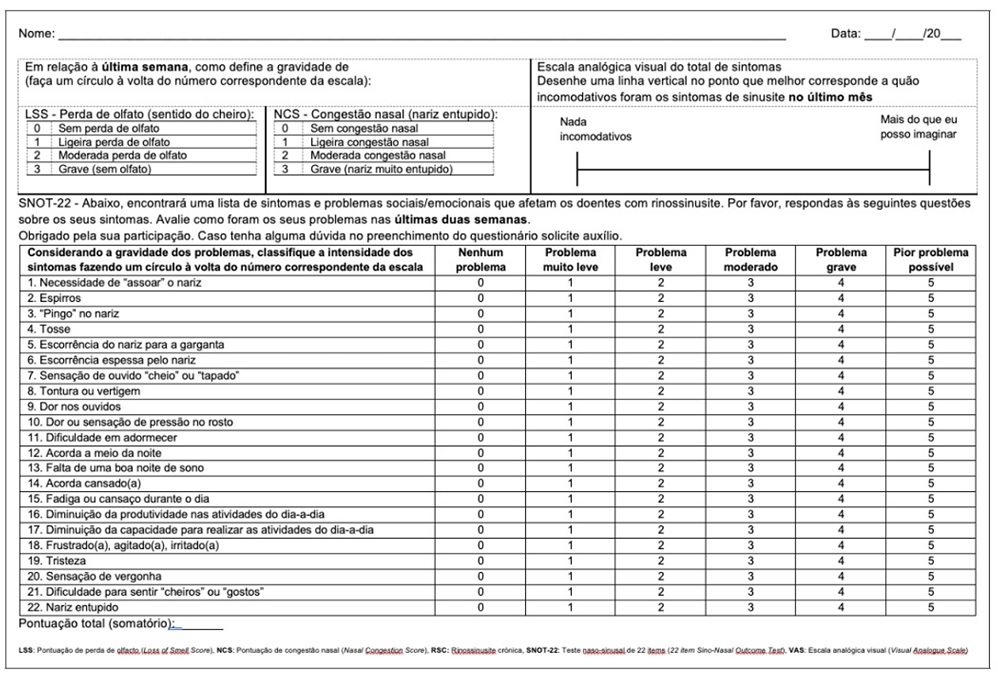
Figura 2 Escalas e questionários de avaliação de sintomas utilizados para definir a gravidade da RSC e a resposta ao tratamento, incluindo o LSS e NCS 12
Existem também testes psicofísicos para avaliação do olfato, tal como o teste de olfato de 40 items (UPSIT - The 40-item University of Pennsylvania Smell Identif ication Test) 17. No entanto, visto que não estão disponíveis em todos os centros, consideramos que devem ser incluídos apenas como informação complementar.
Pontuação de congestão nasal
(NCS - Nasal congestion score)
Avaliação diária da congestão nasal em 4 categorias: 0 - sem congestão nasal, 1 - congestão nasal ligeira, 2 - congestão nasal moderada, 3 - congestão nasal grave 16. À semelhança do LSS propõe-se aplicar esta escala questionando a média da congestão nasal na última semana (Figura 2) 9.
Teste naso-sinusal de 22 items
(SNOT-22 - 22-item Sinonasal outcome test)
Este é um instrumento de medição de qualidade de vida específico para a rinossinusite crónica, preenchido pelo doente relativamente às 2 semanas anteriores e que avalia a gravidade de sintomas e de problemas sociais e emocionais relacionados com esta patologia. O resultado varia entre 0 (sem interferência) e 110 (máxima interferência com a qualidade de vida) e a diferença mínima clinicamente significativa (MCID - minimal clinical important difference) é de 8,9 pontos 18 O questionário validado em português de Portugal 19 é apresentado na Figura 2.
Escala analógica visual do total de sintomas
(total symptoms VAS - Visual Analogue Scale)
Esta escala avalia a perceção do doente relativamente à gravidade do total de sintomas da rinossinusite no último mês através do desenho de uma linha vertical numa escala de 10 cm (0 - mínimo até 10 - máximo) (Figura 2) 20.
Indicação para tratamento com biológicos
A indicação terapêutica de dupilumab, omalizumab e mepolizumab para a RSCcPN em Portugal, bem como as recomendações internacionais, partilham o denominador comum de os biológicos serem indicados como tratamento complementar aos corticoides intranasais em doentes adultos com RSCcPN grave e não controlada.
No entanto, a ausência de controlo assume diferentes definições. No resumo de características do medicamento (RCM) de dupilumab 7 e de mepolizumab 4 é necessário o tratamento prévio com corticoides sistémicos e/ou cirurgia, enquanto no RCM de omalizumab 3 não especifica a realização prévia destes tratamentos mas serão doentes com indicação para tratamento adicional aos corticoides intranasais. No EPOS requer a realização prévia de cirurgia endoscópica nasossinusal e de pelo menos três dos cinco critérios seguintes: evidência de inflamação T2 (≥ 250 eosinófilos no sangue periférico e/ou IgE total ≥ 100), necessidade de dois ou mais ciclos de corticoides sistémicos no ano anterior (ou contraindicação para este tratamento), impacto significativo na qualidade de vida (SNOT-22 ≥ 40), anosmia e/ou diagnóstico de asma com necessidade de tratamento de controlo com corticoides inalados 1. No EUFOREA é proposta uma definição objetiva, quer de gravidade quer de controlo, que sugerimos utilizar (Figura 1) e é tida em conta não só a contraindicação para corticoides sistémicos e para a cirurgia, como também a recusa do doente em fazer estes tratamentos 2. No entanto, num doente sem contraindicação cirúrgica, é importante discutir a possibilidade de realizar um procedimento potencialmente curativo, versus o tratamento regular e prolongado com uma terapêutica de administração subcutânea, particularmente com o surgimento recente de técnicas de cirurgia funcional endoscópica nasossinusal (full house e reboot), que apresentam uma menor probabilidade de recidiva 21.
Pensamos ainda ser importante reforçar que os corticoides intranasais devem ser mantidos antes e durante o tratamento, sendo que nos ensaios clínicos realizados até à data foi utilizado como tratamento base em todos os doentes a mometasona nasal 400μg/dia, ou seja, duas pulverizações em cada narina 2id, exceto em doentes que não toleraram esta dose e que diminuíram para 1id 8-10,12.
É também consensual que devem ser avaliadas as comorbilidades (asma, atopia e hipersensibilidade a AINE) e a presença de eosinófilos no sangue periférico, de forma a identificar os doentes com maior probabilidade de inflamação do tipo 2 e que terão maior probabilidade de resposta aos biológicos atualmente disponíveis para esta indicação 2. Neste contexto é importante excluir outras patologias que podem cursar com RSCcPN mas que têm diferente prognóstico e tratamento, das quais são exemplos a fibrose quística, a rinossinusite fúngica e a granulomatose eosinofílica com poliangeíte 22.
Proposta de monitorização da eficácia e segurança do tratamento com biológicos
Tendo em conta que o EPOS 2020 sugere uma avaliação preliminar de eficácia às 16 semanas, seguida de uma avaliação aos 12 meses de tratamento 1 e o EUFOREA 2021 sugere avaliações aos 6 e 12 meses 2, consideramos importante manter estes três momentos de avaliação de eficácia, acrescentando uma avaliação inicial às 4 semanas, de forma a identificar eventuais respondedores rápidos ou alterações iniciais que possam ser preditoras de eficácia do tratamento com o biológico (Tabela 2).
Tabela 2 Esquema de monitorização do tratamento com biológicos na rinossinusite com polipose nasal
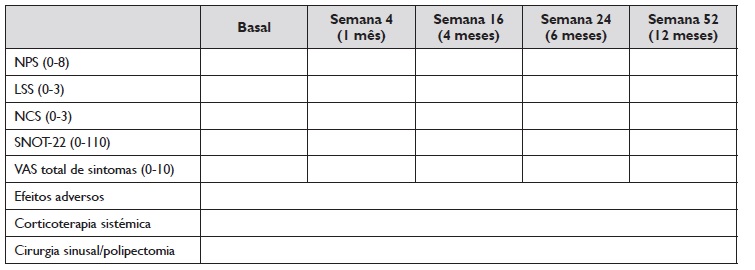
LSS: Pontuação de perda de olfato (Loss of smell score); NCS: Pontuação de congestão nasal (Nasal congestion score);
NPS: Pontuação endoscópica dos pólipos nasais (Nasal polyp score); RSCcPN: Rinossinusite crónica com polipose nasal;
SNOT-22: Teste nasossinusal de 22 items (22 item sino-nasal outcome test); VAS: Escala analógica visual (Visual analogue scale)
Devem ainda ser registadas quaisquer intercorrências, em particular a necessidade de cirurgia e/ou o tratamento com corticoides sistémicos (incluindo fármaco, dose e duração), quer para o tratamento da RSCcPN, quer por outras patologias (Tabela 2).
A monitorização de outras comorbilidades, nomeadamente a asma, deve seguir as recomendações internacionais do Global initiative for asthma (GINA) 23 e recomendações nacionais, como as da Rede de Especialistas em Asma Grave (REAG).
Critérios de eficácia e de suspensão do tratamento com biológicos
O EPOS 2020 define na Figura 1.6.3 (página 17) 1 a ausência de eficácia do tratamento com biológicos de forma idêntica às 16 semanas e aos 12 meses, com indicação para descontinuação na ausência de resposta a todos os seguintes parâmetros: NPS, necessidade de corticoides sistémicos, qualidade de vida, olfato e impacto nas comorbilidades.
O EUFOREA 2021 oferece uma proposta mais objetiva de critérios de eficácia aos 6 e 12 meses, apresentada na Figura 1 2 e que é a que recomendamos utilizar.
CONCLUSÕES
Este protocolo clínico apresenta uma proposta de colheita de dados padronizados a utilizar em contexto de prática clínica, que consideramos exequível e útil, quer do ponto de vista de uniformização dos critérios de acesso ao tratamento com biológicos e monitorização de eficácia e segurança, quer para a realização de futuros estudos multicêntricos de vida real que permitam comparar a eficácia dos vários biológicos disponíveis ou identificar fatores preditores de resposta ao tratamento com biológicos de forma geral e para cada fármaco em particular, em Portugal.















