INTRODUÇÃO
A dermatite atópica é uma patologia cutânea crónica, recidivante, caracterizada por prurido intenso, escoriações, fissuras, liquenificação e xerose cutâneas, com risco aumentado de infeções cutâneas1. Ocorre mais frequentemente em idade pediátrica (prevalência de 5-20% nas crianças), estando associada a história pessoal ou familiar de atopia e aumento da IgE sérica2. A dermatite atópica apresenta uma patogénese complexa que envolve fatores genéticos, imunológicos e ambientais, e pode contribuir para comorbilidades sistémicas e limitação psicossocial1.
A asma grave é definida como asma que requer tratamento com corticoide inalado em dose alta e de um segundo controlador para se manter controlada ou que não atinge controlo sintomático apesar desta terapêutica3. Muitos destes doentes têm uma função respiratória diminuída, apesar do tratamento otimizado, apresentando uma deterioração funcional com o tempo, com maior risco de exacerbações, o que contribui para um grande consumo de recursos do sistema de saúde4.
Cerca de metade dos doentes com asma apresenta ativação das células epiteliais da via aérea pela IL-13 (citocina de resposta tipo 2)5. Neste tipo de resposta inflamatória estão envolvidas as células Th2, eosinófilos e IgE, pelo que a medição dos níveis de IgE séricos e da eosinofilia periférica podem guiar a resposta a terapêuticas biológicas que tenham como alvo esta cadeia de resposta6.
O conceito de marcha atópica reflete a história natural das manifestações alérgicas, caracterizada por uma progressão de sinais clínicos de atopia desenvolvidos ao longo da infância: inicia-se classicamente com a dermatite atópica e progride para alergia alimentar, asma e rinite alérgicas7. A disfunção da barreira cutânea presente na dermatite atópica assume um papel central na sensibilização alergénica. Assim, um controlo efetivo do eczema pode prevenir o aparecimento de outras doenças ou, pelo menos, reduzir a sua gravidade. A dermatite atópica grave está particularmente associada e precede a alergia alimentar, sugerindo uma relação causal que pode resultar da disrupção da barreira cutânea e desregulação imunológica8. Por outro lado, a alergia alimentar pode, por sua vez, preceder o diagnóstico de asma e é considerado um fator de risco para asma grave9.
A terapêutica biológica representa um grande avanço no tratamento de várias doenças, sobretudo a nível hospitalar, e tem como alvo moléculas envolvidas no processo inflamatório. O dupilumab é um anticorpo humano monoclonal que inibe a sinalização da interleucina 4 (IL-4) e da interleucina 13 (IL-13) - citocinas tipo 2/Th2 - através da ligação à subunidade α partilhada pelos recetores das IL-4 e IL-13, diminuindo a resposta pró-inflamatória.
Assim, vários ensaios com dupilumab mostraram eficácia no tratamento de doenças relacionadas com uma resposta inflamatória tipo 2, como a dermatite atópica, asma ou polipose nasal6.
O dupilumab está comparticipado em Portugal para o tratamento de dermatite atópica moderada a grave em adultos e adolescentes a partir dos 12 anos10. Adicionalmente, encontra-se aprovado pela Agência Europeia do Medicamento como tratamento complementar de manutenção para asma grave com inflamação tipo 2, indicação esta ainda não comparticipada em Portugal11.
DESCRIÇÃO DO CASO
Os autores apresentam o caso de uma adolescente com 14 anos de idade, com antecedentes de asma e rinite alérgicas, referenciada inicialmente à consulta de Dermatologia para estudo de dermatite atópica. Desde a infância com história de xerose cutânea difusa e placas cutâneas eritematosas, descamativas, muito pruriginosas com localização predominante nas pálpebras e região malar, regiões antecubital e polítea e joelhos. Apresentava resposta apenas parcial e pouco sustentada aos corticoides tópicos e sistémicos, com várias exacerbações e mesmo internamento.
Associadamente, desde a idade escolar, apresenta queixas de prurido nasal e ocular, esternutos e obstrução nasal persistentes com interferência nas atividades diárias, a traduzir rinoconjuntivite alérgica persistente moderada/grave. Apresenta história de bronquiolites de repetição na infância, com necessidade de antibiótico e, pelo menos, dois internamentos. Sintomas de dificuldade respiratória com o exercício e sibilância e dispneia noturnas, apesar de medicada com corticoide e broncodilatador de longa duração inalados (ICS/LABA) - budesonida/formoterol, 160+4,5 μg/dose, 2 inalações, 2 vezes/dia - e inibidor dos leucotrienos (montelucaste, 10 mg/dia). Múltiplas exacerbações da asma (2/ano), com necessidade de corticoides sistémicos (prednisolona, 0,5-1 mg/kg/dia).
História de agravamento das lesões cutâneas, náuseas e vómitos com a ingestão de leite, marisco e ovo inteiro mal cozinhado, porém com tolerância de vestígios, fazendo evicção destes alimentos desde a infância.
Previamente seguida pela Dermatologia, onde iniciou fototerapia com UVB por dermatite grave, com envolvimento exuberante das pálpebras, região antecubital bilateral, face posterior das coxas, joelhos e região poplítea bilateralmente. Melhoria parcial das queixas com a fototerapia, para além da terapêutica tópica com emolientes, metilprednisolona e pimecrolimus (região facial), mas com resposta pouco sustentada. Manteve várias exacerbações (2-3/ano) com necessidade de corticoterapia sistémica (deflazacorte, 0,5-0,75 mg/kg/dia em terapia prolongada com redução gradual da dose). Houve necessidade de uma hospitalização para controlo sintomático (EASI score 63,6).
Referenciada para a consulta de Imunoalergologia para estudo da dermatite atópica aos 13 anos. Na primeira consulta apresentava sintomas brônquicos e nasais mal controlados. No exame objetivo salientamos lesões cutâneas eritematosas e descamativas em placas dispersas pelo corpo, de predomínio periocular, mãos, pescoço, flexuras dos membros superiores e inferiores (Figura 1-a,b,c,d), exsudativas (EASI score 18,4) e auscultação pulmonar com sibilância.
Do estudo alergológico realizado previamente destacam-se testes cutâneos por picada (Prick test) positivos para Dermatophagoides pteronyssinus (7x5mm), Dermatophagoides farinae (5x4mm), Lepidoglyphus destructor(3x3mm), gato (6x6mm), cão (6x6mm), plátano (7x5mm), bétula (7x4mm), oliveira (9x5mm), gramíneas (5x4mm), ervas (4x6mm), parietária (5x5mm) e Blatella (3x3mm).
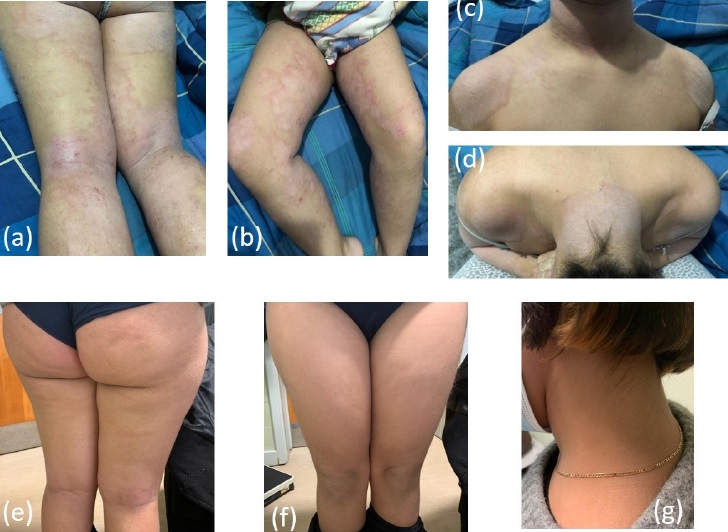
Figura 1 Lesões cutâneas de eczema atópico na primeira consulta - a) região posterior das coxas e pernas e pregas popliteas; b) região anterior das coxas; c) região cervical anterior; d) região cervical posterior) e após 1 mês de tratamento com dupilumab; e) região posterior das coxas e pernas; f) região anterior das coxas e pernas; e g) região cervical posterior
Analiticamente apresentava eosinófilos 0.0/μL, com IgE total 1047 UI/mL, com IgE específicas positivas para ácaros (42,7 kUA/L), gato (60,4 kUA/L), cão (47,4 kUA/L), gramíneas (29,6 kUA/L), barata (2,15 kUA/L), clara de ovo (1,01 kUA/L), trigo (3,7 kUA/L), soja (2,57 kUA/L), amendoim (2,49 kUA/L), morango (1,24 kUA/L) e kiwi (3,78 kUA/L). Do estudo adicional realizado no nosso hospital apresentava IgE para carne de porco de 17,4 kU/L, para bétula de 93,3 kU/L e para rPru p 3/LTP de 1,62 kU/L.
Para melhor esclarecimento da alergia alimentar, foi pedido um estudo de IgE específicas (Immuno Solid-Phase Allergen Chip - ImmunoCAP® ISAC), tendo revelado múltiplas positividades, nomeadamente a pólene de gramíneas e árvores (incluindo Bet v 1, Ole e 1, Ole e 9), ácaros, cão, gato, fungos, principalmente alternaria, e vários alimentos, como clara e gema de ovo (Gal d 1, 3 e 5), leite/carne de vaca (Bos d 6), camarão (Pen m 1 - tropomiosina, provável reatividade cruzada a ácaros), frutos da família das rosáceas (Mal d 1, Pru p 1 - homólogos da Bet v 1, provável reatividade cruzada a pólenes) e kiwi (Act d 1). O resultado completo das positividades do ISAC Test é mostrado na Figura 2a.
Realizou espirometria com prova de broncodilatação, sob corticoterapia sistémica, ICS/LABA em dose elevada e antagonista dos leucotrienos, com os seguintes resultados: FEV1 =57% (1,40L), FVC=82% (2,36L), FEV1/FVC=39%, a evidenciar síndrome obstrutiva moderadamente grave (critérios ATS/ERS), com prova de broncodilatação positiva (melhoria de 31% (403mL) no FEV1 após salbutamol, 400μg) - Figura 2b.
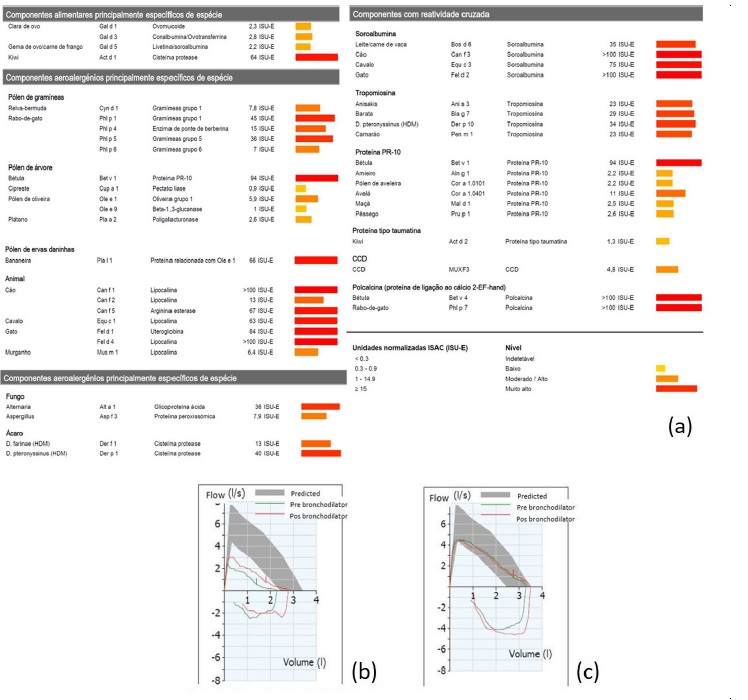
Figura 2 a) resumo dos resultados IgE positivos no teste ISAC; b) curva espirométrica fluxo-volume antes do tratamento com dupilumab; c) curva espirométrica fluxo-volume 7 meses após o início de tratamento com dupilumab
Pela gravidade e refratariedade terapêutica da dermatite atópica, foi decidido o início de terapêutica com dupilumab.
Apenas duas semanas após o início do tratamento apresentava já melhoria das lesões cutâneas, menos extensas e sem exsudado. Ao primeiro mês de tratamento, melhoria significativa dos sintomas brônquicos, com normalização da auscultação pulmonar, mantendo melhoria das lesões de dermatite, com um EASI score 3.4 - Figura 1-e,f,g. Aos 5 meses de tratamento, introduziu na alimentação o ovo inteiro mal cozinhado em quantidades crescentes, sem queixas a nível cutâneo apenas com xerose, áreas pouco extensas, com prurido escasso.
A espirometria após 7 meses de tratamento com dupilumab mostrou uma melhoria muito significativa, com FEV1=109% (2,73L), FVC=115% (3,37L), FEV1/FVC=81% e prova de broncodilatação negativa - Figura 2c.
DISCUSSÃO/CONCLUSÕES
Reporta-se um caso de uma doente com dermatite atópica grave, asma grave e rinite alérgicas, com sensibilização para múltiplos aeroalergénios e alimentos, que iniciou terapêutica com dupilumab revelando uma melhoria muito significativa do eczema e da asma, evidenciada por ausência de sintomas brônquicos atuais e normalização das provas funcionais respiratórias. Do mesmo modo, apresentava várias sensibilizações para alergénios alimentares, com clínica para a ingestão de ovo, que atualmente tolera. Desta forma, apresenta-se um caso de sucesso do tratamento com dupilumab para múltiplas doenças alérgicas, anteriormente dependente de corticoterapia sistémica, com um impacto muito negativo na sua qualidade de vida.
Um ensaio de fase 3 que avaliou a eficácia do dupilumab no tratamento de dermatite atópica em adolescentes com comorbilidades alérgicas mostrou resultados favoráveis nos sintomas de asma, rinite alérgica e diminuição da IgE para alergénios alimentares12. Estão atualmente ainda a decorrer ensaios clínicos que visam mostrar diretamente a efetividade do dupilumab no tratamento da alergia alimentar13,14.
Do nosso conhecimento, estão apenas reportados dois casos de sucesso terapêutico com dupilumab na aquisição de tolerância alimentar e, como tal, o presente caso pode servir como um dado adicional a favor da sua utilização para esta finalidade15,16.
Este caso apoia a eficácia do dupilumab no tratamento da asma grave (ainda não comparticipado em Portugal para esta finalidade) e também na aquisição de tolerância no caso de alergia alimentar, constituindo esta última uma patologia com opções terapêuticas ainda limitadas.