INTRODUÇÃO
Uma percentagem significativa da população atópica encontra-se sensibilizada a fungos e a exposição a alergénios fúngicos em asmáticos sensibilizados tem sido relacionada com exacerbações da doença, necessidades terapêuticas aumentadas e mortalidade por asma1,2. A aspergilose broncopulmonar alérgica (ABPA) foi descrita em 1952 por Hinson et al. no Reino Unido, sendo uma doença alérgica respiratória observada em 1-2% dos doentes com asma de longa duração e também em 2-15% dos doentes com fibrose quística (FQ)3-6. Agarwal R. et al. classificou em 2013 a ABPA como sendo uma doença pulmonar imunológica causada por uma hipersensibilidade ao Aspergillus fumigatus, manifestando-se com uma asma mal controlada, infiltrados pulmonares recorrentes e bronquiectasias.
O diagnóstico de ABPA, segundo os critérios propostos, é estabelecido na evidência de uma IgE total elevada (>1000 IU/ml), IgE específica para A. fumigatus elevada (>0,35 kUA/L) e dois dos seguintes critérios: presença de precipitinas para A. fumigatus, opacidades na radiografia de tórax (fixas ou transitórias), eosinofilia no sangue periférico (>1000 células/μl), bronquiectasias na tomografia computorizada de alta resolução (TCAR)7.
Níveis séricos elevados de anticorpos específicos para o A. fumigatus (sIgE e sIgG) são considerados um bom marcador diagnóstico de ABPA por permitirem confirmar tanto a sensibilização como o nível de exposição atual do doente4,8.
Fatores dependentes da exposição ambiental, predisposição genética, defeitos na função mucociliar, bem como patologia pulmonar coexistente, predispõem ao desenvolvimento de ABPA5,9. Alguns doentes podem desenvolver uma síndrome semelhante à ABPA, mas originada pela sensibilização a outros fungos, situação reconhecida como micose broncopulmonar alérgica (MBPA). Em casos mais graves, a ABPA pode evoluir para fibrose pulmonar e insuficiência respiratória.
A suspeita clínica de ABPA deve levar a um diagnóstico baseado em dados clínicos, laboratoriais (i.e. IgE específica) e imagiológicos, já que um reconhecimento precoce e tratamento adequado pode prevenir a sua progressão para fibrose pulmonar5,10,11. Uma outra patologia pulmonar que se associa à presença de anticorpos específicos para o A. fumigatus é o aspergiloma pulmonar. Esta patologia surge no seguimento da colonização de uma cavidade pulmonar única com uma bola fúngica de A. fumigatus no seu interior, originando um micetoma, geralmente em doentes não imunodeprimidos, não atópicos e com doença pulmonar prévia12,13.
Esporos fúngicos são detetáveis no ambiente exterior e interior, sendo cada vez mais reconhecidos como um fator relevante no desenvolvimento da asma alérgica2,5,12. Tradicionalmente, o diagnóstico da alergia a fungos baseia-se na história clínica, associada a testes in vivo (e.g. testes cutâneos por picada) e quantificação de IgE específica. Contudo, os extratos totais de diferentes fungos variam muito entre si, pelo que a precisão e fiabilidade dos testes diagnósticos depende da qualidade desses extratos e, pela mesma razão, a correlação entre testes cutâneos e serológicos é limitada na alergia a fungos14. Os extratos naturais representam uma mistura indefinida de alergénios e materiais não alergénicos, passando apenas após a sua extração por um processo de remoção de lípidos e resíduos15. Devido à reatividade cruzada entre alergénios de diferentes fungos, a reatividade in vivo ou in vitro a extratos totais de A. fumigatus nem sempre indicará uma sensibilização genuína a esse fungo16,17.
Mais recentemente, componentes alergénicos purificados ou produzidos como proteínas recombinantes têm sido progressivamente introduzidos no diagnóstico das doenças alérgicas, particularmente na avaliação de doentes polissensibilizados18,19.
Entre as 23 proteínas alergénicas do A. fumigatus já identificadas, é possível atualmente avaliar a reatividade da IgE e de IgG para cinco desses componentes (rAsp f 1, f 2, f 3, f 4 e f 6), sendo que vários perfis diferentes de sensibilização têm sido associados à ABPA, com ou sem FQ, e aos doentes com asma e sensibilização a A. fumigatus4,20. No entanto, a relevância clínica desses perfis de sensibilização é ainda hoje controversa, uma vez que perfis diferentes têm sido descritos em grupos diagnósticos diferentes e em zonas geograficamente distintas21,22.
O objetivo deste estudo foi avaliar a sensibilização aos componentes purificados do A. fumigatus, quantificando anticorpos específicos para os mesmos no soro de doentes com ABPA ou com asma e sensibilização a fungos, usando como comparadores doentes com asma alérgica não sensibilizados a fungos, doentes com FQ sem critérios de ABPA e doentes com aspergiloma pulmonar.
MÉTODOS
Desenho do estudo
Avaliação transversal de 57 doentes seguidos em ambulatório num hospital central universitário, com diagnóstico prévio por médico especialista (imunoalergologia e/ou pneumologia) de ABPA (n=13), FQ sem critérios de ABPA (n=9), asma com sensibilização a fungos (ASF, n=10), asma alérgica sem sensibilização a fungos (AA, n=18) e aspergiloma (n=7).
Treze doentes preenchiam os critérios diagnósticos de Agarwal para ABPA seropositiva7. Os 10 doentes com ASF tinham diagnóstico de asma e evidência de IgE positiva (>0,35 kUA/l) para, pelo menos, um fungo (entre Aspergillus fumigatus, Alternaria alternata, Cladosporium herbarum e Penicillium spp), por testes cutâneos prick e/ou determinação sérica de IgE específica. Os 18 doentes com diagnóstico de AA apresentavam testes cutâneos prick e/ou determinação de IgE específica positiva para, pelo menos, um alergénio inalante, excluindo fungos. A ausência de sensibilização a aeroalergénios fúngicos foi também confirmada por IgE específica negativa (<0,35 kUA/L) para uma mistura dos alergénios fúngicos referidos (mx1). Nove doentes tinham o diagnóstico de FQ, sem critérios de ABPA, e sete tinham diagnóstico de aspergiloma. As características dos doentes incluídos estão descritas no Quadro 1. Todas as amostras séricas analisadas foram obtidas por conveniência aquando de colheitas de sangue realizadas no decurso de avaliação diagnóstica ou de seguimento dos doentes avaliados, pelo que em algumas amostras não foi possível ter volume suficiente para todas as determinações. Determinação de IgE e IgG específica para antigénios fúngicos
Foram quantificadas as concentrações séricas de IgE total, IgE e IgG específica para A. fumigatus (m3) e monocomponentes (rAsp f ) por ensaio imunoenzimático fluorométrico (CAP-FEIA, Thermo-Fisher®), seguindo as instruções do fabricante. Resumidamente, o antigénio de interesse, ligado covalentemente a um polímero de celulose tridimensional, reage com a IgE ou IgG específica do soro, previamente diluído, de cada doente. Após a incubação com diluições apropriadas da amostra e da remoção, por lavagem, dos anticorpos não específicos que não
se ligaram, é adicionado um imunossoro anti-IgE ou anti-IgG marcado com uma enzima. Depois de uma nova incubação e lavagens adicionais, é adicionado um substrato e a fluorescência no eluído é medida. A resposta em cada amostra é diretamente comparada com calibradores IgE (kUA/L) ou IgG (mgA/L).
Quadro 1 Características demográficas e quantificação de IgE, IgG, IgE e IgG específicas para o Aspergillus fumigatus (m3), expressos em mediana (min./máx.)
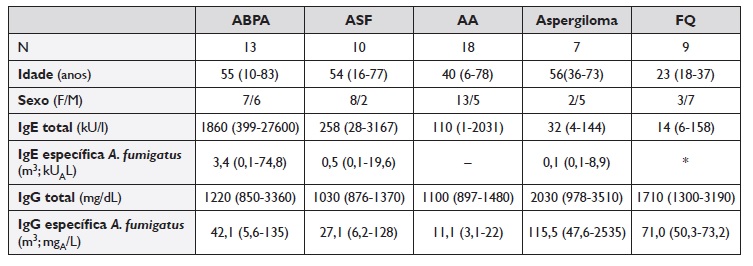
* Só um paciente com 10,2 kUA/L os restantes <0,10 kUA/L
ABPA - Aspergilose broncopulmonar alérgica; ASF - Asma com sensibilização a fungos; AA - Asma alérgica sem sensibilização a fungos; FQ - Fibrose quística
Foram quantificados os anticorpos específicos para uma mistura de extratos totais de fungos (mx1 - Penicillium chrysogenum, Cladosporium herbarum, Aspergillus fumigatus, Alternaria alternata), para um extrato total purificado de A. fumigatus (m3), bem como para cinco dos seus monocomponentes antigénicos recombinantes intracelulares (rAsp f 1, rAsp f 2, rAsp f 3) e excretados (rAsp f 4 e rAsp f 6): rAsp f 1 (proteína major com 18 KD pertencente à família de mitogilina das citotoxinas), rAsp f 2 (proteína de ligação ao fibrinogénio com 310 resíduos de aminoácidos) e rAsp f 3 (proteína peroxisomal com 18,45KD), rAsp f 4 (proteína intracelular com 30,04KD, cuja função bioquímica não está definida) e rAsp f 6 (enzima superóxido dismutase de manganês).
Os níveis de IgE específica para os rAsp f foram considerados como indicando ausência de sensibilização se <0,10 kUA/L, o limite de quantificação para o qual o imunoensaio utilizado foi otimizado23. A IgG específica para o A. fumigatus (m3) foi considerada positiva para níveis >20 mgA/L22.
Análise estatística
A análise descritiva das variáveis é apresentada, exceto quando referido, como mediana e intervalo interquartil (IQR). A significância das diferenças das variáveis contínuas entre grupos ou no mesmo grupo (no caso dos monocomponentes) foi avaliada por testes não paramétricos (testes de Mann-Whitney ou de Wilcoxon) e as diferenças de distribuição de variáveis categóricas pelo teste de Qui2, com correção de Yates (pc). A associação entre variáveis foi avaliada pela correlação de Spearman.
Os dados colhidos foram analisados com o programa SPSS versão 20.0 para Windows.
RESULTADOS
IgE específica para o Aspergillus fumigatus e monocomponentes recombinantes
Os níveis de IgE total e específica para A. fumigatus (m3) foram mais elevados no grupo com ABPA, de acordo com a definição dos grupos selecionados neste estudo. A IgE específica para o extrato total de A. fumigatus (m3) foi positiva (≥ 0,35kUA/L) em 11 de 13 (85%) com ABPA, 6 de 10 (60%) do grupo ASF e 2 de 7 (29%) dos doentes com aspergiloma e 1 dos 9 de doentes com FQ (Quadro 1).
Nestes quatro grupos (sensibilizados a fungos), os doentes com ABPA foram também os que apresentaram globalmente níveis séricos mais elevados de IgE específica para os diferentes rAsp f (Figura 1 , Quadro 2).
Na ABPA, os níveis de IgE para o extrato total de A. fumigatus (m3) correlacionaram-se significativamente com os de cada um dos monocomponentes rAsp f avaliados, verificando-se uma correlação elevada entre os componentes que correspondem a antigénios excretados (rAsp f 1 / rAsp f 3, r=0,725, p=0,012) e moderada para os componentes intracelulares (rAsp f 4 / rAsp f 6, r=0,626, p=0,039). Os níveis de IgE específica para rAsp f 6 (4,3; 0,1-0,3 kUA/L) foram mais baixos e significativamente inferiores aos dos componentes excretados - rAsp f 1 (45,3; 0,2-33,7kUA/L; p=0,041) e rAsp f 3 (23,8; 1,0-48,1kUA/L; p=0,028).
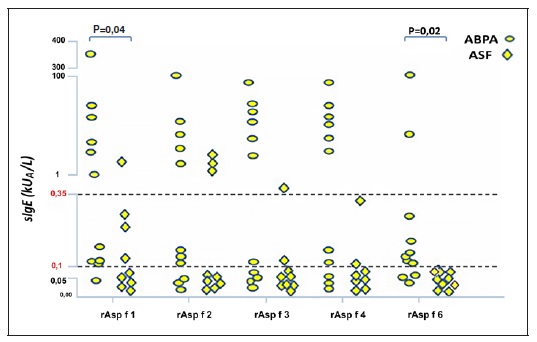
Figura 1 Resultados da IgE específica para os diferentes alergénios do Aspergillus fumigatus (rAsp f, kUA/L) nos doentes com aspergilose broncopulmonar alérgica (ABPA) e asma com sensibilização a fungos (ASF)
Quadro 2 Positividade da IgE específica para os diferentes alergénios do Aspergillus fumigatus (rAsp f ) nos três grupos sensibilizados e que realizaram todas as determinações. A positividade (%) está representada a dois níveis (>0,10 e >0,35 kUA/L).
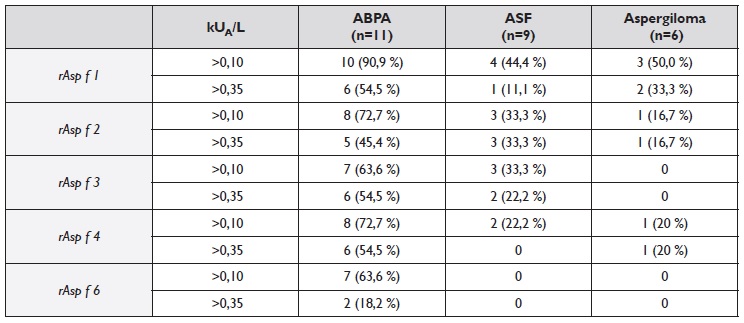
ABPA - Aspergilose broncopulmonar alérgica; ASF - Asma com sensibilização a fungos.
O grupo com ABPA diferiu da ASF por um maior número de casos positivos ao rAsp f 6 (64% versus 0% Qui2=6,2, pc=0,013) e níveis séricos mais elevados (p=0,02; Figura 1), verificando-se também uma tendência para maior positividade ao rAsp f 4 (73% versus 22% Qui2= 3,2, pc =0,072) e rAsp f 1 (91% versus 44%, Qui2=3,12, pc =0,077). Quanto à IgE para rAsp f 1 (o componente mais frequentemente positivo nas nossas amostras), os níveis séricos foram significativamente mais elevados na ABPA do que na ASF (45,3; 0,2-33,7kUA/L versus 0,3; 0,1-0,3kUA/L, p=0,041). IgG específica para o Aspergillus fumigatus e monocomponentes recombinantes
Os níveis de IgG para A. fumigatus (m3) (Quadro 1) foram significativamente diferentes entre os grupos (p=0,002), também como esperado pela definição das amostras selecionadas. Assim, os níveis mais elevados de IgG para o extrato total de A. fumigatus (m3) verificaram-se no grupo-controlo com aspergiloma (mediana 115,5 mg/dL, p<0,02 todas as comparações) e os mais baixos na AA (mediana 11,1 mg/dL, p<0,01 todas as comparações). A IgG específica para A. fumigatus (m3) apresentou-se também globalmente positiva no grupo com ABPA, ASF e na FQ (Quadro 1), não diferindo significativamente entre estes três grupos de doentes.
Quanto aos níveis séricos de IgG para os diferentes componentes rAsp f (Quadro 3), a reatividade ao rAsp f 1 foi significativamente mais elevada comparativamente com os outros componentes, seguindo-se o rAsp f 2, como sendo o segundo antigénio com níveis mais elevados de IgG específica em qualquer dos grupos com ABPA, ASF, aspergiloma e FQ. No entanto, os níveis de IgG específica para os diferentes rAsp f testados não diferiram significativamente entre os grupos ABPA, ASF, FQ e aspergiloma.
DISCUSSÃO
Neste estudo transversal de 57 doentes com patologia respiratória que frequentemente se associa a sensibilização ao A. fumigatus podemos verificar que a avaliação da IgE específica para alguns dos seus antigénios excretados (rAsp f 1) e intracelulares (rAsp f 6) parece útil na caracterização serológica da ABPA. Assim, a positividade IgE para rAsp f 6 é significativamente superior na ABPA em comparação à da asma alérgica com sensibilização a fungos. Do mesmo modo, os níveis de IgE para rAsp f 1 apresentam-se significativamente mais elevados na ABPA; nos doentes com ASF, a maioria dos casos com sIgE positiva para rAsp f 1 tinham níveis relativamente baixos (entre 0,11 e 0,35kUA/L, Quadro 2).
Quadro 3 IgG específica para o extrato total (m3,mgA/L) e para os diferentes alergénios do Aspergillus fumigatus (rAsp f, mgA/L) em doentes com aspergilose broncopulmonar alérgica (ABPA), asma com sensibilização a fungos (ASF), aspergiloma e fibrose quística (FQ), expressos em mediana (min./máx.) do número (n) de amostras quantificadas para todos os componentes.
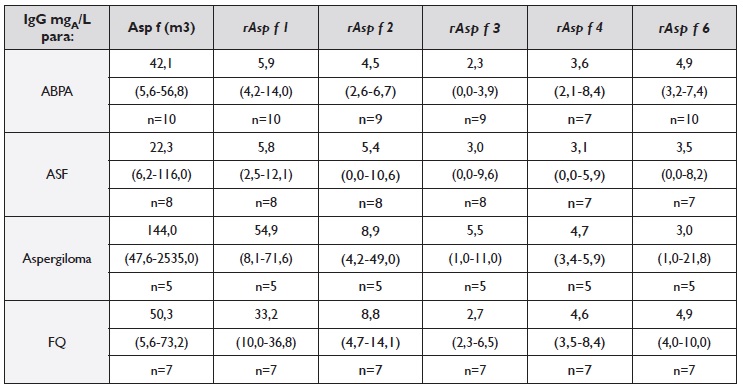
Quanto à sensibilização IgG para o A. fumigatus (m3), os seus níveis são significativamente mais elevados no aspergiloma e baixos na AA e globalmente positivos e semelhantes nos outros três grupos de doentes, traduzindo provavelmente a exposição frequente a este fungo nas patologias respiratórias incluídas. Apesar de no grupo com ASF os valores de sIgG para A. fumigatus serem relativamente mais elevados do que no grupo AA (Quadro 1), os seus valores medianos (27 mgA/L) encontram-se ainda dentro de valores de referência obtidos em diferentes estudos, avaliando, como grupos-controlo, quer dadores de sangue quer doentes respiratórios sem aspergilose22,24. Já a IgG específica para os diferentes componentes rAsp f, sendo mais elevada para o rAsp f 1 e rAsp f 2, não parece oferecer melhor discriminação diagnóstica que a IgG para o extrato total do A. fumigatus (m3).
Estes resultados estão em consonância com os obtidos num dos estudos iniciais realizados por Crameri R et al25, no qual avaliaram a diferente resposta serológica de 60 asmáticos sensibilizados para A. fumigatus com ABPA e 40 asmáticos sem ABPA, face aos mesmos alergénios recombinantes.
Nos resultados verificaram que os alergénios major rAsp f 1 e rAsp f 3 são reconhecidos por ambos os grupos com elevada incidência, em contraste com rAsp f 4 e rAsp f 6, reconhecidos exclusivamente pelos doentes com ABPA. Em estudos subsequentes4,20, os mesmos investigadores avaliaram doentes com FQ com ABPA, um grupo geograficamente mais alargado de doentes com asma e sensibilização a A. fumigatus, bem como controlos normais; os resultados reforçaram a positividade a rAsp f 1 e rAsp f 3 como marcadores de sensibilização IgE e a positividade a rAsp f 4 e rAsp f 6 mostrou-se relevante no serodiagnóstico da ABPA. Em contraste com estes estudos, Kurup VP et al, avaliando o diagnóstico de ABPA no contexto de FQ21,26, concluem que, apesar de uma resposta IgE um pouco mais elevada para rAsp f 3, nenhum dos monocomponentes testados foi capaz de diferenciar a FQ com ABPA de outros doentes com FQ. Já um estudo alargado de casos de ABPA e de asma sensibilizados ao A. fumigatus no Japão (306 doentes), recentemente publicado27,28, sugere que a IgE específica para rAsp f 1 (como no presente estudo) e rAsp f 2 efetivamente diferenciam as duas populações, podendo ser considerados como marcadores genuínos de sensibilização a A. fumigatus na ABPA.
Os resultados descritos em populações de áreas geográficas diferentes e patologias diversas (i.e., com ou sem FQ) têm-se mostrado inconsistentes. Uma revisão sistemática recente29 concluiu, a partir de 17 estudos e 1131 doentes, que, em doentes com asma, a sensibilidade para o diagnóstico de ABPA é melhor para a combinação de sIgE para rAsp f 1 ou rAsp f 3, mas a especificidade associa-se melhor à positividade ao rAsp f 4 ou rAsp f 6. A resposta imunológica mais específica a estas duas últimas proteínas intracelulares em indivíduos asmáticos com ABPA poderá dever-se ao facto de não se apresentarem como aeroalergénios, em contraste com o que acontece nos asmáticos sensibilizados a fungos, já que na ABPA a colonização das vias aéreas pelo fungo e a subsequente reação imunológica poderá resultar a destruição das estruturas fúngicas e exposição subsequente a estes antigénios intracelulares23.
Assim, a avaliação da resposta IgE para monocomponentes do A. fumigatus, particularmente para os seus antigénios excretados (rAsp f1/rAsp f3) versus os intracelulares (rAsp f 4/rAsp f 6), parece útil na caracterização serológica da ABPA. O uso dos alergénios recombinantes permitirá também contornar e distinguir a reatividade cruzada entre alergénios de diferentes fungos (Alternaria alternata, Cladosporium herbarum, Trichophyton rubrum, Malassezia spp.) dos casos especificamente sensibilizados ao Aspergillus fumigatus (“verdadeiras” sensibilizações)23.
Por outro lado, os níveis séricos de IgG para os rAsp f não distinguem os diferentes grupos de doentes sensibilizados, não melhorando a discriminação diagnóstica da IgG para o extrato total do A. fumigatus (m3).
Este estudo transversal apresenta algumas limitações, como seja amostragem de conveniência (as colheitas de amostras foram realizadas para apoio diagnóstico ou de seguimento e estabelecidas pelo médico especialista assistente), não tendo sido consideradas a fase de evolução ou de tratamento das doenças, aspetos que podem influenciar os níveis de anticorpos séricos específicos. Pelo mesmo motivo, também em alguns casos pontuais não foi possível ter volume suficiente para todas as determinações (ex. IgG).
No entanto, salienta-se que a nossa amostragem, comparativamente com as dos outros estudos, agrega uma diversidade de patologias respiratórias associadas ao A. fumigatus habitualmente observada em cuidados terciários, com doentes seguidos por equipas multidisciplinares e especializadas. A classificação diagnóstica foi revista por dois dos autores, médicos especialistas na área, por consulta dos registos clínicos, não tendo em conta os resultados da presente investigação dos monocomponentes rAsp f.
Utilizámos também neste trabalho um tipo de imunoensaio semiautomático (ImmunoCAPTM) e com reagentes disponíveis comercialmente, cuja calibração, otimização e reprodutibilidade está bem estabelecida em publicações anteriores22. Os alergénios recombinantes testados, para IgE e IgG específicas, são também mais estandardizáveis do que os obtidos de extratos nativos, podendo ser preparados de uma forma consistente em grandes volumes e utilizáveis em equipamentos automatizáveis30.
A utilidade da caracterização laboratorial dos componentes alergénicos do A. fumigatus deverá ser explorada em estudos longitudinais, envolvendo maior número de doentes, para que seja possível avaliar a sua relevância na deteção de exacerbações e melhor estabelecer critérios de resposta terapêutica numa doença crónica e debilitante como a ABPA.