INTRODUÇÃO
As doenças alérgicas crónicas são consideradas um problema de saúde pública devido à sua elevada prevalência mundial. Segundo a Organização Mundial de Saúde (OMS), aproximadamente 35% da população mundial sofre de doenças alérgicas respiratórias, como são exemplo a asma e a rinite1. Aproximadamente 80% dos indivíduos com asma têm rinite e cerca de 10 a 40% dos doentes com rinite desenvolvem asma2,3.
Na história natural da doença alérgica respiratória, a rinite precede frequentemente o aparecimento da asma e dificulta o seu controlo4,5. A conjuntivite alérgica está também frequentemente associada à rinite e à asma, sem do uma característica relevante na classificação dos indivíduos com doença respiratória alérgica6; os sintomas mais característicos são o prurido ocular, lacrimejo e a hiperemia conjuntival7. Quando não estão devidamente controladas, estas doenças reduzem drasticamente a qualidade de vida dos doentes e dos seus familiares e acarretam elevados custos de saúde (custos diretos) e maior absentismo laboral (custos indiretos). O impacto na qualidade de vida é tanto maior quanto pior for o controlo da doença8.
Deste modo as recomendações internacionais do Allergic Rhinitis and its Impact on Asthma (ARIA) reforçam a necessidade de abordar concomitantemente a asma e a
rinite (AR) alérgica, destacam como objetivo primário da terapêutica o controlo otimizado da AR alérgica e salientam a necessidade de instrumentos que avaliem simultaneamente o controlo das duas doenças9,10.
Os pilares do tratamento da doença alérgica respiratória são a evicção alergénica (quando possível), a terapêutica farmacológica e a imunoterapia com alergénios (ITA)9,11. A ITA exige uma administração periódica do extrato alergénico ao doente, com o objetivo de aumentar a tolerância clínica e, consequentemente, reduzir os sintomas após exposição e a necessidade de utilização de medicamentos para alívio dos sintomas. Embora, à data, a ITA seja o único tratamento capaz de alterar a história natural da doença alérgica e de prevenir o aparecimento de asma, estima‑se que apenas seja utilizada em 10% dos doentes com rinite alérgica ou asma12. Em Portugal estima‑se que apenas 5% do total de doentes seja tratado com ITA13. Esta subutilização acontece principalmente por dificuldades no acesso à ITA, dados insuficientes de custo‑beneficio, dúvidas do setor da saúde sobre a sua eficácia, entre outros12.
Existem duas vias de administração aprovadas para a ITA, a subcutânea e a sublingual. A via subcutânea, utilizada há muitas décadas, é a via preferencialmente usada em Portugal13,14, possivelmente devido ao seu menor custo e à melhor adesão/persistência de tratamento, mas também devido à sua eficácia, comprovada na redução de sintomas e da necessidade de utilização de medicamentos para alívio dos sintomas11,15,16. A maioria dos autores recomenda um período de tratamento de 3 a 5 anos13,14,17. Este tratamento não é, contudo, isento de riscos; embora as reações adversas em doentes sob tratamento com ITA subcutânea (ITSC) sejam principalmente locais (edema, eritema, prurido), é possível a rara ocorrência de reações sistémicas12,13.
A ITSC tem, contudo, outras desvantagens, nomeadamente a via de administração ser a injetável e a necessidade de deslocação a uma unidade de saúde para a sua administração11.
Sendo um tratamento longo, com risco de reacções adversas e poucos dados que comprovem o seu custo‑beneficio, torna‑se fundamental haver estudos de vida real que aumentem o conhecimento sobre o estado e a evolução destes doentes, nomeadamente no que respeita ao controlo da sua doença alérgica. Desta forma, foi objetivo deste trabalho efetuar uma avaliação de vida real acerca do controlo da doença alérgica em indivíduos sob tratamento com ITSC.
MATERIAL E MÉTODOS
Desenho do estudo
Estudo descritivo que analisou os registos efetuados no contexto da administração de ITSC nas unidades de Imunoalergologia do Hospital e Instituto CUF‑Porto.
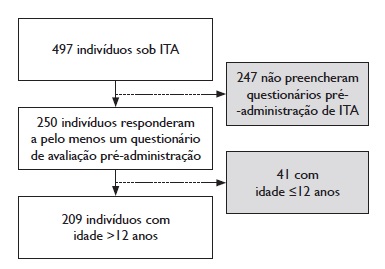
Este estudo engloba os dados recolhidos na prática clínica de rotina entre março de 2017 e junho de 2019. Durante este período foi administrada ITSC a 497 indivíduos, dos quais 412 tinham mais de 12 anos.
Participantes
Foram incluídos nesta análise todos os indivíduos que responderam, pelo menos uma vez, ao questionário de auto‑preenchimento para avaliação prévia à administração da ITSC em uso na unidade (n=250) e que tinham idade superior a 12 anos (n=209) (Figura 1). Foi incluída na análise apenas a avaliação mais recente de cada indivíduo.
Recolha de dados
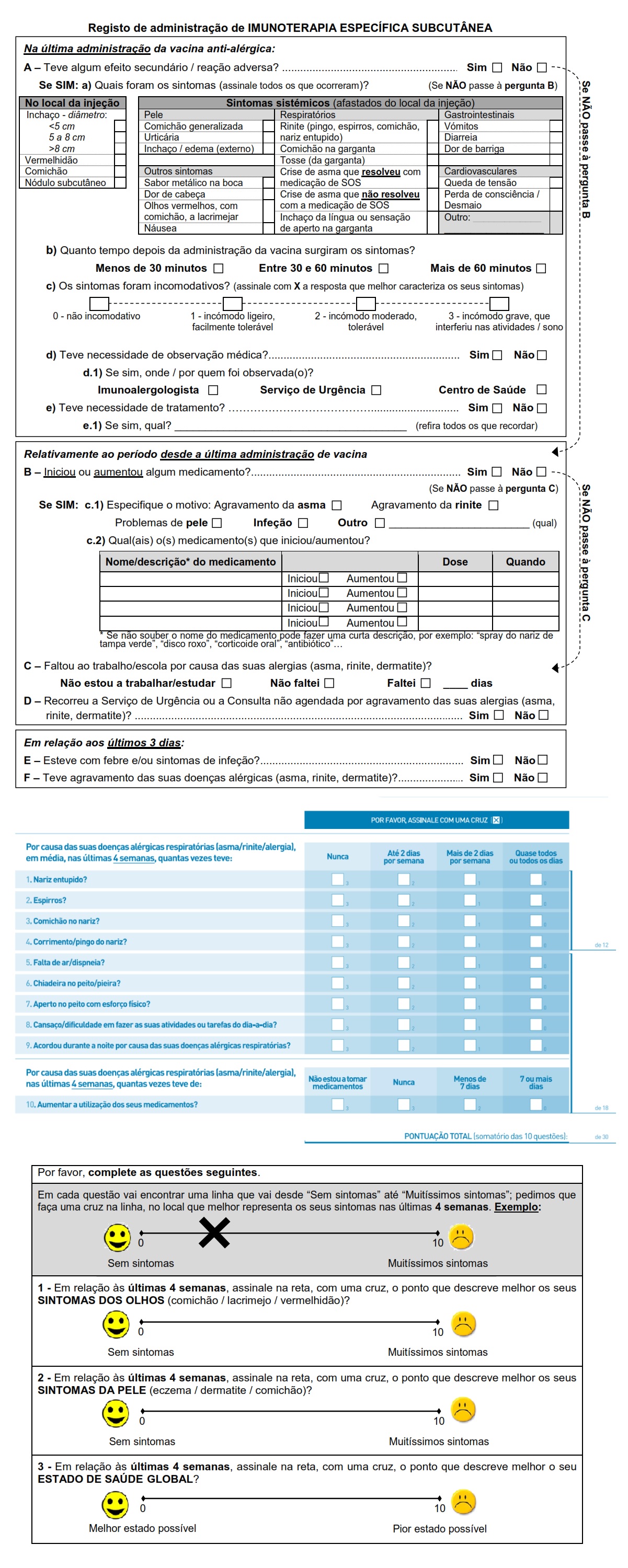
O questionário de avaliação prévia à administração da ITSC é recolhido presencialmente com o objetivo de registar de forma estruturada os aspetos relacionados com as condições para uma administração segura da ITSC.
Este questionário avalia, entre outros, o controlo da asma e da rinite alérgica através do teste de controlo da asma e rinite alérgica (CARAT) e os sintomas oculares (prurido, lacrimejo, vermelhidão) através de uma escala visual analógica (EVA) (Anexo I).
Instrumentos de avaliação
O CARAT é constituído por dez questões (sete sobre a frequência de sintomas, uma sobre perturbações no sono, uma sobre limitações nas atividades diárias e uma sobre a necessidade de alterar a medicação previamente prescrita) referentes às quatro semanas anteriores. As questões são respondidas numa escala de Likert com 4 pontos, sendo que a pontuação total do CARAT (CARATT) varia entre 0 e 30 pontos. O 0 corresponde à ausência total de controlo e 30 a um controlo exímio da doença.
Uma pontuação superior a 24 corresponde a um controlo global da doença. O CARAT pode ainda ser dividido em pontuações parciais que nos permitem avaliar os sintomas das vias aéreas superiores (VAS) e das vias aéreas inferiores (VAI); pontuações superiores a 8 no somatório das questões 1 a 4 estão associadas a controlo das VAS e pontuações maiores ou iguais a 16 no somatório das questões 5 a 10 correspondem a controlo das VAI18.
As EVA são ferramentas simples muito utilizadas na prática clínica para avaliar quantitativamente a gravidade dos sintomas e, consequentemente, o controlo da doença9,19.
A EVA de sintomas oculares utilizada é composta por uma reta com 10 cm de comprimento, onde os doentes devem assinalar o ponto que melhor representa os seus sintomas (comichão, lacrimejo, vermelhidão) nas últimas quatro semanas, sendo que o 0 corresponde a uma ausência de sintomas e o 10 ao máximo de sintomas. A distância entre 0 (ausência de sintomas) e o ponto assinalado pelo doente é medida e registada em centímetros19.
Análise estatística
A análise estatística foi feita utilizando o programa SPSS (IBM® SPSS, Chicago, IL, Estados Unidos da América), versão 26.
Foram usadas medidas descritivas adequadas aos vários tipos de variáveis, incluindo frequência absoluta e relativa (variáveis categóricas), médias e desvios-padrão (DP; variáveis contínuas com distribuição normal) e medianas e variação interquartil (variáveis contínuas com distribuição não normal).
As associações entre os resultados do CARAT (total e pontuações parciais) e a duração do tratamento com ITSC foram calculadas usando a correlação de Spearman e representadas através de coeficientes de correlação.
A comparação das proporções de controlo entre diferentes grupos foi feita usando o teste de qui-quadrado; um p<0,05 foi considerado estatisticamente significativo.
RESULTADOS
Foram incluídos 209 indivíduos, 96 (46%) do sexo feminino. A idade média ± DP foi de 27,4±13,3 anos (mínimo: 12; máximo: 83). Dos indivíduos incluídos neste estudo, 62 (30%) tinham menos de 18 anos. Todos tinham rinite alérgica e cerca de um terço (32%, n=67) tinham asma concomitante. Sessenta e nove doentes (34%) estavam no primeiro ano da ITSC e 79 (40%) estavam no terceiro ou mais anos da ITSC. O Quadro 1 caracteriza os doentes incluídos.
Quadro 1 Caracterização dos doentes incluídos, incluindo estratificação por sexo (n=209)
| Total (n=209) | Sexo feminino (n=96; 46%) | Sexo masculino (n=113; 54%) | |||||
|---|---|---|---|---|---|---|---|
| Idade média (DP), anos | 27,4 | (13,3) | 29,9 | (13,5) | 25,3 | (12,9) | |
| <18 anos, n (%) | 62 | (30) | 17 | (18) | 45 | (40) | |
| ≥18 anos, n (%) | 147 | (70) | 79 | (82) | 68 | (60) | |
| Diagnóstico, n (%) | 142 | (68) | 66 | (69) | 76 | (67) | |
| Rinite alérgica isolada | |||||||
| Rinite alérgica + asma | 67 | (32) | 30 | (31) | 37 | (33) | |
| Duração da ITSC, n (%)a | 69 | (34) | 36 | (38) | 33 | (29) | |
| 1 ano | |||||||
| 2 anos | 52 | (26) | 28 | (29) | 24 | (21) | |
| 3 ou mais anos | 79 | (40) | 30 | (31) | 49 | (43) | |
A pontuação média ± DP do CARATT foi de 24,6±4,2 (mínimo: 6; máximo: 30), com 57% (n=119) dos doentes bem controlados. A pontuação do CARATT foi de 25,2±4,0 (média ± DP) no sexo masculino e de 23,8±4,4 no feminino (Figura 2). No que diz respeito à interpretação do CARATT, 63% dos indivíduos do sexo masculino estavam controlados versus 50% dos do sexo feminino.
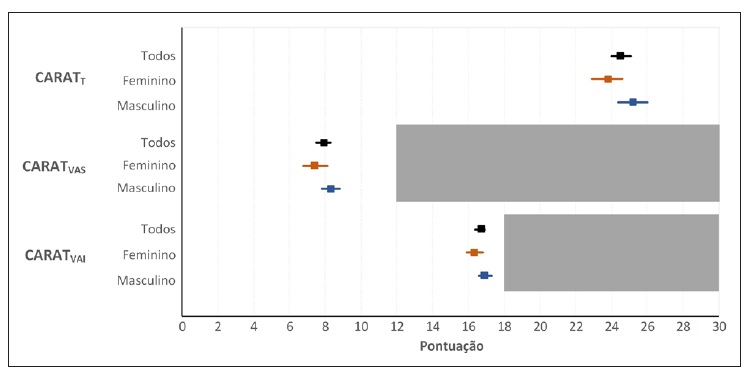
Figura 2 Pontuações médias (intervalo de confiança a 95%) do CARATT, CARATVAS e CARATVAI, incluindo estratificação por sexo
Mais de 80% (n=169) globalmente, e 75% (n=50) dos que têm asma concomitante, apresentavam controlo dos sintomas das VAI, mas apenas 47% (n=98) tinham os sintomas das VAS controlados. A proporção de controlo no sexo masculino foi superior à do sexo feminino, quer no CARATT, CARATVAS e CARATVAI, mas não atingiu significado estatístico. Estratificando por grupo etário, a proporção de indivíduos controlados foi consistentemente superior no grupo com menos de 18 anos, mas também sem que fosse atingido significado estatístico.
A proporção de indivíduos com controlo das VAI foi significativamente maior no grupo a fazer ITSC há pelo menos 3 anos (89% vs. 75% no grupo a fazer ITSC há 1 ou 2 anos; p=0,019); não houve diferenças significativas para a proporção de controlo avaliada pelo CARATT e CARATVAS (Quadro 2).
Quadro 2 Proporção de indivíduos com controlo dos sintomas respiratórios, avaliado pelo CARAT, incluindo estratificação por sexo, faixa etária e duração do tratamento com ITSC
| Controlo dos sintomas respiratórios | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| CARATT | CARATVAS | CARATVAI | |||||||
| n | % | p | n | % | p | n | % | p | |
| Total | 119 | 56,9 | 98 | 46,9 | 169 | 80,9 | |||
| Sexo | 0,062 | 0,264 | 0,103 | ||||||
| Feminino | 48 | 50,0 | 41 | 42,7 | 73 | 76,0 | |||
| Masculino | 71 | 62,8 | 57 | 50,4 | 96 | 85,0 | |||
| Grupo etário | 0,081 | 0,558 | 0,061 | ||||||
| <18 anos | 41 | 66,1 | 31 | 50,0 | 55 | 88,7 | |||
| ≥18 anos | 78 | 53,1 | 67 | 45,6 | 114 | 77,6 | |||
| Duração de ITSC | 0,818 | 0,578 | 0,019 | ||||||
| 1-2 anos | 70 | 57,9 | 60 | 49,6 | 91 | 75,2 | |||
| ≥ 2 anos | 47 | 59,5 | 36 | 45,6 | 70 | 88,6 | |||
As pontuações do CARATT e CARATVAS não se correlacionaram significativamente com a duração do tratamento com ITSC (r=0,082 e - 0,011, respetivamente); no entanto, a pontuação do CARATVAI apresentou uma correlação significativa positiva com a duração deste tratamento (r=0,203, p=0,004) (Figura 3).
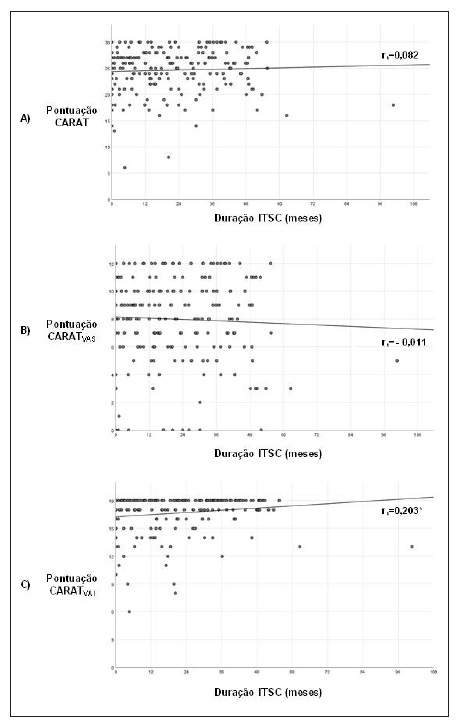
Figura 3 Correlação entre a duração da ITSC e a pontuação do A) CARATT, B) CARATVAS e C) CARATVAI. ITSC - imunoterapia com alergénios subcutânea; rs - Spearman coefficient
A pontuação mediana (intervalo interquartil, IIQ) da EVA de sintomas oculares foi de 0,3(0,8)cm. Setenta e nove por cento (n=164) dos participantes tiveram pontuação inferior a 1 cm e 11% (n=24) superior a 5 cm.
A proporção de indivíduos com pontuação superior a 5 cm não foi significativamente diferente entre os que têm sintomas das VAS controlados e não controlados (13% versus 10%, respetivamente; p=0,392).
DISCUSSÃO
O CARAT é o único questionário disponível à data que avalia concomitantemente o controlo dos sintomas nasais e brônquicos, permitindo fazer uma avaliação global da doença alérgica respiratória (asma, rinite). Neste estudo, mais de metade dos participantes a fazer tratamento com ITSC tinham bom controlo global da doença alérgica respiratória; cerca de – tinham a asma controlada, mas menos de metade tinha a rinite controlada. A proporção de controlo das VAI foi significativamente superior nos doentes a fazer ITSC há três anos, mas não se associou ao sexo ou grupo etário. A pontuação do CARATVAI apresentou uma correlação positiva significativa com a duração do tratamento com ITSC; as pontuações do CARATT e CARATVAS, por sua vez, não se correlacionaram significativamente com a duração da ITSC.
Poucos estudos anteriores realizados em Portugal avaliaram o controlo ou gravidade da doença alérgica respiratória em doentes sob tratamento com ITA. Um estudo realizado em 201020, usando o questionário ACT para avaliação do controlo da asma em indivíduos sob ITA, não encontrou diferença significativa em relação a um grupo de comparação incluindo indivíduos apenas sob farmacoterapia, apesar de os indivíduos sob ITA apresentarem outros sinais de melhoria da doença respiratória, nomeadamente com redução da necessidade de corticóides sistémicos e de recursos ao serviço de urgência; no entanto, nesse estudo, não foi avaliado o controlo da rinite. Um outro estudo retrospetivo, realizado em 200721, mostrou que os indivíduos sob ITA há pelo menos um ano apresentam uma evolução mais favorável do ponto de vista da gravidade e necessidade de farmacoterapia para a asma e rinite do que os não atópicos ou do que os atópicos não tratados com ITA. No entanto, este estudo não incluiu uma avaliação formal do controlo da asma e/ou rinite.
O controlo global da doença alérgica respiratória, neste estudo, avaliado pelo CARAT, foi superior ao que está descrito na literatura em contextos semelhantes.
Estudos em consulta de cuidados primários ou secundários, em Portugal, incluindo indivíduos com asma e rinite, mostraram uma proporção de controlo entre os 3% e os 19%2, incluindo durante a gravidez4,22. No presente estudo, em doentes a fazer tratamento com ITSC, mais de metade tinham bom controlo global da doença alérgica respiratória. Esta proporção de controlo está dentro do mesmo valor reportado no estudo INAsma, de base populacional23.
Esta maior proximidade com os valores de controlo reportados num estudo populacional, que presumivelmente inclui indivíduos com doença mais ligeira, sugere uma possível redução da gravidade da doença alérgica relacionada com o tratamento com ITSC. No entanto, na ausência de informação sobre o nível de controlo, gravidade e tratamento prévios ao início de ITSC, não podemos excluir, apesar de pouco provável, tendo em conta a indicação para ITSC (recomendada em caso de rinite moderada‑grave não controlada com os tratamentos standard), que no nosso estudo a doença respiratória fosse mais ligeira do que nos outros estudos referidos.
O controlo da asma foi superior ao da rinite. Estes resultados estão também de acordo com estudos anteriores, em que a proporção de indivíduos com mau controlo da rinite foi consistentemente superior à de indivíduos com mau controlo da asma2,4,22. Esta diferença no controlo poderá relacionar‑se com diferenças na gravidade das patologias, com maior gravidade da rinite em relação à asma. No presente estudo esta possibilidade é particularmente relevante pelo facto de o tratamento com ITSC estar primariamente indicado para o tratamento da rinite alérgica moderada‑grave e só recentemente a ITA sublingual (mas não a ITSC) ter passado a estar incluída como opção terapêutica recomendada no Global Initiative for Asthma (GINA) em indivíduos com asma24. Adicionalmente, é possível que haja uma maior desvalorização dos sintomas nasais pelos doentes, em relação com uma
menor perceção de impacto (versus os sintomas da asma), que leva a um menor cumprimento da terapêutica de controlo para a rinite e, consequente, perda de controlo.
Este é o primeiro estudo que reporta dados sobre a correlação das pontuações do CARAT (CARATT, CARATVAS e CARATVAI) com a duração do tratamento com ITSC. O nível de controlo da doença alérgica respiratória tem sido usado como um dos outcomes dos ensaios clínicos de avaliação da eficácia da ITA25‑27.
No entanto, a maioria dos estudos faz apenas uma avaliação formal do controlo da asma (não incluindo a rinite) e não foi demonstrado um efeito claro do tratamento no controlo da doença25,26, apesar de haver evidência de que a ITA pode aumentar o tempo até à primeira exacerbação moderada‑grave25‑27.
Neste estudo, a proporção de controlo dos sintomas das VAI foi significativamente maior nos doentes a fazer ITSC há três anos ou mais e foi observada uma correlação positiva entre o controlo dos sintomas das VAI e a duração da ITSC, suportando um melhor controlo da asma nos doentes que estão a fazer ITSC há mais tempo. Adicionalmente, o facto de esta maior proporção e de a correlação significativa apenas se terem verificado com o CARATVAI e não com o CARATT ou CARATVAS, sugere que esse efeito é mais precoce ou exclusivo nos sintomas das VAI. No entanto, este é um estudo que inclui apenas uma avaliação de cada indivíduo, sem considerar informação adicional em relação as sensibilizações, exacerbações recentes, medicação em curso ou estado prévio ao início da ITSC, o
que poderá interferir com estes resultados e limita a sua interpretação e generalização.
Mais de – dos indivíduos tiveram pontuação inferior a 1 cm na EVA de sintomas oculares, indicando sintomas muito ligeiros ou ausentes no momento da avaliação. Este “bom controlo” dos sintomas oculares contrapõe‑se aos mais de 50% com mau controlo da rinite, especialmente se considerarmos que não houve diferenças significativas no controlo dos sintomas oculares de acordo com o controlo da rinite. A prevalência de sintomas oculares em indivíduos
com rinite é elevada, atingindo mais de 50% em alguns estudos28,29; na rinite moderada‑grave essa associação é ainda mais forte, com a prevalência a ultrapassar os 70%30. No entanto, não é tão clara a relação entre o controlo da rinite e o da conjuntivite. Um estudo recente, baseado em EVA de sintomas nasais e oculares (entre outras), colhidas usando a aplicação móvel Allergy Diary, mostrou uma correlação significativa positiva (> 0,63) entre o controlo da rinite e conjuntivite, sugerindo que a multimorbilidade da asma, rinite e conjuntivite, com mau controlo de todas as patologias, é frequente31. No presente estudo, no entanto, os sintomas oculares foram muito ligeiros em praticamente todos os doentes, apesar de todos terem rinite e cerca de 1/3 ter asma. Esta discrepância pode estar relacionada com caraterísticas de base dos doentes incluídos (por exemplo, ausência de conjuntivite, tipo de sensibilizações, tratamento em curso), mas não é de excluir um possível efeito do tratamento com ITSC. De facto, os estudos existentes têm demonstrado eficácia da ITA também na melhoria dos sintomas oculares32,33.
Dos pontos fortes deste estudo podemos referir o facto de ser inovador, na medida em que utiliza dados da prática clínica de rotina e avalia o controlo da doença alérgica sob o ponto de vista do doente. Tal facto está em consonância com o primado dos cuidados de saúde centrados no doente, em que a participação ativa deste no seu tratamento está associada a melhores resultados em saúde34,35. A participação ativa dos doentes representa conhecimento, confiança e motivação. Outra mais‑valia deste trabalho é o facto de os resultados serem recolhidos com o CARAT, um questionário já validado para autopreenchimento.
Relativamente às limitações, estas são as decorrentes de um estudo descritivo com um pequeno número de doentes e baseado em resultados de uma única avaliação no tempo, o que nos retira a possibilidade de avaliar a variação dos sintomas dos doentes ao longo do tratamento com ITSC. Adicionalmente, temos parte dos resultados colhidos com uma EVA, que, apesar de ser uma ferramenta simples e muito utilizada na prática clínica, ainda suscita dificuldades na interpretação por parte dos doentes. Outra limitação deste estudo é apenas terem sido utilizados os dados recolhidos através do questionário prévio à administração de ITSC em uso nas unidades, sem recurso a mais informação clínica. Seria importante o acesso a outras informações, nomeadamente à classificação da gravidade e persistência da rinite na altura da prescrição de ITSC, à terapêutica em curso, às exacerbações, aos resultados dos testes cutâneos por picada ou IgE específicas para aeroalergénios e à composição da ITSC em curso (como marcador das sensibilizações consideradas mais relevantes clinicamente). Estas duas últimas informações teriam particular relevância para avaliação do risco de sintomas na altura de preenchimento dos questionários (permitindo, por exemplo, reportar especificamente o nível de controlo de doentes sensibilizados a pólenes na altura da primavera).
A necessidade de implementar soluções terapêuticas eficazes e capazes de parar e potencialmente reverter o impacto da doença na saúde é urgente, pelo que são necessários mais estudos de vida real, com avaliação longitudinal por períodos prolongados da relação entre o controlo da doença alérgica e o tratamento com ITA.
CONCLUSÃO
Cerca de 60% dos doentes avaliados apresentaram controlo global da doença alérgica respiratória avaliado pelo CARAT; no entanto, menos de metade tinham a rinite controlada. O controlo dos sintomas das vias aéreas inferiores associou‑se significativamente à duração da ITSC. Apesar da proporção de controlo ser superior às publicadas na literatura para doentes alérgicos, são necessários outros estudos de vida real, com avaliação longitudinal por períodos prolongados, para reforçar a evidência de efetividade da ITA.