Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.28 no.3 Lisboa set. 2020
https://doi.org/10.32932/rpia.2020.09.038
ARTIGO ORIGINAL
Angioedema associado aos fármacos inibidores do eixo renina-angiotensina‑aldosterona: Experiência do Centro Hospitalar de Lisboa Ocidental
Angioedema related to the renin-angiotensin-aldosterone system inhibitors: Experience at a Tertiary Care Hospital in Lisbon
Rita Albuquerque Sousa1, Ana Teresa Silva2, Rui Melo Cabral1, Fátima Cruz1, Sílvia Pereira1, Pedro Escada1,3
1 Serviço de Otorrinolaringologia do Hospital de Egas Moniz, Centro Médico Hospitalar de Lisboa Ocidental, Lisboa
2 Serviço de Imunoalergologia do Hospital de Egas Moniz, Centro Médico Hospitalar de Lisboa Ocidental, Lisboa
3 Nova Medical School - Faculdade de Ciências Médicas da Universidade Nova de Lisboa, Lisboa
RESUMO
Introdução: O angioedema isolado é um efeito adverso raro, mas potencialmente fatal, da toma de fármacos inibidores do eixo renina-angiotensina-aldosterona (iRAA). Objetivos: Caracterizar os episódios de angioedema localizados à face e via aérea superior relacionados com a toma destes fármacos nos doentes referenciados ao Centro Hospitalar de Lisboa Ocidental. Métodos: Análise retrospetiva observacional dos doentes com diagnóstico de angioedema da região da face e via aérea superior relacionados com a toma de iRAA. Critérios de inclusão: episódios únicos ou recorrentes de angioedema sob terapêutica com iRAA. Foram excluídos doentes com angioedema associado a urticária e hipersensibilidade a anti-inflamatórios não esteroides. Resultados: Amostra constituída por 49 doentes: 23 do sexo feminino, média de idades 67 anos (min=28;máx=93). Os inibidores da enzima de conversão da angiotensina (IECA) foram a classe relacionada com o desenvolvimento de angioedema em 77,55% (n = 38), os antagonistas dos recetores da aldosterona (ARA II) em 18,37% (n=9) e a associação dos dois foi encontrada em 4,08% dos casos (n=2). Os locais envolvidos foram: face 44,9% (n=22), via aérea 34,7% (n=17), envolvimento da face e via área 20,4% (n= 10). A taxa de recorrência ao serviço de urgência hospitalar foi de 63,3% (n=31). Foi realizada traqueotomia em um doente. Conclusões: O diagnóstico e a abordagem do angioedema relacionado com os fármacos iRAA representa um desafio. Embora os IECA estejam mais frequentemente associados, os ARA II não podem ser considerados uma alternativa segura aos primeiros.
Palavras-chave: Angioedema, ARAII, IECA, inibidores do sistema renina-angiotensina-aldosterona, via aérea.
ABSTRACT
Introduction: Although rare, angioedema is an adverse event of the renin–angiotensin–aldosterone system inhibitors (RAAi) that can be fatal due to airway obstruction. Objective: The aim of this study was to describe these episodes in patients referred to a tertiary care hospital in Lisbon, Portugal. Methods: Retrospective observational study. Inclusion criteria: patients diagnosed with angioedema of the face and upper airway, under treatment with RAAi; exclusion criteria: patients diagnosed with angioedema associated to urticaria or hypersensitivity to nonsteroidal anti-inflammatory drugs. Results 49 patients were reviewed, 23 of which were female, median age of 67 years old (min=28; máx=93). Angiotensin-converting-enzyme inhibitors (ACEi) were related to the event in 77.55% of the cases (n = 38), angiotensin II receptor blockers (ARBs) in 18.37% (n=9) and a combination of the two drugs in 4.08%(n=2). The episodes were located to the face region in 44.9% of the cases (n=22); to the airway in 34.7% (n=17); and a combination of the two in 20.4% (n= 10). Patients resort to an emergency department in 63.3% of the cases (n=31). Tracheotomy was necessary in one patient. Conclusions: The diagnosis and management of angioedema related to the RAAi represents a challenge. Although ACEi are more frequently associated with the episodes, ARBs cannot be considered as a safe alternative.
Keywords: ACEi, airway, angioedema, ARBs, renin-angiotensin-aldosterone system inhibitors.
INTRODUÇÃO
O angioedema da região da face e via aérea superior é um efeito adverso raro da toma de fármacos inibidores do eixo renina-angiotensina-aldosterona (iRAA), mas potencialmente ameaçador da vida¹. A sua forma de apresentação varia de edema benigno que afeta a região da face e lábios a formas mais graves com envolvimento da via aérea superior e que representam verdadeiras emergências². A abordagem da via área nestes doentes revela-se um desafio, sendo por vezes necessárias medidas invasivas de manutenção da mesma, nomeadamente a entubação orotraqueal ou a cricotireotomia e a traqueotomia.
Os fármacos inibidores do eixo renina-angiotensina-aldosterona são fármacos amplamente usados no tratamento de doenças cardiovasculares, nomeadamente a hipertensão arterial e a insuficiência cardíaca. Com o seu uso crescente, o número de episódios de angioedema relacionado com a sua toma tem vindo a aumentar, com uma incidência estimada em cerca de 0,2%-0,7%3,4.
O angioedema corresponde a edema das camadas profundas da derme, de tecidos subcutâneos ou submucosos e mais raramente de órgãos viscerais. É causado por um fenómeno de vasodilatação e aumento da permeabilidade endotelial, que leva à extravasão de fluido para o espaço intersticial¹. Pode ser classificado de acordo com o seu mecanismo fisiopatológico em histaminérgico (mediado por mastócitos) vs mediado pela bradicinina e, dentro destes, em hereditário ou adquirido (Figura 1)1,5. Os episódios associados à toma de iRAA representam formas particulares de angioedema adquirido não alérgico mediados pela bradicinina. O mecanismo fisiopatológico preciso ainda não foi completamente elucidado, mas parece mimetizar as formas de angioedema hereditário associado ao défice de inibidor do fator C1 do complemento (C1INH), no sentido em que ambos ocorrem por aumento dos níveis da bradicinina1.
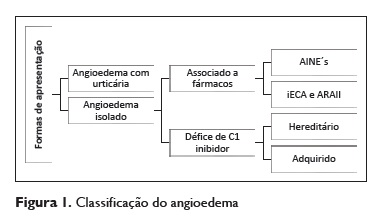
No caso dos inibidores da enzima de conversão da angiotensina (IECA), os mecanismos moleculares envolvidos iniciam-se pela inativação da enzima de conversão da angiotensina (ECA) que leva à diminuição da formação da angiotensina II e a uma diminuição da degradação da bradicinina. Outras vias de degradação da bradicinina são ativadas, mas se houver algum défice nestas vias os níveis de bradicinina aumentam, desencadeando a resposta inflamatória. Estas diferenças e variantes genéticas nestas vias podem explicar o porquê de apenas uma minoria dos doentes sob terapêutica com IECA desenvolver angioedema¹.
No caso dos antagonistas dos recetores da angiotensina (ARA II) o mecanismo fisiopatológico é menos evidente, apesar de não exercerem um efeito direto na ECA nem nas vias de degradação das bradicininas, observa-se um aumento dos níveis das bradicininas com os ARA II, possivelmente pela inibição indireta da ECA e da metaloendopeptidase.
Pensa-se que por bloquearem o receptor tipo 1 da angiotensina, maiores níveis de angiotensina II ficam disponíveis em circulação para se ligar aos receptores tipo 2, o que por sua vez conduz à inibição da ECA e da metaloendopeptidase, resultando no aumento dos níveis da bradicinina¹.
O angioedema isolado associado aos iRAA caracteriza-se por ser habitualmente recorrente e localizado aos tecidos subcutâneos ou submucosos. À semelhança do angioedema hereditário, afeta mais frequentemente a região da face e lábios, mas em alguns casos pode progredir ou envolver preferencialmente as regiões da cavidade oral, orofaringe, hipofaringe e laringe, o que pode representar um risco para a via aérea3.
Estas formas particulares de angioedema são ainda pouco conhecidas por médicos generalistas e de outras especialidades, colocando dificuldades no diagnóstico, orientação terapêutica e tratamento destes doentes4.
O diagnóstico é clínico e baseia-se na história clínica, sendo de particular importância uma anamnese detalhada que inclua a terapêutica habitual, bem como os achados ao exame objetivo, ou por vezes a descrição dada pelo doente. Tratando-se de um diagnóstico de exclusão, é necessário eliminar outras possíveis causas de angioedema, nomeadamente o angioedema hereditário e angioedema associado a outros fármacos, como os AINEs¹.
Habitualmente os episódios associados aos iRAA ocorrem nos primeiros três meses após o início da terapêutica, mas podem ocorrer após vários anos de toma e persistir alguns meses mesmo após a suspensão do fármaco, o que pode tornar menos evidente o estabelecimento desta relação e, consequentemente, o diagnóstico1,6.
O objetivo deste estudo foi caracterizar uma população com angioedema isolado relacionado com a toma de fármacos inibidores do eixo renina-angiotensina-aldosterona e descrever os seus principais aspetos clínicos em doentes observados ou referenciados ao Centro Hospitalar de Lisboa Ocidental.
MÉTODOS
Foi realizada uma análise retrospetiva observacional dos doentes com o diagnóstico de angioedema da região da face e via aérea superior relacionados com a toma de IECA ou ARA II, seguidos em consulta de Imunoalergologia do Hospital de Egas Moniz, Centro Hospitalar de Lisboa Ocidental (CHLO), entre os anos de 2009 e 2016.
Os dados foram obtidos através de registos clínicos de três formas: consulta externa de Imunoalergologia do CHLO, registos do Serviço de Urgência do CHLO, registos de internamento do CHLO.
A partir da amostra obtida foram identificados os fármacos envolvidos (princípio ativo e classe), classificada a localização e gravidade do angioedema pela descrição clínica, assinalados os casos em que houve necessidade de recorrer a um serviço de urgência, assim como aqueles em que foram necessárias medidas de suporte da via aérea, o tratamento instituído em contexto de urgência e a necessidade ou não de internamento.
Foram considerados critérios de inclusão doentes com episódios únicos ou recorrentes de angioedema da região da cabeça e pescoço (incluindo face, lábios, cavidade oral, orofaringe, hipofaringe e laringe) sob terapêutica com IECA ou ARA II. Foram excluídos doentes com angioedema associado a urticária e angioedema associado a hipersensibilidade a AINES.
RESULTADOS
Obtivemos uma amostra de 49 doentes: 47% do sexo feminino (n=23) A média de idades foi de 67 anos (min=28; máx=93) e mediana de 72 anos (Figura 2).
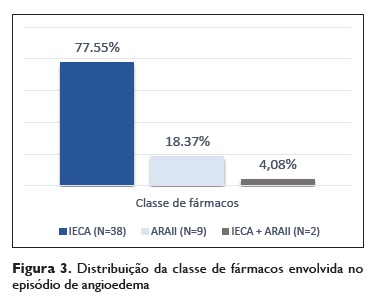
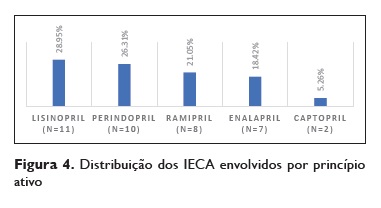
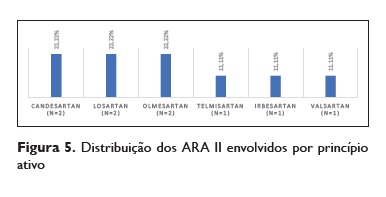
Os IECA foram a classe relacionada com o desenvolvimento de angioedema em 77,55% (n = 38) dos casos, os ARA II em 18,37% (n=9) e a associação dos dois foi encontrada em 4,08% dos casos (n=2) (Figuras 3, 4 e 5).
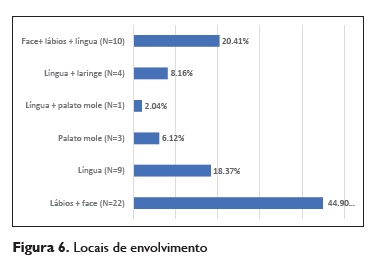
Os episódios ocorreram com atingimento da região da face (face, lábios ou ambos) em 44,9% (n=22) dos casos, da via aérea (língua, palato mole e laringe) em 34,7% (n=17) e o envolvimento da face juntamente com a via área foi observado em 20,4% (n= 10) dos casos (Figura 6).
A taxa de doentes com história de múltiplos episódios até ao diagnóstico foi de 73,47% (n=36).
A taxa de recorrência ao serviço de urgência hospitalar foi de 63,3% (n=31). A taxa de internamento foi de 10,2% (n=5). A traqueotomia foi realizada em um caso(n=1).
Foi possível apurar o tratamento instituído em contexto de urgência em 43% dos casos (n=21): 20,4% (n=10) foram tratados com combinação de corticoide e anti-histamínico por via endovenosa, 8,1% (n=4) foram tratados apenas com corticoide por via endovenosa, em 6,1%(n=3) usou-se uma combinação de corticoide, anti-histamínico e adrenalina, em 4,1%(n=2) usou-se apenas um anti-histamínico, em 2% (n=1) usou-se uma combinação de corticóide e adrenalina, e em 2% (n=1) não foi instituída terapêutica.
O corticoide administrado em todos os casos foi a hidrocortisona, numa dose que variou de 100-200mg; o anti-histamínico administrado foi a clemastina.
DISCUSSÃO
O angioedema associado à toma de iRAA pode ser uma emergência médica, representando um risco potencial para a via aérea dos doentes. Representa um efeito adverso raro por vezes desvalorizado pelo próprio, sendo por outro lado pouco conhecido pelos profissionais de saúde e de difícil diagnóstico.
Um dos dados mais relevantes obtidos neste trabalho foi a alta taxa de ocorrência de múltiplos episódios previamente ao diagnóstico (73,47%), correspondendo à maioria da amostra (n=36). Estes resultados refletem a dificuldade no diagnóstico, que se deve em parte ao facto de não existir uma correlação temporal direta entre a toma do fármaco e o desenvolvimento do angioedema7.
Na maioria dos casos o primeiro episódio ocorre meses após o início do fármaco, mas pode ocorrer vários anos após o início da toma. Por outro lado, este achado pode também refletir a ocorrência de episódios mais “leves”, desvalorizados pelo próprio doente até à ocorrência de um evento mais grave.
No que respeita às características demográficas da amostra, obtivemos uma distribuição semelhante entre género (53% masculino e 47% feminino) e verificamos uma maior incidência acima dos 60 anos, com um pico de incidência entre os 71-80 anos, o que provavelmente reflecte a maior prescrição de fármacos inibidores do eixo renina-angiotensina-aldosterona nestas faixas etárias, nas quais há um aumento de doenças crónicas, como a HTA e/ou suas complicações. Estes resultados são concordantes com os obtidos noutras séries publicadas. Nesta amostra obtivemos uma idade mínima de 28 anos, o que nos leva a crer que estes efeitos adversos não são selectivos para a idade, podendo ocorrer em qualquer faixa etária.
Em nenhum dos casos foram documentados factores precipitantes, contrariamente a algumas séries onde são apontados fatores, como as alterações da dieta, o trauma minorou a exposição a fumos8.
Os locais de envolvimento foram variáveis, no entanto atingiram mais frequentemente a região da face e lábios, o que é concordante com a literatura. Apesar de mais frequentes, estas formas de angioedema isolado são potencialmente menos graves do que aquelas que ocorrem com envolvimento da via aérea superior e seu potencial compromisso.
O envolvimento da via aérea superior pode ocorrer nas formas de edema da língua, palato mole e laringe. A língua foi o terceiro local mais frequentemente envolvido e a região do palato mole e laringe foram as menos envolvidas.
A taxa de ida ao serviço de urgência (SU) foi elevada (63,3%), no entanto não obtivemos dados para 34,7% da amostra, pelo que pode haver uma subestimação desta taxa.
Outro dado relevante do nosso trabalho foi a avaliação do tratamento instituído em contexto de urgência.
Verificamos que para a maioria dos doentes a terapêutica instituída não foi dirigida nem a mais eficaz, consistindo na terapêutica convencional para o angioedema histaminérgico com uma combinação de corticoide e anti-histamínico por via endovenosa (hidrocortisona e clemastina). Em muitos dos casos a terapêutica só foi eficaz passadas várias horas e por vezes após uma dose de reforço. Por outro lado, sabendo que o angioedema isolado é autolimitado, não é possível avaliar com certeza os casos em que a terapêutica foi de facto efetiva. O tratamento mais eficaz disponível no tratamento desta forma de angioedema é aquele que é utilizado no angioedema hereditário, nomeadamente o inibidor da esterase de C1 humana (Berinert®) endovenoso na dose de 20U/kg/toma1,8, ou o Icatibant, antagonista seletivo que compete pelo recetor da bradicinina de tipo 29,10. Isto deve-se ao facto de o angioedema associado à toma de iRAA ter mecanismos comuns ao angioedema hereditário (i.e, ser mediado pela bradicinina).
A não utilização deste fármaco deveu-se, provavelmente, ao desconhecimento e, por outro lado, ao facto de ser um medicamento que, embora recentemente disponível na nossa instituição, tem um elevado custo associado.
Desta forma, a sua utilização deve ser reservada para os casos em que existe uma elevada suspeição clínica e a gravidade o justifique. Para tal, contribui a história clínica fornecida pelo doente e, particularmente, a medicação habitual fundamental para diagnóstico diferencial11,12.
O tratamento definitivo passa pela suspensão dos fármacos inibidores do eixo renina-angiotensina-aldosterona.
O recurso a medidas invasivas para manutenção da via aérea ocorreu em apenas um doente, com necessidade de realização de traqueotomia. Alguns trabalhos apontam para o envolvimento de múltiplos locais e o envolvimento da laringe como fatores associados a maior risco de necessidade de medidas invasivas de manutenção da via aérea². A taxa de internamento foi de 10,2% (n=5), refletindo a necessidade de vigilância da via aérea.
Embora em número reduzido, estes doentes representam os casos mais graves e potencialmente fatais. Talvez a instituição de uma terapêutica médica mais dirigida (nomeadamente a utilização do inibidor da esterase de C1 humana ou um antagonista do recetor da bradicinina) pudesse evitar o curso mais grave nestes casos.
Outro dado relevante do presente trabalho foi a associação destes episódios à toma de fármacos do grupo dos antagonistas dos recetores da angiotensina II (ARAII). O angioedema isolado é um efeito adverso conhecido da toma de fármacos do grupo dos IECA e até há alguns anos acreditava-se que os ARA II eram uma alternativa segura a estes fármacos. Mais recentemente, alguns estudos vieram demonstrar a associação entre o desenvolvimento de angioedema isolado e a toma de ARA II1,3,5. Os resultados que obtivemos são compatíveis com esses resultados e adicionam evidência a favor da não utilização dos fármacos ARA II em substituição dos IECA em caso de angioedema. Embora o desenvolvimento de angioedema seja menos frequente com a toma de ARA II, ocorre num número importante de casos13. Este menor número poderá em parte refletir a menor prescrição de ARA II relativamente ao uso de IECA, visto que são usados maioritariamente como fármaco de segunda linha. Embora em alguns casos tenha sido feita a substituição para ARA II sem novos episódios documentados, para outros doentes esta substituição não impediu a recorrência dos episódios e, noutros casos, o ARA II estava a ser usado como fármaco de primeira linha no momento em que ocorreram os episódios. A utilização dos ARA II em alternativa aos IECA, após episódio de angioedema, não pode ser considerada segura no entanto, nos casos em que não se verificam novos episódios, a introdução deste fármaco pode ser benéfica (i.e, se tiver sido prescrito para a prevenção de insuficiência renal), pelo que deverá ser ponderado o risco/benefício da sua utilização14.
Como limitações deste trabalho referimos o facto de se tratar de um estudo retrospetivo observacional. Os doentes foram selecionados a partir de um centro hospitalar da região de Lisboa (CHLO). Os dados obtidos poderão estar em relação com as características demográficas da população desta região. Por outro lado, a ausência de uma base de dados maior limitou a dimensão da amostra. Pela falta de dados obtidos, na ausência de registos clínicos, não foi possível obter uma caracterização mais precisa dos episódios com descrição através do exame objetivo em SU, tratamento utilizado e verdadeira taxa de ida ao serviço de urgência. Importa ainda referir que a recorrência a outros serviços de urgência com diagnóstico e tratamento instituído não foram avaliados.
Desta forma, um estudo prospetivo que tivesse como ponto de partida doentes selecionados através de um SU talvez permitisse uma melhor caracterização da população, dos episódios e da terapêutica instituída.
CONCLUSÃO
O angioedema da região da face e via aérea superior é um efeito adverso raro da toma de IECA e ARAII, mas potencialmente ameaçador da vida e relativamente pouco conhecido. Afeta maioritariamente a população acima dos 65 anos, o que está relacionado com a maior prescrição destes fármacos nessa faixa etária. Os locais mais frequentemente envolvidos incluem face, lábios e língua, podendo ocorrer compromisso da via aérea superior. O diagnóstico é frequentemente difícil e com um atraso significativo desde a primeira manifestação, sendo necessário um nível elevado de suspeição. Representa um número importante de casos de ida ao serviço de urgência e o tratamento instituído na maior parte dos casos revela-se pouco eficaz. O tratamento dirigido mais eficaz é aquele utilizado no tratamento agudo do angioedema hereditário, por serem fármacos inibidores da ação da bradicinina. O tratamento definitivo passa pela suspensão desta classe de fármacos. Os IECA são a classe mais frequentemente associada ao desenvolvimento de angioedema, no entanto existe um número importante de casos relacionados com a toma de ARA II, pelo que a sua utilização sem provocação oral específica não pode ser recomendada como alternativa segura aos IECA nestes doentes.
REFERÊNCIAS
1. Javaud N, Achamlal J, Reuter P, Lapostolle F, Lekouara A, Youssef M, et al. Angioedema related to angiotensin-converting enzyme inhibitors: Attack severity, treatment, and hospital admission in a prospective multicenter study. Medicine (Baltimore) 2015;94(45):e1939. [ Links ]
2. Kieu M, Bangiyev J, Thottam P, Levy P. Predictors of airway intervention in angiotensin-converting enzyme inhibitor-induced angioedema. Otolaryngol Head Neck Surgery 2015;153(4):544‑50. [ Links ]
3. Cicardi M, Aberer W, Banerji A, Bas M, Berstein J, Bork K, et al. Classification, diagnosis and approach to treatment for angioedema: Consensus report from the Hereditary Angioedema International Working Group. Allergy 2014;69:602-16. [ Links ]
4. Caballero T, Baeza ML, Cabañas R, Campos A, Cimbollek S, Gómez-Traseira C, et al. Consensus statement on the diagnosis, management, and treatment of angioedema mediated by bradykinin. Part II. Treatment, follow-up, and special situations. J Investig Allergol Clin Immunol 2011;21:422-41. [ Links ]
5. Wadelius M, Marshall SE, Islander G, Nordang L, Karawajczyk M, Yue Q, et al. Phenotype standardization of angioedema in the head and neck region caused by agents acting on the angiotensin system. Clin Pharmacol Ther 2014;96(4):477-81. [ Links ]
6. Chiu AG, Newkirk KA, Davidson BJ, Burningham AR, Krowiak EJ, Deeb ZE. Angiotensin-converting enzyme inhibitor-induced angioedema: a multicenter review and an algorithm for airway management. Ann Otol Rhinol Laryngol 2001;110(9):834-40. [ Links ]
7. Grant N, Deeb Z, Chia S. Clinical experience with angiotensineconverting enzyme inhibitor-induced angioedema. Otolaryngol Head Neck Surg 2007;137(6):931-5. [ Links ]
8. Nielsen E W, Gramstad S. Angioedema from angiotensin-converting enzyme (ACE) inhibitor treated with complement 1 (C1) inhibitor concentrate. Acta Anaesthesiol Scand 2006; 50(1):120-2. [ Links ]
9. Baş M, Greve J, Stelter K, Havel M, Strassen U, Rotter N, et al. A randomized trial of icatibant in ACE-inhibitor–induced angioedema. N Engl J Med 2015 29;372(5):418-25.
10. Straka BT, Ramirez CE, Byrd JB, Stone E, Woodard-Grice A, Nian H, et al. Effect of bradykinin receptor antagonism on ACE inhibitor-associated angioedema. J Allergy Clin Immunol 2017;140(1):242-8 [ Links ]
11. Caballero T, Baeza ML, Cabañas R, Campus A, Cimbollek S, Gómez-Traseira C, et al. Consensus statement on the diagnosis, management, and treatment of angioedema mediated by bradykinin. Part I. Classification, epidemiology, pathophysiology, genetics, clinical symptoms, and diagnosis. J Investig Allergol Clin Immunol 2011;21(5):333-47. [ Links ]
12. Pedrosa M, Prieto-García A, Sala-Cunill A; Spanish Group for the Study of Bradykinin-Mediated Angioedema (SGBA) and the Spanish Committee of Cutaneous Allergy (CCA). Management of angioedema without urticaria in the emergency department. Ann Med 2014;46(8):607-18. [ Links ]
13. Toh S, Reichman ME, Houstoun M, Southworth MR, Ding X, Hernandez AF, et al. Comparative risk for angioedema associated with the use of drugs that target the renin-angiotensin-aldosterone system. Arch Intern Med 2012;172(20):1582-9. [ Links ]
14. Winters ME, Rosenbaum S, Vilke GM, Almazroua FY. Emergency department management of patients with ACE-inhibitor angioedema. J Emerg Med 2013;45(5):775-80. [ Links ]
Rita Albuquerque Sousa
E-mail: ritalbuquerquesousa@gmail.com
Conflito de interesses
Os autores declaram que não existem conflitos de interesse.
Data de receção / Received in: 09/09/2019
Data de aceitação / Accepted for publication in: 20/11/2019














