Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Portuguesa de Imunoalergologia
Print version ISSN 0871-9721
Rev Port Imunoalergologia vol.27 no.1 Lisboa Mar. 2019
https://doi.org/10.32932/rpia.2019.03.003
ARTIGO ORIGINAL
Testes intradermicos e imunodots podem ser uteis no de alergia canina a carne
Intradermal testing and immunodot may be useful in diagnosing dog allergy to meat
Luis Lourenco Martins1,2, Isabela Esteves de Campos3, Celia Miguel Antunes4,5, Ana Rodrigues Costa4,5, Ana Goicoa Valdevira6, Ofelia Pereira Bento2,7
1 Departamento de Medicina Veterinaria, Escola de Ciencias e Tecnologia, Universidade de Evora
2 Instituto de Ciencias Agrarias e Ambientais Mediterranicas (ICAAM), Universidade de Evora
3 Faculdade de Zootecnia e Engenharia de Alimentos, Universidade de Sao Paulo, Sao Paulo
4 Departamento de Quimica, Escola de Ciencias e Tecnologia, Universidade de Evora
5 Instituto de Ciencias da Terra (ICT -IIFA), Universidade de Evora
6 Hospital Veterinario Universitario Rof Codina, Faculdade Veterinaria de Lugo, Universidade de Santiago de Compostela, Lugo, Espanha
7 Departamento de Zootecnia, Escola de Ciencias e Tecnologia, Universidade de Evora
RESUMO
Fundamentos: O diagnóstico de alergia alimentar em cães e geralmente realizado com recurso a dietas de exclusão e provas de provocação. Objetivos: Contribuir para a avaliação do valor diagnóstico de testes intradérmicos (TID) e de imunodots na alergia canina a carne. Métodos: Onze cães suspeitos de alergia alimentar seguidos em consulta externa de alergia foram submetidos a TID para os ácaros do pó e de armazenamento mais comuns, pólenes de gramíneas, carne de vaca, de porco, de borrego e de frango. A IgE especifica foi determinada comercialmente para ácaros e pólenes e avaliada por imunodots para diferentes carnes. Resultados: A IgE especifica media, em unidades de absorcao ELISA (UAE) foi especialmente elevada para Dermatophagoides farinae (1665), Acarus siro (2063) e Tyrophagus putrescentiae(1644). Os TID revelaram-se especialmente positivos para Dermatophagoides farinae (5 doentes), Dermatophagoides pteronyssinus (6), carne de vaca (10), de frango (6) e de porco e de borrego (5). Os immunodots revelaram-se positivos em todos os doentes para carne de vaca, de porco e de borrego e em 8 para frango. Observou-se uma correlacao positiva entre os TID e os imunodots para carne de vaca e frango. Conclusões: A exclusão da carne de vaca, de porco, de borrego ou de frango da dieta dos cães com TID respetivamente positivos resultou em sensível melhora clinica. Os testes baseados nas IgE especificas revelaram-se ferramentas rápidas de diagnostico razoavelmente preditivo na alergia a carne. Serão necessarios estudos moleculares para esclarecer possíveis reacções cruzadas e avaliação da imunidade celular para identificar alergia alimentar nao mediada por IgE.
Palavras-chave: Cão, alergia alimentar, carne, sensibilização.
ABSTRACT
Background: Food allergy diagnosis in dogs usually runs through exclusion diets with provocation tests. Aims: To evaluate the diagnostic value of Intradermal Tests (IDT) and Immunodots in dogs with allergy to meat. Methods: From an allergy outpatient consultation 11 dogs suspected of food allergy were subjected to intradermal testing (IDT) for the most common dust and storage mites, grass pollens, beef, pork, lamb and chicken. Specific IgEs were commercially assessed for mites and pollens, and in immunodots to beef, pork, lamb and chicken. Results: Mean sIgE in ELISA -Absorbance -Units (EAU) was especially high to Dermatophagoides farinae (1665) Acarus siro (2063) and Tyrophagus putrescentiae (1644). IDT revealed positivity mostly for D. farinae (5 patients), D. pteronyssinus (6), beef (10), chicken (6) and pork and lamb (5). Immunodots revealed positive in all patients to beef, pork and lamb, and in 8 to chicken. Positive correlation was found between IDT and immunodot to beef and chicken. Conclusions: Avoidance of beef, pork, lamb or chic en in IDT positive dogs revealed clinical improvement. sIgE -based tests revealed quick reasonably predictive diagnosis tools in meat allergy. Molecular studies will be needed to clarify possible cross -reactions and assessment of cell immunity to identify non-IgE-mediated food allergy.
Key -words: Dog, food allergy, meat, sensitization.
INTRODUÇÃO
A dermatite de contato1,2 e a dermatite alérgica alimentar3,4 caracterizam-se por uma condição cutânea inflamatória, mais ou menos localizada, apresentando-se o prurido, tal como na alergia às pulgas e à Malassezia, como a principal queixa de base5.
No entanto, em relação à alergia alimentar, estima-se que cerca de 10-15% apresentará sinais digestivos6. O diagnóstico atual de dermatite atópica canina baseia–se na história clínica e na exclusão de outras causas de dermatite, como infeções parasitárias ou bacterianas, bem como intolerância alimentar1,5. A identificação da reatividade cutânea mediada por IgE, através de TID, e a determinação sorológica de IgE alergénio–específicas visam um diagnóstico mais específico, particularmente quando se objetiva a imunoterapia específica para o tratamento7,8. As reações cutâneas adversas a alimentos constituem as manifestações predominantes em cães com alergia alimentar, sendo a carne de vaca, os produtos lácteos, o frango e o trigo os alimentos mais frequentemente implicados9. Como nos seres humanos, os testes cutâneos e sorológicos, por si mesmos, não apresentam suficiente fiabilidade no diagnóstico de alergia alimentar5. O recurso a dietas de eliminação ou a dietas hipoalergénicas comerciais tem constituído a metodologia proposta para o diagnóstico de alergia alimentar10,11.
Um subsequente passo diagnóstico é muitas vezes necessário e inclui provas de provocação alimentar com alimentos individuais, para identificar o(s) alimento(s) especificamente envolvido(s)9. Encontram-se atualmente disponíveis no mercado opções analíticas com vista à identificação de alergia alimentar canina, quer baseadas no Western Blot, como o Cyno -DIAL® (Galileo Diagnostics, França), quer no ELISA, como o Teste Screening Alimentar e o Painel de Alergénios Alimentares (LETI Animal Health, Espanha). Porém, o recurso a essa opção como método diagnóstico único, mesmo para a metodologia baseada no Western Blot, considerada mais sensível e específica, não está recomendado para o diagnóstico de alergia alimentar no cão, face à insuficiente sensibilidade e especificidade11,12. No entanto, alguns estudos haviam já revelado resultados controversos. Investigação laboratorial levada a cabo por Puigdemont et al. (2006)13 revelou concordância com as manifestações clínicas, enquanto Kunkle e Horner (1992)14 haviam observado resposta positiva a alergénios alimentares em cães apenas com alergia ambiental.
Ausência de reatividade celular a antigénios alimentares foi também verificada em cães com reatividade alérgica alimentar15. Em face da frequente suspeita de alergia alimentar e dado o insuficiente valor diagnóstico individual dos métodos laboratoriais estudados e a positividade dos TID para algumas carnes, em associação com a melhoria clínica após a sua exclusão da dieta, pretendeu-se, neste estudo, avaliar a relevância da abordagem diagnóstica combinada: i) história clínica; ii) TID; iii) IgE específica e iv) provas dietéticas de exclusão e provocação no diagnóstico de alergia alimentar, de forma mais rápida e com razoável fiabilidade.
MATERIAL E MÉTODOS
Seleção dos doentes
De 85 cães atendidos nas consultas externas de dermatologia e alergologia do Hospital Veterinário da Universidade de Évora (Portugal) e do Hospital Veterinário Universitário Rof Codina (Lugo, Espanha), 11 (5 do sexo masculino e 6 do sexo feminino) foram seleccionados pela história clínica e TID, por suspeita de alergia alimentar.
Consideraram-se suspeitos de alergia alimentar os doentes que, mesmo não apresentando manifestações digestivas, apresentavam dermatite alérgica sem agravamento estacional e TID positivos para alimentos. Todos os selecionados apresentavam dermatite pruriginosa e, pelo menos, seis dos critérios de Favrot para dermatite atópica16, sem queixas de natureza digestiva.
Os TID foram realizados com extratos comerciais, incluindo controlo positivo (solução de histamina) e negativo (solvente dos extratos) (Bial Aristegui, Bilbao, Espanha) de acordo com os procedimentos diagnósticos internacionalmente aceites para, pelo menos, Dermatophagoides farinae (Der f), Dermatophagoides pteronyssinus (Der p), Acarus siro (Aca s), Tyrophagus putrescentiae (Tyr p), Lepidoglyphus destructor (Lep d), Dactylis glomerata (Dac g), Phleum pratense (Phl p), carne de vaca, de porco, de borrego e de frango.
Determinação das IgE específicas
A IgE específica para um painel dos ácaros e pólenes mais comuns foi determinada de acordo com Lee et al. (2009)17 em laboratório comercial (Leti -Univet, Barcelona, Espanha). A avaliação das IgE específicas para carne de vaca, de porco, de borrego e de frango foi realizada em imunodot blots como segue: i) músculo fresco de cada uma das espécies, refrigerado, cortado em pedaços muito finos (<3 mm) e submetido a extracção proteica sob agitação orbital suave, a 1:3, em tampão fosfato salino pH 7,4, durante 30 min a +4 oC; ii) o sobrenadante foi obtido por centrifugação a 3000 g durante 20 min a +4 oC; iii) a concentração proteica do extrato foi medida segundo o método de Warburg e Christian18 em espectrofotómetro (Beckman DU530 UV -VIS, Beckman Coulter, Brea, EUA) e repartido em aliquotas conservadas a -20 oC; iv) as tiras de nitrocelulose (NC) de 4 mm de largura foram preparadas pingando por ponto (dot) 2 μL de solução de extracto de cada carne a 500 μg/mL; v) as tiras de NC foram bloqueadas 2×0,5 h em tampão de bloqueio (1% leite em pó desnatado – 0,1% Tween -20, em tampão Tris salino pH 7,4) à temperatura ambiente; vi) as tiras foram incubadas durante 2 h com soros individuais a 1:10 em tampão de bloqueio, seguido de lavagens de 4x5 min com solução de lavagem (0,9% NaCl – 0,1% Tween -20); vii) foi realizada incubação durante 2 h com anticorpo monoclonal marcado com biotina a 1:1000 em tampão de bloqueio (AbDSerotec, Kidlington, Reino Unido), seguido de lavagem 4x5 min e 1 h de incubação com ExtrAvidin -fosfatase alcalina (Sigma-Aldrich) a 1:5000; viii) as tiras de NC foram submetidas a um ciclo adicional de lavagem de 4x5 min e a visualização da marcação IgE específica foi realizada por reação cromogénica com nitroazul de tetrazólio/5-bromo-4-cloro-3-indolil fosfato (Sigma -Aldrich) em tampão substrato. Os controlos de imunodot foram realizados sem soro e sem soro e sem anti-IgE canina.
RESULTADOS
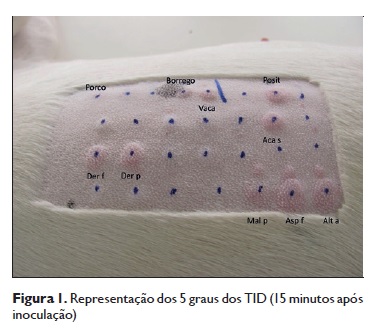
Os TID e a intensidade dos imunodots foram classificados de 1 a 4 e lidos, respetivamente, aos 15 min após a administração e aos 30 min de revelação, por três observadores separados, e os resultados positivos podem observar-se no Quadro 1. A representação dos 5 graus dos TID é exemplificada na Figura 1. A IgE específica média, em UAE, foi de 1665 (Der f), 297 (Der p), 2063 (Aca s), 1644 (Tyr p), 105 (Lep d), 547 (Dac g) e 601 (Phl p), considerando um cut-off de 150 UAE. Os TID observaram–se positivos em 5 doentes (Der f), 6 (Der p), 4 (Aca s), 1 (Tyr p), 3 (Lep d), 4 (Dac g), 3 (Phl p), 10 (carne de vaca), 5 (porco), 5 (borrego) e 6 (frango). Os imunodots IgE específicos revelaram -se positivos para todos os doentes, relativamente às carnes de vaca, porco e borrego, e, em 8 deles, para frango (Figura 2). Foi possível uma semiquantificação dos resultados dos imunodots, tendo-se observado uma forte correlação positiva entre IgE específica e TID para Der p (r = 0,881; p = 0,048), TID e imunodots para carne de vaca (r = 0,702; p = 0,015) e frango (r = 0,878; p = 0,0003) e entre os imunodots para vaca e borrego (r = 0,800; p = 0,006). Foram observadas diferentes tendências de associação em dupleto dos índices TID/immunodots para carne de bovino (3,2/3,73), suíno (3/3,27), borrego (1,8/2,91) e frango (1,8/1,3). Dado o objetivo diagnóstico subjacente em cães que apresentaram TID positivos para a carne de vaca, porco, borrego ou frango, foi recomendada a exclusão alimentar respetiva, com melhora clínica significativa, especialmente quando a carne bovina ou o frango estavam implicados.

DISCUSSÃO
Com base em parâmetros relacionados com alergia, como a reatividade cutânea e a sensibilização subjacente, pode considerar-se que a combinação de diferentes métodos de diagnóstico representará um valor acrescentado.
Assim, poder-se-á igualmente considerar a possibilidade de combinação do estudo da IgE específica para alimentos por métodos in vivo (TID) e in vitro (imunodot blot) como uma ferramenta útil para um diagnóstico preditivo mais rápido de alergia alimentar. Esta via diagnóstica apresentará, ainda, a vantagem de permitir evitar o recurso a alimentos comerciais de proteínas extensamente hidrolisadas, cujo elevado custo e baixa palatabilidade estão frequentemente associados a má aderência ao processo. A deteção de IgE específicas para as diferentes carnes, recorrendo a antigénios preparados a partir das respetivas fontes em natureza, por oposição à deteção sobre substrato antigénico preparado a partir de alimentos compostos comerciais, tal como sucede com alguns métodos comerciais, apresenta a vantagem de avaliar a resposta à carne de cada espécie animal individualmente, independentemente de qualquer interferência relacionada com aditivos alimentares.
Para este objetivo o recurso a métodos como o ELISA apresentará a desvantagem de ser mais elaborado e requerer mais equipamento. Também o Western Blot após separação eletroforética de proteínas, permitindo a identificação de alergénios moleculares, perde vantagem, na medida em que, possibilitando a identificação de alergénios moleculares, estará direcionado à investigação diagnóstica por componentes, à qual se associará uma imunoterapia igualmente resolvida por componentes, mais específica, mas que não se perspectiva nas situações de alergia alimentar5,19.
No que respeita à carne de vaca, uma fonte importante de alergénios alimentares para o cão9, a possível reacção alérgica por sensibilização cruzada à galactose -alpha-1,3-galactose (α -Gal)20, associada à picada de ixodídeos, deve igualmente ser investigada nos cães com aquela alergia, tal como vem sendo estudado para os humanos21. Com efeito, apesar da ampla gama de produtos inseticidas e acaricidas atualmente disponíveis no mercado veterinário, em termos práticos uma total exclusão da suscetibilidade à picada de ixodídeos não é possível, favorecendo a sensibilização primária através da picada, com a subsequente resposta alérgica cruzada após a ingestão de carne de vaca. Além disso, estudos por citometria de fluxo, de avaliação da activação de basófilos5, da libertação de citocinas inflamatórias, como TNF -α com baixa expressão de TGF -β1, mediada por células T22, ou a expressão de IL-33 monocítica23,24, devem também ser conduzidos, visando a padronização destes métodos para o cão, o que será especialmente importante em termos diagnósticos, perante uma suspeita de alergia alimentar grave, mediada ou não por IgE25.
CONCLUSÕES
Não obstante os resultados observados, inicialmente inesperados, de associação positiva entre os TID e a resposta clínica favorável após exclusão alimentar das carnes implicadas, mais investigação é necessária no que toca à alergia alimentar mediada por IgE, com uma população de estudo maior.
A investigação futura deverá aferir a utilidade real dos TID, em associação com o imunodot ou outros métodos, no diagnóstico de alergia alimentar, tendo em conta a inerente demora da prova diagnóstica clássica, constituída pela dieta de exclusão (raramente inferior a 2 meses)3.
O recurso a métodos de diagnóstico alergológico molecular poderá permitir esclarecer fenómenos inerentes a reatividade cruzada, e métodos de avaliação da imunidade celular poderão, adicionalmente, permitir identificar processos de alergia alimentar não mediados por IgE.
REFERÊNCIAS
1. Hensel P, Santoro D, Favrot C, Hill P, Griffin C. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Vet Res 2015;11:196. [ Links ]
2. Favrot C, Steffan J. Seewald W. Picco F. A prospective study on the clinical features of chronic canine atopic dermatitis and its diagnosis. Vet Dermatol 2010;21:23-31. [ Links ]
3. Lloyd D. Diagnosis and management of adverse food reactions in the dog. Proceedings of the World Congress WSAVA/ FECAVA/CSAVA. Prague, Czech Republic. 2006;232-5. [ Links ]
4. Picco F, Zini E, Nett C, Naegeli C, Bigler B, Rufenacht S, et al. A prospective study on canine atopic dermatitis and food-induced allergic dermatitis in Switzerland. Vet. Dermatol 2008;19:150-5. [ Links ]
5. Martins L, Bento O, Inacio F. Veterinary allergy diagnosis: past, present and future perspectives. Allergo J Int 2016;25:20-32. [ Links ]
6. Osborn SC. Food allergy dermatitis. Proceedings of the North American Veterinary Conference. Orlando, USA. 2006;20:365-6. [ Links ]
7. Loewenstein C, Mueller RS. A review of allergen-specific immunotherapyin human and veterinary medicine. Vet Dermatol 2009;20:84 -98. [ Links ]
8. Olivry T, DeBoer DJ, Favrot C, Jackson HA, Mueller RS, Nuttall T, et al. Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Disea ses of Animals (ICADA). BMC Vet Res 2015;11:210. [ Links ]
9. Mueller RS, Olivry T, Prelaud P. Critically appraised topic on adverse food reactions of companion animals (2): common food allergen sources in dogs and cats. BMC Vet Res 2016;12:9. [ Links ]
10. Mueller RS, Olivry T, Prelaud P. Critically appraised topic on adverse food reactions of companion animals (1): duration of elimination diets. BMC Vet Res 2015;11:225. [ Links ]
11. Mueller RS, Olivry T. Critically appraised topic on adverse food reactions of companion animals (4): can we diagnose adverse food reactions in dogs and cats with in vivo or in vitro tests? BMC Vet Res 2017;13:275. [ Links ]
12. Favrot C, Linek M, Fontaine J, Beco L, Rostaher A, Fischer N, et al. Western blot analysis of sera from dogs with suspected foodallergy. Vet Dermatol 2017;28:189 -e42. [ Links ]
13. Puigdemont A, Brazis P, Serra M, Fondati A. Immunologic responses against hydrolyzed soy protein in dogs with experimentally induced soy hypersensitivity. Am J Vet Res 2006;67:484 -8. [ Links ]
14. Kunkle G, Horner S. Validity of skin testing for diagnosis of food allergy in dogs. J Am Vet Med Assoc 1992;200:677 -80. [ Links ]
15. Ishida R, Masuda K, Kurata K, Ohno K, Tsujimoto H. Lymphocyte blastogenic responses to inciting food allergens in dogs with food hypersensitivity. J Vet Int Med 2004;18:25-30. [ Links ]
16. Olivry T. International Task Force of Canine Atopic Dermatitis. New diagnostic criteria for canine atopic dermatitis. Vet Dermatol 2010;21:123-6. [ Links ]
17. Lee KW, Blankenship KD, McCurry ZM. Performance characteristics of a monoclonal antibody cocktail -based ELISA for detection of allergen -specific IgE in dogs and comparison with a high affinity IgE receptor -based ELISA. Vet Dermatol 2009;20:157-64. [ Links ]
18. Muller H, Schweizer B. Biochemical applications for UV/Vis spectroscopy. Norwalk, USA: Perkin -Elmer Corporation, 1993. [ Links ]
19. Saridomichelakis MN, Olivry T. An update on the treatment of canine atopic dermatitis. Vet J 2016;207:29-37. [ Links ]
20. Nunen S. Tick -induced allergies: mammalian meat allergy, tick anaphylaxis and their significance. Asia Pac Allergy 2015;5:3-16. [ Links ]
21. Fischer J, Lupberger E, Hebsaker J, Blumenstock G, Aichinger E, Yazdi AS, et al. Prevalence of type I sensitization to alpha-gal in forest service employees and hunters. Allergy 2017;72:1540-7. [ Links ]
22. Tan JA, Smith WB. None IgE -mediated gastrointestinal food hypersensitivity syndrome in adults. J Allergy Clin Immunol Pract 2014;2:355-7. [ Links ]
23. Jensen -Jarolim E, Pali -Scholl I, Roth -Walter F. Outstanding animal studies in allergy I. From asthma to food allergy and anaphylaxis. Curr Opin Allergy Clin Immunol 2017;17:169-79. [ Links ]
24. Lott JM, Sumpter TL, Turnquist HR. New dog and new tricks: evolving roles for IL -33 in type 2 immunity. J Leukoc Biol 2015; 297:1037-48. [ Links ]
25. Suto A, Suto Y, Onohara N, Tomizawa Y, Yamamoto-Sugawara Y, Okayama T, et al. Food allergens inducing a lymphocyte-mediated immunological reaction in canine atopic -like dermatitis. J Vet Med Sci 2015;77:251 -4. [ Links ]
Luis Miguel Lourenco Martins
E-mail: lmlm@uevora.pt
Data de receção / Received in: 20/12/2017
Data de aceitação / Accepted for publication in: 08/03/2018