Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Arquivos de Medicina
versão On-line ISSN 2183-2447
Arq Med vol.24 no.5 Porto out. 2010
ARTIGO DE REVISÃO
Efeitos da Glutamina no Câncer Colorretal Evidências da Literatura
Effects of Glutamine in the Colorectal Cancer
Ana Lilian Bispo dos Santos*, Maria Rita Carvalho Garbi Novaes*, Daniel Carvalho de Toledo*, Pedro Henrique Lourenço Cavalcante*
*Fundação de Ensino e Pesquisa em Ciências da Saúde do Distrito Federal – FEPECS, Brasília, Brasil
RESUMO
O câncer é responsável por aproximadamente, 14% das causas de mortalidade, sendo o câncer colorretal (CCR) o terceiro tipo mais frequente de neoplasia maligna no mundo. Estudos demonstram que a suplementação dietética com glutamina tem diminuído os efeitos colaterais do tratamento antineoplásico. O objetivo deste estudo foi realizar uma análise crítica da literatura, que elucidasse os efeitos da glutamina em portadores de CCR. Foi realizada consulta de artigos originais e de revisão publicados nas bases de dados: LILACS, ENSP, FSP, HISA, PAHO, WHOLIS, Cochrane e MEDLINE, no período de janeiro de 1980 a dezembro de 2009, utilizando-se os descritores: glutamina e neoplasia/câncer colorretal nos idiomas inglês, espanhole português. Obtiveram-se 65 artigos nas seguintes bases: Cochrane (41,5%) e MEDLINE (58,5%), sendo selecionados 13 artigos, que atenderam aos critérios de inclusão e foram utilizados nas tabelas de estudos clínicos e experimentais. Destes, 33,3% eram procedentes da Cochrane e 66,7% do MEDLINE. Estudos conduzidos em animais e humanos demonstraram que na presença de CCR, a glutamina apresentou possíveis efeitos na redução do crescimento tumoral, melhoria na resposta imunológica e maior sensibilidade do tumor ao tratamento quimioterápico por reduzir os níveis de glutationa tumoral e aumentar ou manter os estoques desse antioxidante no intestino. Contudo, são necessários estudos controlados e randomizados adicionais,para elucidar os possíveis efeitos e os mecanismos de ação da glutamina em uma casuística ampliada com diferentes estadiamentos do câncer colorretal.
Palavras-chave: câncer; glutamina; suplementação alimentar
SUMMARY
Cancer is responsible for approximately 14% of all causes of mortality, being colorectal cancer (CRC) the third most common type of malignancy in the world. Studies show that a dietary supplementation with glutamine has decreased the side effects of cancer treatment. The aim of this study was to make a critical analysis of the literature so as to elucidate the effects of glutamine in patients with CRC. Consultation was done in original papers and published review in the following databases: LILACS, ENSP, FSP, HISA, PAHO, WHOLIS, Cochrane e MEDLINE, from January 1980 to December 2009, using descriptors: glutamine and colorectal cancer in English, Spanish and Portuguese. Sixty-five articles were obtained based as follow: Cochrane (41.5%), MEDLINE (58.5%). Thirteen articles that met the criteria for inclusion were selected and used in tables of clinical and experimental studies. Of these, 33.3% were from Cochrane and 66.7% from MEDLINE. Studies conducted with animals and humans have shown that in the presence of CRC, glutamine may have effects on the reduction of tumor growth improving immune response and increasing tumor sensitivity to chemotherapy, since it reduces the levels of tumoral glutathione and increases or maintains the stock of this antioxidant in the intestines. However, additional controlled and randomized trials are needed in order to elucidate the possible effects and mechanisms of action of glutamine in larger sample with different colorectal cancer staging.
Key-words: cancer; glutamine; supplementary feeding
Introdução
O câncer, doença caracterizada pelo crescimento anormal e progressivo da célula a partir de alterações em nível de DNA, é responsável, anualmente, por mais de 7,6 milhões de óbitos no mundo, o que corresponde a, aproximadamente, 14% das causas de mortalidade (1). No Brasil o câncer representa a segunda causa de morte, perdendo apenas para as doenças cardiovasculares (2-4).
O câncer colorretal (CCR) é o terceiro tipo mais frequente deneoplasia maligna no mundo, em ambos os sexos, e o segundo em países desenvolvidos. No Brasil, a estimativa para este tipo de neoplasia em 2010 foi de 13.310 e 14.800 novos casos em homens e mulheres, respectivamente (1).
No CCR, a história familiar de câncer de cólon e reto e a predisposição genética ao desenvolvimento de doenças crônicas do intestino, como as poliposes adenomatosas, assim como o alto consumo de alimentosricos em gordura animal e a baixa ingestão de frutas, verduras, legumes e cereais constituem-se fatores de risco. Os pacientes portadores de retocolite ulcerativa (RCU) inespecífica e doença de Crohn (DC) têm maior chance de desenvolver esta neoplasia (1).
O risco de desenvolvimento de CCR por RCU e DC tem aumentado anualmente, alcançando cerca de 12-20% do risco depois dos 30 anos (5).
Estudos revelam que pacientes com câncer apresentam maior comprometimento do estado nutricional, sendo evidenciada a desnutrição em 40-80% dos casos e perda ponderal superior a 10% em cerca de 30% dos pacientes oncológicos (6,7).
A terapêutica antineoplásica pode comprometer ainda mais o estado nutricional, desencadeando graus variados de desnutrição devido a seus efeitos colaterais, que afetam indiretamente a ingestão alimentar e a absorção de nutrientes (8).
Nos pacientes oncológicos com diagnóstico mais tardio é observado o desenvolvimento de desnutrição grave, a caquexia caracterizada por manifestações clínicas como anorexia, perda involuntária e intensa de peso, depleção de massa muscular com ou sem perda de tecido adiposo, crescimento retardado em crianças, fmal e a baixa ingestão de frutas, verduras, legumes e cereais albuminemia, inflamação, resistência fadiga, anemia, hipoalbuminemia, inflamação, resistência à insulina, dentre outras (9,10).
A caquexia está associada à diminuição da resposta ao tratamento específico, da qualidade de vida e à diminuição da auto-estima, além de maiores riscos de infecção pós operatória e aumento da morbimortalidade (8).
Evidências científicas demonstram que a suplementação dietética com glutamina tem ajudado os pacientes oncológicos a enfrentar os efeitos colaterais do tratamento antineoplásico devido aos seus efeitos protetores sobre a mucosa intestinal, células neurais e do sistema imunológico, além de aumentar a sensibilidade tumoral ao tratamento quimioterápico (10-16).
O objetivo deste estudo foi realizar uma análise da literatura, baseada em evidências científicas, que elucidassem os efeitos obtidos após a suplementação nutricional com glutamina em pacientes com câncer colorretal.
Metodologia
Este trabalho consiste em revisão bibliográfica, realizada após consulta de artigos originais e de revisão publicados em revistas indexadas nas bases de dados: LILACS (Literatura Latino-Americana e do Caribe em Saúde Pública), ENSP (Acervo Virtual da Biblioteca da Escola Nacional de Saúde Pública), FSP (Acervo Virtual da Biblioteca da Faculdadede Saúde Pública da USP), HISA (Base Bibliográfica Virtual em História da Saúde Pública na América Latina e Caribe), PAHO (Acervo Virtual da Biblioteca da Organização Pan-Americana de Saúde), WHOLIS (Sistema de Informação da Biblioteca da OMS), Cochrane, (The Cochrane Library) e MEDLINE (Literatura Internacional em Ciências da Saúde) publicados no período de Janeiro de 1980 a Dezembro de 2009, utilizando-se os descritores indexados no MEDLINE: glutamina e neoplasia/câncer colorretal nos idiomas inglês, espanhol e português.
Critérios de inclusão para seleção dos artigos: os estudos deveriam ser conduzidos em pacientes adultos ou animais com câncer colorretal e que utilizassem a suplementação com glutamina.
Obteve-se 65 artigos nas seguintes bases: LILACS (0%),ENSP (0%), FSP (0%), HISA (0%), PAHO (0%), WHOLIS (0%), Cochrane (41,5%) e MEDLINE (58,5%). Dentre eles, foram excluídas 21 duplicações encontradas nas diferentes bases consultadas, ou seja, na verdade, obtiveram-se 44 artigos. Após análise detalhada, 13 artigos atenderam aos critérios de inclusão, sendo que, destes, 66,7% eram procedentes do MEDLINE e 33,3% da Cochrane. Os artigos selecionados foram utilizados nas tabelas de estudos clínicos e experimentais.
Dos artigos foram extraídas informações em relação ao tipo de estudo realizado, tratamento antineoplásico, via de administração e posologia da glutamina, efeitos adversos, sujeitos da pesquisa e tumor.
Bioquímica da glutamina
A glutamina (NH2-C(O)-CH2-CH2-CHNH2-COOH) é aminoácido mais abundante no sangue, com peso molecu-olar de aproximadamente 147,1; pode ser sintetizada por todos os tecidos do organismo e representa 60% de todos os aminoácidos livre do músculo esquelético (14,17). Écomposta por carbono (41,09%), oxigênio (32,84%), nitrogênio (19,17%) e hidrogênio (6,90%) (17,18). Foi classificada como aminoácido não essencial, mas por se tornar indispensável em situações catabólicas, diversos autores vêm considerando este aminoácido como condicionalmente essencial. Comporta-se como combustível oxidativo para células de rápida replicação no trato gastrointestinal, como enterócitos e colonócitos e células imunológicas, como macrófagos e linfócitos (19,13).
Esse aminoácido contém dois grupos amina por molécula, desempenhando a importante função de transportador de nitrogênio (14). A glutamina atua no sistema nervoso central (SNC), como única via capaz de eliminar íons de amônia, altamente tóxico para as células neurais (13). A glutamina também está envolvida na proliferação e desenvolvimento de células, em especial do sistema imune, além da doação de esqueletos de carbono para a gliconeogênese (18,20).
O metabolismo da glutamina envolve duas enzimas responsáveis pela síntese e degradação deste aminoácido (Figura 1). São elas: a glutamina sintetase e a glutaminase. A glutamina sintetase é a enzima responsável pela síntese de glutamina a partir do glutamato, sendo a reação inversa catabolizada pela enzima glutaminase (20-22).
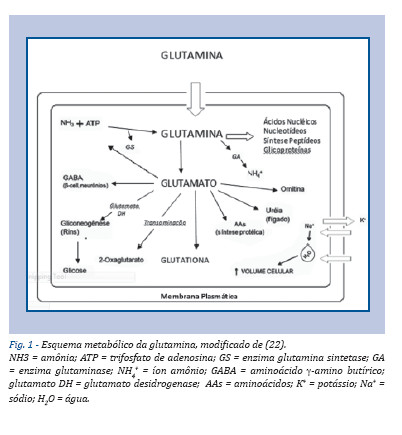
No cérebro, a glutamina sintetase é utilizada como um importante agente na redução da concentração de amônia, com consequente desintoxicação e produção de glutamina para novasíntese de glutamato (21). No pulmão e no músculo esquelético, é responsável pela manutenção da concentração de glutamina plasmática, sendo essencial em situações patológicas ou de estresse (23). Nos rins, a glutamina sintetase é imprescindível para o controle do metabolismo do nitrogênio e manutenção do pH no organismo (24).
A glutaminase é a enzima que catalisa a hidrólise de glutamina em glutamato e íon amônio. A hidrólise da glutamina representa o primeiro passo na sua utilização a partir da síntese do glutamato. Outras reações podem ocorrer principalmente na via que permite o consumo de glutamina no ciclo do ácido tricarboxílico (25). A glutaminase pode ser encontrada no fígado e nos demais tecidos, tais como rins, cérebro, leucócitos e trato gastrintestinal. Contudo, a sua forma mais ativa apresenta-se principalmente nas mitocôndrias (24).
Alguns tipos de células, tais como células do sistema imune, rins e intestino, apresentam elevada atividade glutaminase, sendo considerados tecidos consumidores glutamina (24). Por outro lado, os músculos esqueléticos,os pulmões, o fígado, o cérebro e, possivelmente, o tecido adiposo apresentam elevada atividade da enzima glutamina sintetase e são considerados tecidos sintetizadores de glutamina (26,27).
Efeitos fisiológicos da glutamina no cólon e reto
Os ácidos graxos de cadeia curta, principalmente os ácidos acético, propiônico e butírico são fontes energéticas primárias das células epiteliais da mucosa colônica. Eles são formados pela fermentação bacteriana anaeróbica de fibras residuais contidas no bolo fecal (28). Em segmentos do cólon, a ausência do bolo fecal impede a formação desses ácidos, bem como sua consequente absorção e utilização pelas células epiteliais. A glutamina, que é um substrato energético secundário para essas células, passa a ser primordial, podendo ser utilizada preferencialmente à glicose como fonte energética (29).
Estudos têm demonstrado que a glutamina pode ser um elemento com atividade energética e trófica importante para o cólon submetido a situações de estresse, que apresenta atrofia da parede epitelial (30).
Segundo René et al. (31), pacientes portadores de tumores gastrointestinais, apontaram concentração três vezes maior de glutamina em vasos que irrigavam o jejuno, em relação à concentração em vasos do íleo e cólon, concluindo que, quantitativamente, a glutamina é um substrato mais importante para as porções proximais do intestino.
Propriedades terapêuticas da glutamina
A função protetora da glutamina, tanto sobre a mucosa intestinal quanto sobre as células neurais e do sistema imunológico, tem sido identificada em humanos e ratos com câncer submetidos à quimioterapia e/ou radioterapia. São evidenciados ainda os possíveis efeitos terapêuticos da glutamina na prevenção de danos aos tecidos normais,incluindo os nervos periféricos, durante os tratamentos antitumorais (11-15,32).
A glutamina tem demonstrado efeitos na redução da perda do peso corporal, da anorexia e da degradação do tecido muscular durante a quimioterapia, além de tornar o tumor mais sensível ao tratamento quimioterápico, inibindo seu crescimento, por reduzir os níveis de glutationa tumoral e aumentar ou manter os estoques desse antioxidante no intestino (12,16,33).
Os peroxisome proliferator-activated receptors (PPARs) são receptores dos hormônios nucleares, e regulam a expressão dos genes responsivos. Eles também antagonizam a atividade de transcrição de fatores envolvidos na inflamação e na imunidade. Existem três isotipos de PPARs (PPARγ,PPARφ e PPARγ), cada um representa um alvo terapêutico (34). O subtipo PPARγ, em particular, representa um potencial alvo terapêutico para a quimioprevenção do CCR e das doenças inflamatórias do intestino (5).
PPARγ atua regulando a diferenciação celular do cólon.Fiatte (35) concluiu em seu estudo que a L-glutamina modula a expressão deste receptor em células Caco-2. A PPARγ diminui a modulação inflamatória e produz ação antiproliferativa e pró-apoptótica em células epiteliais. O que suprimi o processo inflamatório em pacientes com RCU ou DC, que compõem o grupo de alto risco para o desenvolvimento de CCR, podendo ser indicada como neoadjuvantee/ou adjuvante no tratamento preventivo das neoplasias colorretais malignas (35,5).
Efeitos adversos e toxicidade da glutamina
Alguns pesquisadores se preocupam com a possívelrelação entre o crescimento do tumor e a suplementaçãoda glutamina, devido a observação dos baixos níveis desseaminoácido apresentados pela maioria das pessoas comcâncer (36-38).
Estudos experimentais conduzidos em animais e humanos, entretanto, demonstram que o câncer colorretal não atua como sequestrador de glutamina (31,39-41), tendo este aminoácido o efeito de reduzir o crescimento tumoral por sua influência na melhora da resposta imune e portornar o tumor mais sensível ao tratamento quimioterápico (13,16,42,43).
Monson & Schoenstadt (44) referem, em seu estudo, os efeitos neuropsicomotores da glutamina, principalmente em pacientes com enfermidades dessa natureza, como o transtorno bipolar. Eles notaram o surgimento de transtornos depressivos e perda de memória após aplicação parenteral de glutamina. Porém, cabe ressaltar que vários pacientes incluídos no estudo já sofriam de depressão ou lapsos de memória, não sendo possível relação patognomónica. Também foram levantadas questões sobre a possível nefrotoxidade da glutamina. Estudos com pacientes oncológicos em tratamento quimioterápico relatam que a elevação sérica de glutamina tem alto valor preditivo no desenvolvimento de insuficiência renal (45). Todavia, realizando um trabalho com pacientes críticos, Orfila et al. (46) concluíram que a suplementação com glutamina reduziu a incidência de falência renal, hiperglicemia, além de determinar maior rapidez na evolução clínica do paciente.
Segundo Curi (17), a preocupação dos pesquisadores seria com a toxicidade da glutamina livre para uso clínico, devido a liberação de amônia antes e após sua administração. Entretanto, as taxas de amônia liberadas parecem ser insignificantes para causarem efeitos tóxicos. Permanece ainda a necessidade de avaliações mais detalhadas, nos casos de pacientes com função hepática comprometida(47). A depuração plasmática dos dipeptídeos de glutamina em pacientes com cirrose hepática não se altera de modo marcante, mas a insuficiência renal crônica diminui (48).Sendo assim, as condições fisiológicas de cada paciente interferem na toxicidade da glutamina e esta deve ser melhor avaliada (49).
Consequências nutricionais do tratamento antineoplásico
A terapêutica antitumoral compreende a quimioterapia, a radioterapia, a imunoterapia, a hormonioterapia, a cirurgia ou a combinação destas. Cada uma das modalidades de tratamento pode ocasionar alterações nutricionais, interferindo na capacidade de ingestão, digestão e absorção adequada de nutrientes (50), além de afetar a deglutição e o paladar (7). Os medicamentos podem afetar indiretamente a ingestão alimentare a absorção por meio dos desconfortos no sistema digestório, como náuseas, vômitos, anorexia, dor abdominal, diarréia, febre, estomatite, mucosite e aversão alimentar (8).
A radioterapia diminui a atividade proliferativa nas criptas, interrompendo o suprimento de células às vilosidades e diminuindo a sua espessura e a superfície absortiva da mucosa. Uma das possíveis consequências desta terapia é enterite, que se manifesta clinicamente por dor abdominala em cólica, diarréia e má-absorção, podendo determinar a interrupção do tratamento (13).
O procedimento cirúrgico está associado ao hipermetabolismo, à degradação de tecidos e à perda protéica. Estas alterações propiciam a diminuição do peso, a fadiga e a deterioração da capacidade funcional (8).
O câncer produz um estado de esforço fisiológico caracterizado por deficiência relativa da glutamina, que podeser agravada pelos efeitos do tratamento antineoplásico(12,14). E a depleção de glutamina pode causar atrofia epitelial do intestino delgado, estando associada ao colapso dabarreira intestinal e a maior probabilidade de translocaçãobacteriana (11).
Estudos experimentais e clínicos com a utilizag ção da glutamina
Estudos conduzidos em animais de laboratório eem humanos portadores de câncer demonstram efeitosbenéficos após a suplementação dietética com glutamina(Tabelas 1
e 2).
Estudos experimentais em animais
Foi observado que a suplementação oral de glutamina em ratos possivelmente melhorou a seletividade das drogas antitumorais e a sensibilidade das células tumorais a (Tabela 1).
Ensaios clínicos com glutamina em pacientes com câncer colorretal
A suplementação da glutamina em estudos clínicos foi capaz de reduzir a incidência e a severidade de neuropatias periféricas sem interferir na resposta a quimioterapia e na sobrevida dos pacientes (Tabela 2). Foi observada ainda a diminuição do tempo de internação, melhoria dos efeitos colaterais da quimioterapia e melhorano estado nutricionale na recuperação linfocitária de pacientes cirúrgicos.
Considerações finais
Cabe mencionar que a principal limitação do presente estudo foi o fato de os pesquisadores não submeterem para publicação relatórios de pesquisa que produziram resultados negativos. Tal limitação caracteriza o que se denomina viés de publicação. Apesar dessa limitação, o estudo trouxe um resultado positivo, pois possibilitou as seguintes conclusões:
a) pesquisas conduzidas em animais e humanos com câncer colorretal demonstraram que a glutamina traz resultados benéficos na redução do crescimento tumoral;
b) melhoria na resposta imunológica;
c) aumento na sensibilidade do tumor ao tratamento quimioterápico por reduzir os níveis de glutationa tumoral e aumentar ou manter a concentração desse antioxidante no intestino. Contudo, são necessários estudos controlado se randomizados adicionais aos já realizados para elucidaros possíveis mecanismos de ação da glutamina em uma casuística ampliada com diferentes tipos câncer.
Agradecimentos
Os autores agradecem o apoio financeiro (bolsas de Iniciação Científica) recebido pela Fundação de Ensino e Pesquisa em Ciências da Saúde da Secretaria de Estado de Saúde do Distrito Federal ao projeto de pesquisa do qual resultou este artigo de revisão.
Fonte financiadora
Apoio financeiro (bolsas de Iniciação Científica) recebido pela Fundação de Ensino e Pesquisa em Ciências da Saúde da Secretaria de Estado de Saúde do Distrito Federal ao projeto de pesquisa do qual resultou este artigo de revisão.
Referências
1 - Instituto Nacional do Câncer; Ministério da Saúde, Secretaria de Atenção à Saude, Coordenação de Prevenção e Vigilância do Cancer. Estimativas 2010: Incidência de Câncer Brasil. Rio de Janeiro (Brasil): INCA; 2009 [ Links ]
2 - Silva SMCS, Mura JDPM. Tratado de Alimentação, nutrição & dietoerapia. São Paulo :Roca;2007 [ Links ]
3 - Fortes RC, Melo AL, Recôva VL, Novaes CG. Hábitos dietéticos de pacientes com cancer coloretal em fase pós-operatoria. Rev Bras Cancerol 2007;53:277-89. [ Links ]
4 – Fortes RC, Melo AL, Recova VL, Novaes MRCG. Alterações lipídicas em pacientes com cancer colorretal em F e Pós-operatorio: Ensaio clinico Randomizado e Duplo-Cego com fungos Agaricus Syivaticus. Rev Bras Coloproct 2008:28: 281-8 [ Links ]
5 - Carter AB, Miyak SA, Hontecillas R, Bassaganya- Riera J. Modulation of inflammation- induced colorectal Cancer through PPARy. PPAR Res 2009; 2009: 1-9 [ Links ]
6 – Garófolo A, Petrilli, AS. Balanço entre ácidos graxos omega – 3 e 6 na resposta inflamatória em pacientes com câncer e caquexia. Rev Nut 2006;19:611-21 [ Links ]
7 – Araujo FF, Silva CC, Fortes RC. Terapia nutricional enteral em pacientes ocológicos: uma revisão da literatura. Com Ciencias Saúde 2008;19:61-70 [ Links ]
8 – Ulsenheimer A, SIlva ACPS, Fortuna FVF. Perfil nutricional enteral em pacientes com câncer segundo diferentes indicadores de avaliação. Rev Bras Nutr Clin 2007;22:292-7 [ Links ]
9 – Fortes RC, Novaes MRCG. Efeitos da suplementação dietética com cogumelos Agaricales e outros fungos medicinais na terapia contra cancer. Rev Bras Cancerol 2006;52:363-71 [ Links ]
10 – Evans Wj, Morley Je, Argiles J, et al. Cachexia: a new definition. Clin Nutr 2008;27:1-7 [ Links ]
11 – Perrone F, Gallo C, et al. Oral glutamine in the prevention of fluorouracil induced intestinal toxicity: a double blind, placebo controlled, randomized trial. Gut 2001;48:28-33 [ Links ]
12 – Savarese DM, Savy G, Vahdat L, Wischmeyer PE, Corey B. Prevention of chemotherapy. Cancer Treat Rev 2003:29:501-13 [ Links ]
13 – Diestel CF, Lopes-Paulo F, Arq es RG, Horts NL, Caetano CER. Efeito da suplementação oral de l-glutamina na parede colónica de ratos submetidos à irradiação abdominal. Act Cir Bras 2005; 20: 94-100
14 - Wang WS, Lin JK, Lin TC, et al. Oral glutamine is effective for preventing oxaliplatininduced neuropathy in colorectal cancer patients. Oncologist 2007;12:312-19. [ Links ]
15 - Cunha-Lopes WM, Aguilar-Nascimento JE, Dock-Nascimento D, Gomes-Da-Silva MHJ, Silva VAT. Associação de glutamina e probióticos no trofismo mucoso do cólon na peritonite experimental. Rev Col Bras Cir 2007;34:48-53. [ Links ]
16 - Xue H, Le Roy S, Sawyer MB, Field CJ, Dieleman LA, Baracos VE. Single and combined supplementation of glutamine and n-3 polyunsaturated fatty acids on host tolerance and tumour response to 7-ethyl-10-[4-(1-piperidino)-1-piperidino] carbonyloxy camptothecin.(CPT-11)/5-fluorouracil chemotherapy in rats bearing Ward colon tumour. Br J Nutr 2009;2:1-9.
17 - Curi R. Glutamina: metabolismo e aplicações clínicas e no esporte. Rio de Janeiro: Sprint; 2000. [ Links ]
18 - Rogero MM, Tirapegui JO. Considerações nutricionais e bioquímicas da suplementação de glutamina em atletas: controvérsias e aspectos atuais. J Metab Nutr 2003;7:106-17. [ Links ]
19 - Neu J, Demarco V, Li N. Glutamine: clinical applications and mechanisms of action. Curr Opin Clin Nutr Metab Care 2002;5:69-75. [ Links ]
20 - Newsholme P, Lima MMR, Procopio J, et al. Glutamine and glutamate as vital metabolites. Braz J Med Biol Res 2003;36:153-63. [ Links ]
21 - Rowbotton DG, Keast D, Morton AR. The emerging role of glutamine as an indicator of exercise stress and overtrai-ning. Sports Med 1996;21:80-97. [ Links ]
22 - Cruzat VF, Petry ER, Tirapegui J. Glutamina: Aspectos Bioquímicos, Metabólicos, Moleculares e Suplementação. Rev Bras Med Esporte 2009;15:392-7. [ Links ]
23 - Pinel C, Coxam V, Mignon M, et al. Alterations in glutamine synthetase activity in rat skeletal muscle are associated with advanced age. Nutr 2006;22:778-85. [ Links ]
24 - Labow BI, Souba WW, Abcouwer SF. Mechanisms governing the expression of the enzymes of glutamine metabolism – glutaminase and glutamine synthetase. J Nutr 2001;131:2467-74. [ Links ]
25 - Rennie MJ, Bowtell JL, Bruce M, Khogali SEO. Interaction between glutamine availability and metabolism of glycogen, tricarboxylic acid cycle intermediates and glutathione. J Nutr 2001;131:2488-90. [ Links ]
26 - Newsholme P, Procopio J, Lima MMR, Pithon-Curi TC, Curi R. Glutamine and glutamate – their central role in cell metabolism and function. Cell Biochem Funct 2003;21:1-9. [ Links ]
27 - Cruzat VF, Rogero MM, Borges MC, Tirapegui J. Aspectos atuais sobre estresse oxidativo, exercícios físicos e suplementação. Rev Bras Med Esporte 2007;13:336-42. [ Links ]
28 - Cukier C, Magnoni D, Alvarez TS. Nutrição Baseada na Fisiologia dos Órgãos e Sistemas. São Paulo: Sarvier; 2005. [ Links ]
29 - Lopes-Paulo F. Alterações estruturais na mucosa do cólon derivado – Estudo estereológico experimental em ratos. Rev Bras Coloproc 2002;22:164-9. [ Links ]
30 - Khan J, Liboshi Y, Cui L, et al. Alanyl-glutamine-supplemented parenteral nutrition increases luminal mucus gel and decreases permeability in the rat small intestine. J Parenter Enter Nutr 1999;23:24-31. [ Links ]
31 - René RWJH, Maarten FM, Nicolas EPD, Peter BS. Glutamine Extraction by the Gut Is Reduced in Patients with Depleted Gastrointestinal Cancer. Ann Surg 1997;225(1):112-21. [ Links ]
32 - Vahdat L, Papadopoulos K, Lange D, et al. Reduction of paclitaxel-induced peripheral neuropathy with glutamine. Clin Cancer Res 2001;7:1192-7. [ Links ]
33 - Rouse BSK, Nwokedi BSE, Woodliff EJ, Epstein J, Klimberg VS. Glutamine Enhances Selectivity of Chemotherapy Through Changes in Glutathione Metabolism. Ann Surg 1995;221:420-6. [ Links ]
34 - Kostadinova R, Wahli W, Michalik L. PPARs in diseases: control mechanisms of inflammation. Curr Med Chem 2005;12:2995-3009. [ Links ]
35 - Fiatte C, Huin C, Collet P, Plénat F, Dauça M, Schohn H. Expression of PPARgamma is reduced by medium supplementation with L-glutamine in human colorectal Caco-2 cells. Int J Mol Med 2008;22:825-32. [ Links ]
36 - Decker GM. Glutamine: Indicated in Cancer Care? Clin J Oncol Nurs 2002;6:112-5. [ Links ]
37 - Martins AMCRPF. Metabolismo Da Glutamina Na Célula Tumoral. Arq Inst Biol 2003;70:231-7. [ Links ]
38 - Marino F, Giani I, Clerico G, et al. Glutamine supplementation in colorectal cancer. Colorectal Dis 2007;9:851-9. [ Links ]
39 - Holm E. Substrate Balances across Colonie Carcinomas in Humans. Cancer Research 1995;55:1373-8. [ Links ]
40 - Hagmüller E, Kolimar HB, Gunther H, Hoim E, Trede M. Protein Metabolism in Human Colon Carcinomas: In Vivo Investigations Using a Modified Tracer Technique with L-[1-13C]Leucine. Cancer Research 1995;55:1160-7.
41 - Van Der Hulst RRWJ, Von Meyenfeldt MF, Deutz NEP, Soeters PB. Glutamine Extraction by the Gut Is Reduced in Patients with Depleted Gastrointestinal Cancer. Ann Surg 1997;225:112-21. [ Links ]
42 - Oriordain MG, Fearon KCH, Ross JA, et al. Glutamine-Supplemented Total Parenteral Nutrition Enhances T-Lymphocyte Response in Surgical Patients Undergoing Colorectal Resection. Ann Surg 1994;220:212-21. [ Links ]
43 - Oguz M, Kerem M, Bedirli A, et al. L-alanin-L-glutamine supplementation improves the outcome after colorectal surgery for cancer. Colorectal Dis 2007;9:515--20. [ Links ]
44 - Monson K, Schoenstadt A. Glutamine Side Effects. Washington: Clinaero: Bring Heatth for Life; c 2006-2009. http://www.mental-health.emedtv.com/glutamine/glutamine-side-effects.html [ Links ]
45 - Dols MC, Calle SG, Pino AM, Diaz IA, Garcí JA, Caderon VG, et al. Glutamina sérica como factor predictivo de insuficiencia renal em pacientes oncológicos tratados con quimioterapia basada en cisplatino. Oncologia 2005;28:30-8. [ Links ]
46 - Orfila GM, Talaverón JML, García BG, et al. Utilización de glutamina en nutrición parenteral en paciente crítico: efectos sobre la morbi-mortalidad. Nutr Hosp 2007;22:61-7. [ Links ]
47 - Souba WW, Herskowitz K, Austgen TR, Chen MK, Salloum RM. Glutamine nutrition: theorical considerations and therapeutic impact. J Parent Ent Nutr 1990;14:237-43. [ Links ]
48 - Abumrad NN, Morse EL, Lochs H, Williams PE, Adibi AS. Possible Sources of glutamine for parenteral nutrition: imparei on glutamine metabolism. Am J Physiol 1989;257:228-34. [ Links ]
49 - Hornsby-Lewis L, Shike M, Brown P, klang M, Pearlstone D, Brennan M. LGlutamine supple in home total parenteral nutrition patients: stability, safety, and effects on intestinal absorptkm. J Em Nutr 1994;18:268-73. [ Links ]
50 - Barrére APN, Kamata LH. Informações Nutricionais Para Auxiliar os Pacientes Oncoematológicos a Lidarem com Efeitos Colaterais do Tratamento. Prática Hospitalar 2007;49:25-8. [ Links ]
51- Xue H, Sawyer MB, Field CJ, Dieleman LA, Baracos VE. NutritionalModulation of Antitumor Efficacy and Diarrhea Toxicity Related to Irinotecan Chemotherapy in Rats Bearing theWard Colon Tumor. Clin Cancer Res 2007;23:7146-54. [ Links ]
52 - Xue H, Saeyer MB, Field CJ, Dieleman LA, Murray D, Baracos VE. Bolus Oral Glutamine Protects Rats against CPT-11-Induced Diarrhea and Differentially Activates Cytoprotective Mechanisms in Host Intestine but Not Tumor. J Nutr 2008;138:740-6. [ Links ]
53 - Dupertius YM, PONT GB, Buchegger F, Pichard C. Effect of an immunonutrient mix on human colorectal adenocarcinoma cell growth and viability. Nutr 2007;23:672-80. [ Links ]
54 - Morlion BJ, Stehle P, Wachtler P, et al. Total parenteral nutrition with glutamine dipeptide after major abdominal surgery: a randomized, double-blind, controlled study. Ann Surg 1998;227:302–8. [ Links ]
55 - Fortes RC, Recôva VL, Melo AL, Novaes MRCG. Qualidade de Vida de Pacientes com Câncer Colorretal em Uso de Suplementação Dietética com Fungos Agaricus Sylvaticus após Seis Meses de Segmento: Ensaio Clínico Aleatorizado e Placebo- Controlado. Rev Bras Coloproct 2007;27:130-38. [ Links ]
56 - Jing-Xiang S, Xiao-Huang T, Lie W, Chen-Jing L. Glutamine dipeptide-supplemented parenteral nutrition in patients with colorectal cancer. Clin Nutr 2004;1:49-53. [ Links ]
57 - Li Y, Ping X, Yu B, Liu F, Ni X, Li J. Clinical trial: prophylactic intravenous alanyl-glutamine reduces the severity of gastrointestinal toxicity induced by chemotherapy--a randomized crossover study. Aliment Pharmacol Ther 2009;30:452-8. [ Links ]
58 - Pan CX, Loehrer P, Seitz D, et al. A phase II trial of irinotecan, 5-fluorouracil and leucovorin combined with celecoxib and glutamine as first-line therapy for advanced colorectal cancer. Oncol 2005;69:63-70. [ Links ]
Dr.ª Ana Lilian Bispo dos Santos
FEPECS - Fundação de Ensino e Pesquisa em Ciências da Saúde, SMHN Quadra 03, conjunto A, Bloco 1, Edifício Fepecs Brasília/DF, CEP: 70710-907 Brasil. E-mail: analilian_nutricao@yahoo.com.br














