INTRODUÇÃO
O fruto do castanheiro (Castanea sativa Mill.) é muito apreciado e tem uma importância económica elevada em Trás-os-Montes, no Nordeste de Portugal. A região é responsável por cerca de 80% da produção nacional de castanha, com 45 348 hectares dos 51 496 hectares de soutos em Portugal. (INE, 2021). A elevada qualidade da castanha nesta região foi reconhecida pela União Europeia com a Denominação de Origem Protegida (DOP) "Castanha da Terra Fria" (Regulamento (CE) Nº. 1107/96; Rodrigues, 2010).
A produção de frutos saudáveis para a alimentação pode ser afetada em várias dimensões, por fatores abióticos e bióticos como as doenças e as pragas. Estes problemas podem comprometer a produtividade e, consequentemente, a qualidade dos frutos ao longo da cadeia de produção. Um dos principais e graves problemas da atualidade no setor são as podridões que ocorrem desde a pré-colheita, sendo especialmente grave na pós-colheita, com as condições de armazenamento e as infestações de insetos (Washington et al., 1997; Sieber et al., 2007; Migliorini et al., 2010). Nesse contexto a podridão castanha (‘brown rot’), constitui mais um desafio para os produtores e a indústria transformadora (Lione et al., 2019), tendo sido comprovado que o seu principal agente responsável é uma espécie recentemente descrita do género Gnomoniopsis, Gnomoniopsis smithogilvyi L.A. Shuttleworth, E.C.Y. Liew and D.I. Guest, também conhecido por Gnomoniopsis castanea (Visentin et al., 2012; Shutleworth et al., 2012; Shuttleworth et al., 2013; Maresi et al., 2013; Dar & Rai, 2015; Dennert et al., 2015; Lione et al., 2019; Shuttleworth & Guest, 2017; Vannini et al., 2017; Lione et al., 2019). A espécie parece também estar associada ao aparecimento de cancros da casca do castanheiro, tanto na Europa como na Ásia (Dar e Rai, 2015; Pasche et al., 2016).
Os sintomas característicos da podridão da castanha causada por G. smithogilvyi em castanhas traduz-se no aparecimento de alterações de cor e na degradação da textura, embora em alguns casos a castanha possa aparecer calcificada e desidratada (Visentin et al., 2012; Maresi et al., 2013; Shuttleworth et al., 2013). É de realçar o facto de estes sintomas poderem aparecer somente durante o armazenamento, sendo detetados quando a castanha é aberta e visualizado o seu interior. Porém, em alguns casos, G. smithogilvyi pode viver como endófito em castanhas assintomáticas, impedindo a deteção visual da doença pelos sintomas descritos anteriormente (Dennert et al., 2015; Ruocco et al., 2016).
Os métodos de diagnóstico mais fiáveis para a deteção/identificação de G. smithogilvyi dependem da realização de técnicas microbiológicas convencionais como o isolamento em meios de cultura, entre eles o Agar Extrato de Malte (MEA), Agar de Extratos de Malte e de Levedura (MYA) e o Agar de Batata e Dextrose (PDA), com a posterior identificação de isolados por meio de métodos morfométricos e/ou biomoleculares (Shuttleworth et al., 2012; Visentin et al., 2012). Mais recentemente, foram desenvolvidos métodos de deteção direta deste fungo na castanha, como o “Loop Mediated Isothermal Amplification” (LAMP) em tempo-real, V-LAMP (visual-LAMP) e “Real‑time quantitative PCR”, qPCR (Vettraino et al., 2021).
A investigação a nível internacional tem incidido no desenvolvimento de tratamentos pós-colheita para controlar as podridões da castanha, recorrendo ao uso de armazenamento refrigerado como na Grécia, Itália e Suíça (Mencarelli, 2001; Jermini et al., 2006; Vekiari et al., 2007), o armazenamento em atmosfera controlada, na Itália (Mencarelli, 2001), e tratamentos de água quente na Grécia, Itália, Suíça e EUA (Mignani e Vercesi, 2003; Panagou et al., 2005; Rieger, 2005; Jermini et al., 2006). Na China, Grécia, Itália, Nova Zelândia e EUA, banhos de compostos com atividade antifúngica como iodo, hipoclorito de sódio, natamicina, ácido paracético e outros ácidos orgânicos têm sido utilizados/testados (Paglietta e Bounous, 1979; Giacalone e Bounous, 1993; Mencarelli, 2001, Kader, 2002; Mignani et al., 2003; Panagou et al., 2005; Klinac, 2006; Yang et al., 2006; Donis-Gonzalez, 2008; Donis-Gonzalez et al., 2010).
Desde 1973 os azóis são usados na agricultura, correspondendo a 16% do volume global de fungicidas (Jørgensen e Heick, 2021). Apesar da sua importância e eficácia, os azóis ou os metabolitos resultantes da sua degradação, apresentam elevada toxicidade para a vida aquática com efeitos permanentes, podendo mesmo causar danos nos organismos neonatos (EU, 2022a). Em consequência, muitos compostos, em especial na Europa, têm sido retirados do mercado (propiconazol, bitertanol), ou sê-lo-ão brevemente (epoxiconazol, tebuconazol, difenoconazol e metconazol), podendo provocar um impacto significativo no combate às doenças fúngicas, a curto e a médio prazo (Jørgensen e Heick, 2021). Os tratamentos biológicos usando microrganismos antagonistas como bactérias ou fungos (e.g. Bacillus spp., Trichoderma spp., Gliocladium spp.) têm sido eficazes na redução de doenças in vitro (Pasche et al., 2016) e in situ, com a vantagem de serem mais sustentáveis para o meio ambiente (Filho et al., 2010).
O presente estudo teve como objetivo principal estudar o impacto da aplicação de um fungicida químico e um biológico e outras substâncias (soluções nutritivas), homologados para culturas agrícolas (mas não para C. sativa), por forma a reduzir, na pré-colheita, os níveis de infeção da castanha por G. smithogilvyi. O impacto das aplicações na produtividade e na incidência das podridões (podridão castanha e outras) foi avaliado no final dos ensaios de campo e após um mês e dois meses de refrigeração das castanhas a 4 ºC.
MATERIAL E MÉTODOS
Áreas de estudo
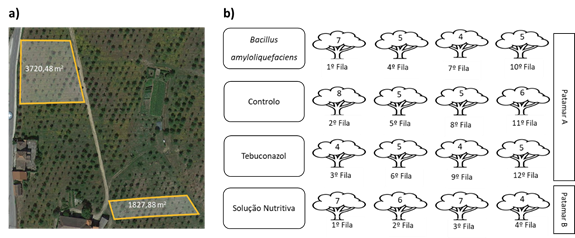
O presente estudo foi realizado ao longo do ano de 2021, num souto com castanheiros da variedade ‘Bouche de Bétizac’, com 8 anos de idade e à altitude de 508 - 525 m. A figura 1 (a) ilustra a área de estudo do souto.
Descrição do Ensaio de Campo
As árvores dispostas em fileiras estão separadas entre si por 3 metros. Durante o período da floração (23, 30 de junho e 7 de julho de 2021) foram individualmente aplicados dois fungicidas, um químico (tebuconazol) e um biológico (Bacillus amyloliquefaciens), e uma solução nutritiva (óxido de silício, óxido de potássio, aminoácidos livres) aplicados a 30 de junho, 30 de julho e 30 de agosto. Os fungicidas foram aplicados em 4 linhas distintas e intercaladas, totalizando 12 linhas no patamar A (figura 1 (a)), com as 4 linhas do controlo (sem tratamento). A solução nutritiva foi aplicada em 4 linhas seguidas no patamar B como ilustra a Figura 1 (a). Todos os tratamentos foram aplicados por pulverização foliar. O número de árvores tratadas variou entre 18 e 24 conforme o tratamento (Figura 1 (b)). As fileiras de castanheiros não apresentavam o mesmo número de árvores devido à mistura de variedades presente no souto.
O Quadro 1 descreve os tratamentos aplicados no souto: produto, composição, princípio ativo, ação, dose e aplicação.
Quadro 1 Descrição dos tratamentos aplicados no souto. Data das aplicações: Serenade® ASO e Horizon® - (23 e 30 de junho, 7 de julho 2021); Codasil - 30 de junho, 30 de julho e 30 de agosto 2021
| Princípio ativo | Ação | Composição | Dose | Aplicação |
|---|---|---|---|---|
| B. amyloliquefaciens (Serenade® ASO) | Biofungicida de contacto com ação bacteriostática de largo espectro | Suspensão concentrada com 1.34% de B. amyloliquefaciens QST 713 (1 x 109 ufc/g) | 1 L/100 L | 3 X |
| Tebuconazol (Horizon®) | Fungicida sistémico contra oídio da videira | Emulsão óleo em água com 250 g/L de tebuconazol | 1 L/100 L | 3 X |
| Óxido de silício, óxido de potássio, aminoácidos livres (Codasil) | Solução nutritiva | SiO2 (26,10 p/v) + K2O (14,62 p/v) + aminoácidos livres (5,22 w/v) | 360 mL/100 L | 3 X |
A recolha dos ouriços foi feita no dia 22 de setembro de 2021 (Quadro 2). Por fila foram colhidos 30 ouriços correspondendo 6-8 por árvore. Na apanha houve o cuidado de colher os ouriços de alturas e exposições solares diferentes. No laboratório, as amostras foram colocadas num lugar fresco e efetuada a avaliação morfológica e da produtividade o mais rápido possível por forma a minimizar as perdas de peso por desidratação.
Quadro 2 Parâmetros de avaliação e número de castanhas na respetiva amostragem
| Parâmetros | Ensaio de campo |
| Avaliação da Produtividade | 120 ouriços/tratamento (30 x 4filas) |
| Qualidade Externa | 200 castanhas/tratamento (50 x 4filas) |
| Qualidade Interna | 200 castanhas/tratamento (50 x 4filas) |
| Avaliação Microbiológica | 10 castanhas/tratamento |
Avaliação da Produtividade
As amostras foram analisadas no Laboratório de Tecnologias Agro-ambientais da UTAD.
A produtividade foi avaliada pelos parâmetros: peso dos ouriços, com e sem castanhas, peso das castanhas, índice de fertilidade, aspeto (enrugadas versus lisas), cor das castanhas, número de castanhas bichadas e podres. O peso dos ouriços e das castanhas foi medido em gramas numa balança digital (Petit Balance MK - 200B) com capacidade de 200 g e precisão de 0,01 g. Após esta avaliação as castanhas foram mantidas separadas por tratamento e refrigeradas (4 ºC) até ao seu processamento.
Qualidade externa
A qualidade externa dos frutos foi avaliada pela visualização de defeitos e sinais visíveis de danos pós-colheita: i) rachaduras; ii) sinais de infestação (presença de orifícios de saída causados pelo gorgulho da castanha); iii) sinais de infeção fúngica (crescimento de bolor visível), conforme descrito por Overy et al. (2003). Os sintomas observados foram contabilizados para cada castanha de modo a calcular a percentagem média de infeção externa e de infestação por tratamento.
Qualidade Interna
Após a inspeção externa, as castanhas foram imersas em lixívia comercial a 5% por 5 minutos, seguidas de três lavagens consecutivas com água destilada e estéril. As castanhas foram secas com papel absorvente e, imediatamente antes da avaliação interna, foram desinfetadas com etanol a 70%. Para a avaliação interna as castanhas foram cortadas longitudinalmente, desinfetando a faca de corte entre cada observação e considerando os seguintes parâmetros: presença/ausência de larvas, infeção fúngica e tipo de podridão visível. A percentagem de superfície com podridão de cada castanha foi estimada visualmente para determinar o nível de infeção conforme proposto por Donis-González et al. (2016). Foram considerados cinco níveis de infeção: L0 (0%), L1 (1-25%), L2 (26-50%), L3 (51-75%) e L4 (76-100%).
Avaliação microbiológica
A monitorização do efeito dos tratamentos sobre a carga microbiana das castanhas foi feita imediatamente na pós-colheita e após um mês e dois meses de refrigeração (4 ºC). Em cada tratamento, foram separadas 10 castanhas saudáveis por tratamento para a pesquisa de fungos contaminantes, principalmente de G. smithogilvyi. Em cada castanha foram assepticamente retiradas de cinco partes diferentes provenientes do hilo, cotilédone, embrião, lado direito e esquerdo, e inoculadas em placa de Petri de 9 cm com meio PDA. Das 200 castanhas por tratamento da avaliação interna e de todas as que apresentavam podridão visível no seu interior, foi adotado o procedimento anterior. Após a inoculação as placas foram fechadas com parafilme( e incubadas a 25 °C por 14 dias. A identificação de G. smithogilvyi foi feita por características culturais e microscópicas por comparação com culturas puras existentes no laboratório e identificadas por biologia molecular a partir das sequências consenso da região ITS (códigos de acesso GenBank OK326904, OK326907 e MW165483). As nossas culturas de referência estão depositadas na Micoteca da Universidade do Minho (MUM) sob os códigos MUM 21.76 (=UTAD3), MUM 21.79 (=UTAD6) e MUM 20.139 (=IPB-GS1).
Todas as amostras foram tratadas em condições assépticas numa câmara de biossegurança BSL2, a fim de evitar qualquer tipo de contaminação secundária.
Análise estatística
Os dados foram analisados utilizando os programas EXCEL 2010 e STATISTICS 12, Versão 20. A análise envolveu a estatística descritiva (médias e respetivos desvios-padrão e percentagens).
Para comparar médias de amostras independentes, foram utilizados testes não paramétricos, como o teste ANOVA Ranks de Kruskal-Wallis e o teste de comparações múltiplas (Z-teste). A hipótese nula foi rejeitada quando o nível de significância crítica foi inferior a 0,05.
RESULTADOS E DISCUSSÃO
Avaliação da Produtividade
Com base nos resultados obtidos, em termos de produtividade, o Quadro 3 apresenta os pesos médios dos principais parâmetros avaliados no ensaio. A média de valores para o ouriço completo e das castanhas bem formadas foi superior em todos os tratamentos realizados quando comparados com o controlo, excetuando o tratamento com tebuconazol, onde os valores médios de todos os parâmetros biométricos foram inferiores. Foram encontradas diferenças significativas entre os tratamentos nos pesos ‘ouriço completo’ (p< 0,001), ‘ouriço’ (p< 0,0001), e ‘castanhas bem formadas’ (p< 0,0001). No Quadro 3 encontra-se assinalado as comparações múltiplas entre os vários tratamentos. No parâmetro ‘castanhas bem formadas’ não foram observadas diferenças (p>0,05) entre os tratamentos controlo/agente de controlo biológico, e controlo/solução nutritiva. No entanto, existiram diferenças significativas (p< 0,05) entre os tratamentos agente de controlo biológico/solução nutritiva. Em termos de produtividade (peso/castanha), o tratamento com tebuconazol foi significativamente (p< 0,05) inferior à dos restantes, seguindo-se do tratamento com B. amyloliquefaciens e solução nutritiva.
Quadro 3 Avaliação da produtividade dos tratamentos efetuados no souto. Valores médios e desvios-padrão (DP) dos parâmetros: ouriço completo, ouriço, castanhas bem formadas (n=120).
| Tratamento | Ouriço completo (g) | Ouriço (g) | Castanhas bem formadas (g) |
| Controlo | 77,8±21,7a | 30,8±9,0a | 18,2±6,4 a, b, d |
| B. amyloliquefaciens | 78,7±26,1ª | 30,4±11,3a | 17,6±7,6 a, b |
| Tebuconazol | 48,4±14,2b | 23,7±7,5b | 8,6±3,1 c |
| Solução nutritiva | 82,3±29,8ª | 32,3±11,5a | 20,8±7,8 a, d |
Letras iguais significam ausência de diferenças significativas (p > 0,05)
Qualidade Externa e Interna
Os resultados obtidos na avaliação externa estão apresentados no Quadro 4. A maior percentagem de danos, ranhuras ou fissuras na casca da castanha, foi registada nas amostras nos tratamentos com tebuconazol (4.5%) e B. amyloliquefaciens (3.5%), embora em valores relativamente baixos. As castanhas de todos os tratamentos apresentaram mais sinais de infestação e de podridões do que o controlo, embora a diferença não seja significativa. É também de salientar diferenças na maturação nas castanhas tratadas com tebuconazol, onde as castanhas imaturas ou verdes representaram 14,5% e 3,5%, respetivamente. No momento da apanha dos frutos, os castanheiros tratados com tebuconazol apresentavam folhas secas e acastanhadas, que poderão ter afetado a produtividade fotossintética e, deste modo, atrasado o desenvolvimento dos frutos, relativamente ao controlo.
Quadro 4 Qualidade externa das castanhas nos diferentes tratamentos do ensaio de campo, expressa em %, de: danos, infestação, podridões, castanhas imaturas e castanhas verdes (n= 200 castanhas/tratamento)
| Tratamento | Danos | Infestação | Podridões | Imaturas | Verdes |
| Controlo | 1,5 | 0,0 | 0,0 | 1,0 | 0,0 |
| Tebuconazol | 4,5 | 0,5 | 1,0 | 14,5 | 3,5 |
| B. amyloliquefaciens | 3,5 | 1,0 | 1,0 | 2,5 | 0,0 |
| Solução nutritiva | 1,0 | 1,0 | 0,5 | 1,5 | 1,0 |
Relativamente à Qualidade interna (visual) os níveis de infeção fúngica foram baixos, predominando o nível L1; em nenhum dos tratamentos não se observou níveis acima de L2 (Quadro 5). O nível mais elevado, L2 foi observado nas amostras do tratamento com B. amyloliquefaciens (0,5%). Nas amostras tratadas com tebuconazol não foi detetada infeção fúngica visível em nenhuma castanha.
Quadro 5 Qualidade interna das castanhas (observação visual) nos diferentes tratamentos do ensaio de campo. Níveis de infeção (L0 (0%), L1 (1-25%), L2 (26-50%), L3 (51-75%) e L4 (76-100%) e tipo de podridão (%) (castanha, preta) (n = 200 castanhas/tratamento)
| Infeção fúngica (%) | Tipo de podridão (%) | ||||||
| Tratamento | L1 | L2 | L3 | L4 | Castanha | Preta | |
| Controlo (a) | 0,5 | 0,0 | 0,0 | 0,0 | 0,5 | 0,0 | |
| Tebuconazol | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | |
| B. amyloliquefaciens | 1,0 | 0,5 | 0,0 | 0,0 | 1,0 | 0,5 | |
| Solução nutritiva | 2,0 | 0,0 | 0,0 | 0,0 | 2,0 | 0,0 | |
A presença de larvas não foi detetada em nenhuma das castanhas tratadas.
As castanhas avaliadas como saudáveis, por inspeção visual, e sobrantes do ensaio, foram refrigeradas e, após um e dois meses, inspecionadas internamente para determinar os níveis de infeção fúngica. Este acompanhamento foi realizado nas mesmas condições das avaliações anteriores, mas com um número menor de castanhas para cada tratamento (n = 10). É de referir que, nas inspeções externas das castanhas, após um e dois meses de armazenamento não foram detetados danos, sinais de infestação ou de podridão em nenhum tratamento. Os resultados da inspeção interna observados nas castanhas dos diferentes tratamentos estão apresentados no Quadro 6. No momento da colheita o nível máximo de infeção fúngica encontrado foi o L2 e as percentagens de infeção variaram entre os 0 - 2%. Após um mês de armazenamento, e para o nível de infeção L1, as percentagens de infeção variaram entre os 0 - 40%. Após dois meses de refrigeração, o nível máximo foi atingido nas castanhas de todos os tratamentos (L4), com percentagens entre os 10 - 40%. As amostras do tratamento com tebuconazol foram as que apresentaram menores níveis de infeção fúngica, quer no momento da colheita, quer após um mês de armazenamento não apresentando sinais visuais de infeção fúngica (0%). Só ao fim de dois meses é que apresentaram sinais de infeção, cerca de 20% (L1) e 10% (L4). Estes resultados vão de encontro aos obtidos por Driss (2019), que reportou níveis de infeção de nível L4 em castanhas armazenadas não esterilizadas das variedades ‘Martaínha’ e ‘Longal’.
Quadro 6 Avaliação interna das castanhas nos diferentes tratamentos do ensaio de campo depois de um e dois meses de armazenamento. Níveis de infeção fúngica (L0 (0%), L1 (1-25%), L2 (26-50%), L3 (51-75%) e L4 (76-100%) e tipo de podridão (%) castanha, outras. (n= 10 castanhas/tratamento)
| Infeção fúngica (%) | Tipo de podridões (%) | ||||||
| Armazenamento | Tratamento | L1 | L2 | L3 | L4 | Castanha | Outras |
| Controlo | 40 | 0 | 0 | 0 | 40 | 0 | |
| 1 mês | Tebuconazol | 0 | 0 | 0 | 0 | 0 | 0 |
| B. amyloliquefaciens | 20 | 0 | 0 | 0 | 20 | 0 | |
| Solução nutritiva | 40 | 0 | 0 | 0 | 40 | 0 | |
| 2 meses | Controlo | 10 | 0 | 0 | 40 | 50 | 0 |
| Tebuconazol | 20 | 0 | 0 | 10 | 30 | 10 | |
| B. amyloliquefaciens | 0 | 50 | 0 | 30 | 80 | 0 | |
| Solução nutritiva | 0 | 20 | 0 | 40 | 50 | 10 | |
Avaliação microbiológica
Na avaliação microbiológica das castanhas saudáveis, i.e., sem sinais visuais de infeção fúngica (Figura 2), G. smithogilvyi foi detetado nas castanhas do controlo (10%) e no tratamento com a solução nutritiva (40%). Curiosamente, para as restantes podridões, estas foram expressivas em ambos os controlos (30%). No tratamento com tebuconazol 20% das castanhas apresentavam podridões, estando, no entanto ausente a podridão castanha.
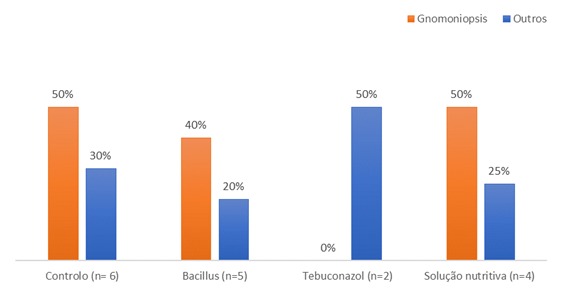



Figura 2 Percentagem de castanhas contaminadas com fungos: a) sem infeção visível (n=10 castanhas/tratamento) e b) com infeção visível (n= todas as castanhas com podridão visível).
Das castanhas com sinais visíveis de podridão (Figura 2b) e pertencentes aos grupos controlo, solução nutritiva e B. amyloliquefaciens, entre 40 a 50 % estavam contaminadas com G. smithogilvyi.
No geral e em relação à avaliação microbiológica, o tratamento com tebuconazol foi mais eficaz no combate contra G. smithogilvyi, pois não foi detetada nenhuma castanha contaminada com este fungo. Num estudo onde discos de batata-doce foram infetados com Ceratocystis fimbriata, o agente da podridão negra na batata-doce, seguindo-se a aplicação da mistura tebuconazol + trifloxistrobina, houve a inibição do crescimento de micélio de C. fimbriata (Mohsin et al., 2021). Num estudo recentemente publicado foi avaliada a atividade in vitro e in situ de vários fungicidas contra G. smithogilvyi. Os fungicidas mais eficazes in vitro foram os que tinham como princípios ativos o difenoconazol ou a piraclostrobina. Nos ensaios de campo, a combinação destas duas substâncias mostrou ter grande eficácia, diminuindo os níveis de infeção nas castanhas (Silva-Campos et al., 2022). As duas substâncias pertencem a grupos químicos distintos: a piraclostrobina é um metoxi-carbamato, enquanto o difenoconazol é um triazol, tal como o tebuconazol, testado no presente trabalho. O tebuconazol é um fungicida usado para controlar podridões em culturas de hortícolas, forrageiras, oleaginosas, frutícolas, flores e plantas ornamentais (EPA, 2012). Entre as frutícolas, é usado na líchia, prunóideas, nogueira-pecã, entre outras. Porém, na Europa, não está homologado para o castanheiro.
A Figura 3 apresenta os valores médios percentuais dos resultados microbiológicos obtidos desde a apanha da castanha até dois meses de armazenamento a temperatura de refrigeração (4 ºC).
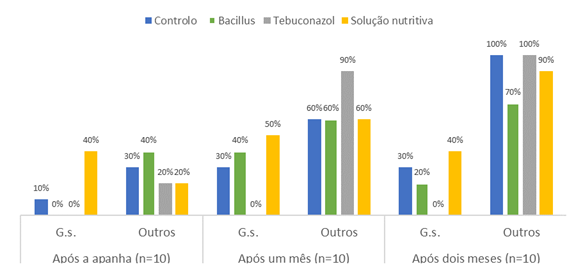

Figura 3 Distribuição dos valores percentuais microbiológicos obtidos ao longo do armazenamento das castanhas dos respetivos tratamentos. G.s. - G. smithogilvyi; Outros - outros bolores.
Perante os resultados obtidos nas análises microbiológicas para a pesquisa de G. smithogilvyi ao longo do armazenamento (Figura 3), conclui-se mais uma vez que o tratamento tebuconazol foi o mais eficaz contra G. smithogilvyi ao longo de 2 meses de armazenamento a 4 ºC. Em contrapartida verificou-se um aumento gradual das outras podridões fúngicas nas castanhas de todos os tratamentos, incluindo nas do tebuconazol. Também Washington et al. (1997) verificaram que a incidência da colonização fúngica em castanhas saudáveis armazenadas a 0 ºC variava bastante ao longo de 152 dias, mostrando que as castanhas colonizadas no momento da colheita, em especial com fungos endófitos, têm o potencial de causar podridões. Mais recentemente Driss (2019) concluiu que a proliferação de fungos aumenta com o período de armazenamento das castanhas. Estes resultados reforçam a necessidade de controlar a carga fúngica das castanhas no campo, de modo a diminuir a podridão destes frutos na pós-colheita. O tratamento com tebuconazol mostrou ser capaz de inibir a carga microbiana no momento da colheita e a podridão castanha, i.e. por G. smithogilvyi, ao longo do armazenamento (2 meses). Apesar do resultado promissor, o tebuconazol só poderá ser usado até 31 de agosto de 2023, por determinação da Comissão europeia (EU, 2022b). É pois importante encontrar alternativas eficazes. O tratamento com B. amyloliquefaciens poderia ser uma alternativa ao tratamento com tebuconazol. No presente trabalho, a aplicação de B. amyloliquefaciens mostrou ser menos eficaz contra G. smithogilvyi, apesar de alguma eficácia na redução das restantes podridões, quer na colheita quer na pós-colheita - máximo de 70% de contaminação após 2 meses de armazenamento, contra 90% no tebuconazol.
CONCLUSÕES
Os dados obtidos neste estudo atentam para a atual problemática do setor da castanha, relacionada com a podridão castanha causada por G. smithogilvyi, o principal agente desta podridão, sendo o seu controlo importante para garantir a sustentabilidade do mercado Europeu. O controlo deste agente na pré-colheita reduziria os níveis de infeção nas castanhas, e o seu impacto económico. Nos vários tratamentos propostos, no tratamento com a solução nutritiva as castanhas apresentaram parâmetros biométricos mais favoráveis quando comparadas com as dos outros tratamentos. Já as castanhas tratadas com tebuconazol apresentaram algum atraso na maturação e mais danos externos ao nível da casca, embora não sejam significativos. Na qualidade interna, as castanhas tratadas com a solução nutritiva apresentaram níveis de infeção fúngica mais elevados, comparativamente aos restantes tratamentos. Pelo contrário, os tratamentos com tebuconazol e com B. amyloliquefaciens foram mais eficazes, respetivamente, contra a podridão castanha e as outras podridões. Assim, o fungicida tebuconazol foi o mais eficaz no controlo pré-colheita e pós-colheita (até 2 meses) de G. smithogilvyi. Como este composto será banido a partir de setembro de 2023, é urgente encontrar tratamentos alternativos. Os agentes de controlo biológico como B. amyloliquefaciens poderão ser um substituto contra algumas podridões, sendo necessário mais investigação na sua capacidade em controlar G. smithogilvyi.