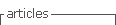INTRODUÇÃO
Os sistemas agroflorestais surgiram em diversos contextos socioculturais, sendo que atualmente sua instalação tem a finalidade de tratamento da cobertura manejada para alcançar o enriquecimento em áreas de pousio, reabilitação de áreas de floresta ripárias, cobertura florestal secundária e recuperação de florestas (Blinn et al., 2013; do Couto et al., 2016). Trata-se de uma alternativa difundida economicamente, para o suprimento de demandas humanas por recursos naturais, além de favorecer à biodiversidade em ambientes recuperados. Essas áreas, quando conectadas com florestas tropicais nativas, oferecem abrigo e recursos para algumas espécies da fauna (Oliveira et al., 2019). Assim, agroflorestas desempenham um papel de substituição ou auxílio na conservação da floresta natural ou até mesmo ajudam a restaurar as funções florestais, perdidas anteriormente (Schroth et al., 2003).
Ambientes agroflorestais são utilizados com frequência por espécies frugívoras de médio e grande porte como corredores ecológicos, esse designer da paisagem facilita a movimentação da fauna e, consequentemente, possibilita a dispersão de sementes de espécies zoocóricas (Trolliet et al., 2017). Assim, a fauna de mamíferos terrícolas, como Tapirus terrestris (anta), arborícolas, como Ateles spp. (macacos-aranha), ou voadores, como os morcegos, contribuem com serviços ecossistêmicos por meio de manutenção e recomposição florística de áreas reflorestadas, bem como de agroflorestas. Essa fauna, dispersa sementes dos frutos consumidos e sementes nos bolos fecais (Parrotta e Knowles, 2001). Desse modo, as agroflorestas tornam-se corredores de dispersão e podem ser consideradas aliadas na recuperação de ambientes degradados, uma vez que a fragmentação florestal afeta a dispersão de sementes, principalmente das espécies zoocóricas que dependem da fauna local para a sua dispersão (Rooduijn et al., 2018).
A zoocoria é um dos principais meios de dispersão de sementes em florestas tropicais, ocorrem em 70-100% das plantas lenhosas e pode ser comum também nas florestas temperadas, vegetações mediterrâneas ou florestas temperadas do hemisfério sul (Hambuckers et al., 2017). Espécies zoocóricas tendem a predominar em ambientes úmidos, pois a maior disponibilidade de água fornece melhores condições para o investimento em frutos carnosos e em associação com a fauna frugívora proporcionam a dispersão mais eficiente (Santana et al., 2018). A relação planta-frugívoro tem um papel fundamental na estrutura da floresta e podem representar um dos principais mecanismos que influenciam a distribuição espacial das plantas (Trolliet et al., 2017).
Em florestas clímax e em estágio avançado de regeneração há predominância da dispersão por zoocoria, já em florestas iniciais a uma predominância de espécies anemocóricas e autocóricas (Vicente-Silva et al., 2016). Florestas secundárias e ambientes degradados, distante de outros fragmentos florestais, apresentam uma grande dissimilaridade entre as espécies tolerantes a sombra (maioria dispersa por zoocoria) e intolerantes (maioria anemocóricas e autocóricas). Entretanto, florestas secundárias com maior proximidade à floresta primária apresentam composição de espécies zoocóricas mais semelhante a floresta primária adjacente (Pessoa et al., 2017).
As diferentes síndromes e a frequência em que os diásporos alcançam ambientes favoráveis para o seu estabelecimento, determinam a distribuição espacial e a riqueza das populações vegetais (Talora e Morellato, 2000; Stefanello et al., 2009). O estabelecimento de plantas nativas em ambientes de plantios de espécies arbóreas como as agroflorestas, podem ocorrer independentemente da idade do plantio e da área basal, ambos dependem da disponibilidade da fonte de sementes, já a sobrevivência e o crescimento, dependem da idade do plantio e das condições favoráveis (Trolliet et al., 2017; Ritter et al., 2018).
Os processos que ocorrem no recrutamento de espécies da comunidade arbórea em florestas plantadas e agroflorestas, ainda são incipientes, fazendo-se necessário o desenvolvimento de pesquisas que respondam quais mudanças físicas ocorrem, em relação a uma floresta nativa, especialmente quando ambientes distintos são próximos espacialmente. Assim, uma maneira de avaliar essas mudanças são através de pesquisas sobre a estrutura e síndromes de dispersão em ambos os ambientes. Desse modo, objetivamos com a presente pesquisa, determinar as relações estruturais da vegetação arbórea de uma floresta nativa em contato com uma agrofloresta, onde consideramos a síndrome de dispersão fator explicativo para a relação entre os ambientes.
MATERIAL E MÉTODOS
Área de Estudo
Realizamos a pesquisa na Fazenda São Nicolau, Cotriguaçu, Mato Grosso, Brasil (09º51’17.8” S e 58º14’53.7” W). A propriedade tem extensão de 10.000 hectares, sendo 7.000 hectares de floresta nativa, 1.700 hectares de agrofloresta implantada em forma de talhões, e 1.300 hectares de Área de Preservação Permanente (APP). O sistema de agrofloresta foi implementado com o objetivo principal de reflorestamento e recuperação de áreas degradadas, anteriormente exploradas como pastagens. As mudas nativas plantadas foram provenientes de sementes coletadas na área de floresta da Fazenda São Nicolau. Entre as 50 espécies plantadas, apenas 10 se adaptaram e se desenvolveram: Ficus maxima, Astronium sp., Ceiba speciosa, Handroanthus sp., Simarouba amara, Spondias mombin, Schizolobium amazonicum, Cordia alliodora, Jacaranda copaia e Amburana acreana. Além da teca (Tectona grandis), espécie exótica cultivada no plantio, e que apresentou bom desenvolvimento, correspondendo a menos de 20% do total de árvores existentes na agrofloresta (Rodrigues et al., 2011).
Coleta de dados
Coletamos os dados pelo método de parcelas quadrangulares (10 × 10m) tomando como referência trilhas de monitoramento de mastofauna. Na ocasião, montamos 33 parcelas em área de floresta nativa e 24 na agrofloresta (Figura 1). Em cada parcela amostramos os indivíduos com circunferência à altura do peito (CAP) maior de 15 cm. Também mensuramos a abertura do dossel com ajuda do equipamento esferodensiometro em cada uma das parcelas, além disso, identificamos os indivíduos arbóreos, por meio de coleta e herborização, diretamente no campo, e avaliação de especialistas segundo o Angiosperm Phylogenetic Group IV (APG et al., 2016). Identificamos os indivíduos classificados em função da síndrome de dispersão como: Anemocóricos, Autocóricos e Zoocóricos, para isso, seguimos a nomenclatura da Lista de Espécies da Flora do Brasil (Flora do Brasil, 2020).
Análise de dados
Realizamos o teste de Kolmogorov - Smirnov para verificar a normalidade dos dados. Calculamos os parâmetros fitossociológicos (frequência relativa, densidade relativa, dominância relativa e índice de valor de importância) para a caracterização da vegetação arbórea. Utilizamos a ordenação multivariada Análise de Componentes Principais (PCoA), para determinar a similaridade florística entre floresta nativa e agrofloresta, com base na similaridade de Bray-Curtis, e dados de abundância por espécie em relação às parcelas por ambiente.
A partir da relação entre espécies por unidade amostral, elaboramos uma curva de rarefação para determinar o esforço amostral. Calculamos a diferença da abertura de dossel entre os ambientes por meio de um Teste t. Para determinar a influência da abertura do dossel na estrutura da vegetação (riqueza, abundância e área basal) em ambos os ambientes, utilizamos um Modelo Linear Generalizado (GLM) com distribuição de Poisson. E por fim, analisamos as características estruturais (abundância e área basal) por síndromes de dispersão por meio de uma ANOVA de dois fatores (Síndrome × Ambiente). Todas as análises foram realizadas no ambiente R versão 3.6.0 (The R Foundation for Statistical Computing Platform, 2019).
RESULTADOS
Caracterização da vegetação
Registramos o total de 395 indivíduos arbóreos pertencentes a 98 espécies e 35 famílias, incluindo a família Lamiaceae da espécie exótica Tectona grandis. A floresta nativa apresentou 87 espécies (280 indivíduos) e a agrofloresta apresentou um incremento de 34 espécies nativas além das 10 espécies plantadas durante a formação da agrofloresta, totalizando 44 espécies (115 indivíduos). Além disso, 25 indivíduos não foram identificados, sendo 21 na floresta nativa e quatro na agrofloresta. As famílias mais representativas foram Fabaceae (41 ind.; 13 spp.), Arecaceae (36 ind.; 8 spp.), Moraceae (30 ind.; 8 spp.), Burseraceae (57 ind.; 7 spp.), Bignoniaceae (20 ind.; 5 spp.) e Lauraceae (11 ind.; 5 spp.). Na floresta nativa as espécies mais representativas foram Protium heptaphyllum (6%), Protium unifoliolatum (4%), Protium pilosissimum (3%) e Protium spruceanum (3%). Já na agrofloresta destacaram-se, Tectona grandis (12%), Vismia guianensis (6%), Attalea phalerata (4%) e Cecropia distachya (4%).
As curvas de rarefação de espécies indicam que o esforço amostral foi satisfatório para a agrofloresta, assim como para a floresta nativa, ainda que a inflexão da curva seja menos evidente neste segundo caso (Figura 2). As curvas demonstram menor riqueza de plantas lenhosas na agrofloresta em comparação a floreta nativa.
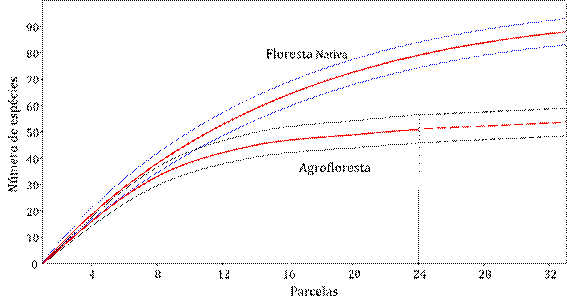
Figura 2 Curva de rarefação do esforço amostral na floresta nativa e na agrofloresta, na Amazônia Meridional (Linhas tracejadas significa estimativa).
Em relação à similaridade da agrofloresta em contato com a floresta nativa, a PCoA mostrou claramente alguns pontos com similaridade entre os ambientes, também destacamos algumas parcelas distintas quanto a ocorrência de espécies em ambos os ambientes com maior variação na composição de espécies na floresta nativa. Os dois primeiros eixos da ordenação multivariada explicaram 37% da variação dos dados. Na ordenação, observamos claramente essa transição entre os ambientes (Figura 3).
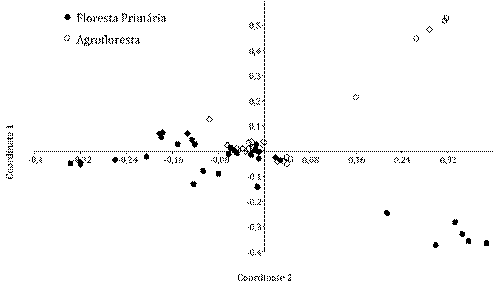
Figura 3 Abundância das espécies registradas na floresta nativa e agrofloresta, representada pela análise de coordenadas principais (PCoA), baseado na similaridade de Bray-Curtis.
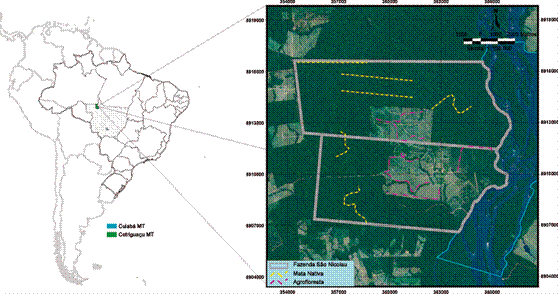
Nossos resultados apontam que, quanto maior a abertura do dossel, menor era a riqueza de espécies na parcela em ambos ambientes (GLM, Z=3,052; P<0,01). Em relação a abundância, o padrão foi o mesmo, diminui com o aumento da abertura do dossel (GLM, Z=3,614; P<0,001). A área basal das parcelas também foi influenciada negativamente com a abertura do dossel nos dois ambientes (GLM, Z=3,614; P<0,001), porém, esse padrão foi mais evidente na floresta nativa (Figura 4). Além disso, a média de abertura de dossel foi significativamente maior na agrofloresta do que na floresta nativa (Teste t, P<0,001).
Síndromes de dispersão
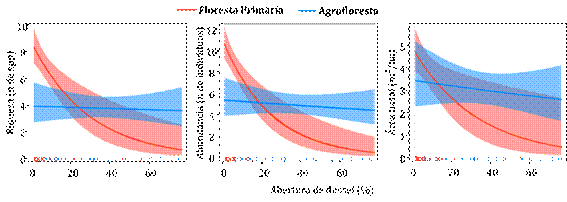
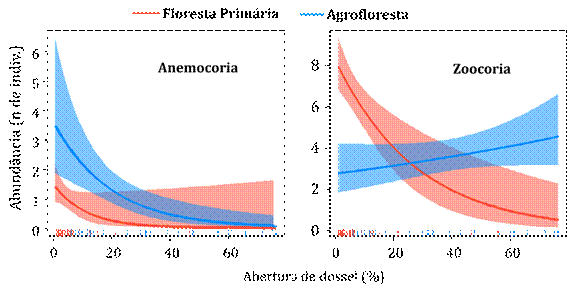
Consideramos a abundância e área basal (P<0,01) e identificamos que a ocorrência de zoocoria em ambos os ambientes é significativamente maior, quando comprada com anemocoria e autocoria. No entanto, não houve diferença significativa entre as características quanto à ocorrência de anemocoria e autocoria, para ambos ambientes. No caso da zoocoria, tanto a abundância como a área basal foram maiores na floresta nativa (P<0,05; Figura 5).
As síndromes de dispersão também se relacionaram com a abertura de dossel (Figura 6). Independente do ambiente, a riqueza de espécies anemocóricas diminuiu com o aumento da abertura do dossel (GLM, Z=-1,776; P<0,05). As espécies zoocoricas também apresentaram esse padrão, porém somente na floresta nativa, pois a agrofloresta teve influência positiva (GLM, Z=-4,395; P<0,001).
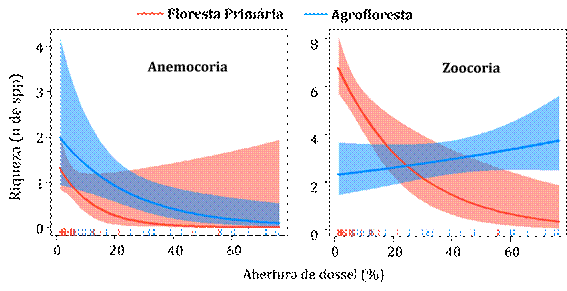
Figura 6 Modelo Linear Generalizado das síndromes de dispersão, mostrando a relação entre abertura do dossel e riqueza na floresta nativa e na agrofloresta, na Amazônia Meridional.
A riqueza e a abundância das síndromes de dispersão também foram influenciadas pela abertura do dossel (Figura 7). A presença de indivíduos anemocóricos teve maior representatividade na agrofloresta, de acordo com o aumento abertura de dossel (GLM, Z=2,048; P<0.05). Por outro lado, indivíduos zoocóricos tenderam a aumentar, quanto maior fosse a abertura do dossel na agrofloresta (GLM, Z=3,748; P<0,001). Em ambos ambientes, identificamos que a área basal é independente da abertura de dossel, assim como das síndromes de dispersão.
DISCUSSÃO
A diversidade de espécies registradas neste estudo assemelha-se à diversos outros realizados no norte do estado de Mato Grosso (Araujo et al., 2009; Mews et al., 2012; Maracahipes Santos et al., 2015). Assim, o alto número de espécies registradas na floresta nativa já era esperado devido composição florística Amazônica contribuir para a elevada riqueza (Maracahipes Santos et al., 2015; ter Steege et al., 2019), além disso, a área recebe influência de espécies do Cerrado (Coronado et al., 2015). Similarmente, um estudo realizado na Mata Atlântica verificou a presença de 73,7% de espécies zoocóricas presente na composição arbórea por Pivello et al. (2006). Isso se deve ao fato de haver maior proporção dessas espécies nas florestas tropicais (Howe e Smallwood, 1982; Morellato e Leitão-Filho, 1992). Ademais, diversos estudos apontam a família Fabaceae com maior representativa na região (Almeida et al., 2014; Araujo et al., 2009).
As características estruturais da floresta podem influenciar a colonização/dispersão de espécies, potencializar riqueza, abundância e tamanho de indivíduos arbóreos (Demarchi et al., 2018). O dossel por exemplo, pode influenciar o estabelecimento de espécies pioneiras (dossel aberto) (Pinheiro et al., 2013), ou espécies de estágios sucessionais mais avançados (dossel fechado) (Santos et al., 2014). Neste sentido, locais com maior abertura de dossel no interior de florestas nativas são menos ricos, enquanto ambientes naturalmente empobrecidos de espécies e com dossel aberto, como as agroflorestas, podem facilitar o estabelecimento de espécies pioneiras, devido a maior entrada de luz solar nesse ambiente.
A área de agrofloresta deste estudo, mostra claramente o recrutamento de espécies nativas pioneiras, favorecidas pela dispersão abiótica e biótica de sementes vindas da floresta nativa adjacente. Portanto, os pontos amostrados com maior similaridade entre a agrofloresta e a floresta nativa decorrem da colonização da área plantada de agrofloresta por espécies provenientes da floresta nativa (Stefanello et al., 2009). Os sistemas para recuperação de áreas degradas (Floresta Plantada e Sistema Agroflorestais-SAFs) são compostos por espécies pioneiras que sombreiam o solo nos estágios iniciais de sucessão (Teixeira e Assis, 2009) e, por serem boas colonizadoras, normalmente estão adaptadas a ambientes pouco favoráveis, de modo que áreas abertas estimulam o aumento dessas espécies (Fearnside, 2010; Hutchison et al., 2018). Tais sistemas ajudam a mitigar os efeitos do desmatamento, além de mostrar excelentes resultados na recuperação de áreas degradadas na Amazônia (Sonter et al., 2017). Nosso estudo mostrou algumas dessas características evidenciadas nas síndromes de dispersão.
Florestas conservadas apresentam padrão característico quanto a redução do diâmetro, concomitantemente buscam atingir o dossel para competirem por luz (Lopes et al., 2013; Draper et al., 2019). Por essa razão, as florestas nativas tendem a responder negativamente as mudanças, pois apresentam um estágio sucessional avançado, caracterizado pela presença de indivíduos bons competidores, principalmente por espaço aéreo e luminosidade (Oliveira Filho et al., 2004).
Os resultados apresentados para a riqueza e abundância de espécies com distintas síndromes de dispersão estão de acordo com o esperado, ou seja, em locais com menor abertura do dossel é esperado que haja maior quantidade de espécies anemocóricas, pela forma em que estas colonizam ambientes abertos (Oliveira e Moreira, 1992). Quanto a zoocoria, a menor riqueza e abundância de espécies zoocóricas com o aumento da abertura do dossel, pode indicar estágios de sucessão iniciais com menor participação da fauna silvestres na colonização de clareiras recentemente abertas (Stefanello et al., 2010). Entretanto na agrofloresta, esse fator pode ter relação com a espécies que foram plantadas inicialmente, considerando que, os locais com maior abertura de dossel, ainda não obtiveram uma regeneração satisfatória, a ponto de reduzir a intensidade e luminosa no sub-bosque, situação essa, que pode resultar na presença dominante das espécies plantadas (Daronco et al., 2013). A zoocoria como síndrome de dispersão dominante na área reforça a importância da fauna nos processos de dispersão de sementes e recrutamento de plântulas, uma vez que, a floresta nativa constituí em refúgios para a fauna silvestre (Reznik et al., 2012). Entretanto, devemos considerar, ao menos de forma complementar, o papel do banco de sementes na composição florística atual das áreas de agrofloresta.
As características relatadas neste estudo, são de grande importância na recuperação da diversidade funcional da comunidade arbórea e interações mutualísticas entre planta-frugívoro (Brancalion et al., 2018). Nesse sentido, os ambientes estudados servem como exemplo de sucesso na recuperação da floresta nativa, considerando as limitações de dispersão de sementes de espécies arbóreas em florestas tropicais (Reid et al., 2015) e a importância da conservação da fauna frugívora para a recuperação de florestas degradadas (Muñoz et al., 2016).
CONCLUSÕES
Os padrões estruturais da agrofloresta em contato com a floresta nativa nos mostram a importância da zoocoria como determinante na conexão de ambientes recuperados, pois influenciam fortemente a riqueza e diversificam a composição da comunidade arbórea. Portanto, a importância da síndrome se intensifica em razão das espécies zoocóricas serem independentes à abertura do dossel na agrofloresta. Nesse sentido, a agrofloresta implementada na área de estudo demonstrou ser uma alternativa viável para recuperação de áreas degradadas.