INTRODUÇÃO
O feijão-comum (Phaseolus vulgaris L.) é uma cultura agrícola de elevada importância económica e social no Brasil. Entre os diversos problemas de origem fitossanitários que limitam a produtividade dessa cultura, encontram-se nemátodes fitoparasitas, especialmente Meloidogyne spp. (nemátodes-das-galhas) e Pratylenchus spp. (nemátodes-das-lesões) (Cunha et al., 2015; Dadazio et al., 2016).
Em áreas de cultivo de feijão, as espécies M. incognita e M. javanica são encontradas com maior frequência (Simão et al., 2010). Os nemátodes-das-galhas são responsáveis por danos que podem atingir até 90% na qualidade e na produtividade da cultura, dependendo do nível populacional, da cultivar e das condições ambientais (Simão et al., 2010; Singh e Schwartz, 2011). Atualmente, M. enterolobii tem causado grande preocupação devido à sua elevada agressividade em diversas espécies vegetais (Brito et al., 2007). Este nemátode também consegue quebrar a resistência de plantas portadoras do gene Mi-1 ou N, que conferem resistência a outras espécies de Meloidogyne (Bitencourt e Silva, 2010).
A utilização de cultivares resistentes, é um dos principais métodos para o controlo de nemátodes fitoparasitas (Posse et al., 2010). Sendo assim, fontes de resistência precisam ser identificadas e quantificadas para utilização de novas variedades que possam reduzir o ciclo biológico do nemátode, tentando manter a população abaixo do limiar de dano econômico. A identificação de genótipos de feijoeiro resistentes, tolerantes ou imunes a nemátodes fitoparasitas pode ser explorada em programas de melhoramento de plantas, visando aumentar a tolerância ou a resistência ao ataque desses nemátodes e viabilizar o cultivo desta leguminosa em áreas infestadas (Baida et al., 2011; Bozbuga et al., 2015).
Em diversos relatos, a variação de resistência entre genótipos de feijão aos nemátodes-das-galhas tem sido comprovada, demonstrando que um mesmo genótipo de feijoeiro pode reagir de forma diferenciada a diferentes espécies de Meloidogyne. A reação de resistência dos genótipos FORT-10, FORT-13, FORT-16 e Aporéa M. incognita, bem como a suscetibilidade dos feijoeiros Rico-23, Pérola e ‘FORT-19’ a este nemátode, foram comprovadas em estufa (Santos et al., 2012). Para M. javanica, Singh et al. (2011) não detectaram nenhuma fonte de resistência nas cultivares e genótipos de feijoeiro avaliadas. A divergência de comportamento entre genótipos de feijoeiro aos NGR foi relatada noutro estudo, em que os genótipos HAB 402, HAB 408, HAB 411 e HAB 428 apresentaram resistência simultânea a M. incognita e M. javanica e a genótipos HAB 403 mostrou-se suscetível a ambas (Baida et al., 2011). Bozbuga et al. (2015) ao avaliarem a reação de 87 genótipos de feijoeiro a M. incognita, verificaram que apenas treze eram resistentes.
Diante desse contexto, o objetivo deste trabalho foi avaliar a reação de sete genótipos de feijoeiro a M. incognita, M. javanica e M. enterolobii.
MATERIAL E MÉTODOS
Três ensaios foram conduzidos em estufa. Cada ensaio foi repetido, para confirmação dos dados. Durante a condução dos ensaios, a média das temperaturas na estufa foi de 23,5 ºC e 28,0 ºC, nas repetições 1 e 2, respectivamente.
Em todos os ensaios, o delineamento experimental foi inteiramente casualizado com cinco repetições, sendo avaliado, respectivamente, a reprodução de M. incognita, M. javanica e M. enterolobii em sete genótipos (PR11-6-4-1-2, Pr11-6-4-1-2, C4-8-1-1, C2-1-6-1-1, IAC-Alvorada, IAC-Diplomata e IAC-Una) de feijoeiro.
Populações puras das espécies estudadas foram identificadas pelo padrão perineal das fêmeas e electroforese de isoenzimas (Oliveira et al., 2012) e multiplicadas, separadamente, em plantas de tomateiro, Solanum lycopersicum, cv. Rutgers. As sementeiras foram realizadas diretamente em vasos de polietileno com capacidade de 2000 dm3 contendo uma mistura de solo (franco-argiloso), areia e matéria orgânica (1:2:1), autoclavadas (120°C, 1 atm, durante 2 h). O desbaste manual foi efetuado após a emergência das plântulas, deixando uma por vaso. Cada vaso foi inoculado com 5.000 ovos + J2 de M. incognita, M. javanica ou M enterolobii, obtidos pelo método de Hussey e Barker (1973) modificado por Boneti e Ferraz (1981). Depositou-se a suspensão de ovos + J2 em dois orifícios com 3 cm de profundidade na rizosfera de cada planta. O tomateiro cv. Rutgers foi utilizado como controlo uma vez que é susceptível às espécies estudadas.
Sessenta dias após a inoculação os sistemas radiculares das plantas foram lavados individualmente sob água corrente, pesados após a retirada do excesso de água com papel filtro e submetidos à coloração com Floxina B (Daykin e Hussey, 1985) para facilitar a contagem das massas de ovos. Os índices de galhas (IG) e de massas de ovos (IMO) foram obtidos de acordo com a escala de Taylor e Sasser (1978) e classificados em: 0 (sem galhas ou massas de ovos); 1 (1 a 2 galhas ou massas de ovos); 2 (3 a 10 galhas ou massas de ovos); 3 (11 a 30 galhas ou massas de ovos); 4 (31 a 100 galhas ou massas de ovos) e 5 (mais de 100 galhas ou massas de ovos) por raiz. Em seguida, os sistemas radiculares foram processados (Coolen e D’Herde, 1972) numa solução de hipoclorito de sódio a 0,5%, e trituradas num liquidificador.
O número final de ovos e jovens na suspensão final foi determinado com o auxílio da lâmina de Peters observada ao microscópio de luz. Esse número foi utilizado para se obter o fator de reprodução (população final do nemátode (Pf)/ população inicial (Pi)). Plantas com FR igual ou maior que 1,0 foram consideradas suscetíveis (S) e menores que 1,0, resistentes (R) (Oostenbrink, 1966).
Os resultados da variável FR foram transformados através de 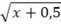 para cumprir os pressupostos da distribuição normal. Os dados foram analisados pelo programa SISVAR (Ferreira, 2011) e as médias comparadas pelo teste de Tukey a 5% de probabilidade de erro.
para cumprir os pressupostos da distribuição normal. Os dados foram analisados pelo programa SISVAR (Ferreira, 2011) e as médias comparadas pelo teste de Tukey a 5% de probabilidade de erro.
RESULTADOS E DISCUSSÃO
Quanto à reação dos genótipos de feijoeiro a M. incognita, M. javanica e M. enterolobii, foi possível observar variações de comportamento entre os genótipos a estas espécies de nemátodes, adotando-se por base o FR (Quadros 1, Quadro 2 e Quadro 3). O tomateiro cv. Rutgers, utilizado como controlo, apresentou FR acima de 16,0, comprovando a viabilidade do inóculo utilizado.
Quadro 1 Índice de galhas (IG), de massa de ovos (IMO), fator de reprodução (FR) de Meloidogyne incognita em sete genótipos de feijoeiro, com determinação da reação dos genótipos.
| Ensaio 1 | Ensaio 2 | ||||||||
| Genótipos | IG¹ | IMO² | FR³ | Reação4 | IG | IMO | FR | Reação | |
| IAC-Diplomata | 2,0 | 1,4 | 2,2 b* | S | 2,0 | 0,6 | 4,0 b | S | |
| IAC-Alvorada | 3,0 | 3,0 | 5,6 a | S | 3,2 | 2,2 | 15,5 a | S | |
| IAC-Una | 2,8 | 2,2 | 5,8 a | S | 1,6 | 1,0 | 3,6 b | S | |
| C2-1-6-1-1 | 2,0 | 1,2 | 1,3 b | S | 2,4 | 1,8 | 3,4 b | S | |
| C4-8-1-1 | 1,6 | 0,4 | 0,6 c | R | 0,6 | 0,0 | 0,7 c | R | |
| PR11-6-4-1-2 | 1,6 | 1,4 | 0,2 c | R | 1,8 | 1,4 | 3,5 b | S | |
| Pr11-6-4-1-2 | 2,0 | 1,6 | 1,3 b | S | 1,6 | 0,8 | 4,0 b | S | |
| Tomateiro ‘Rutgers’ | 4,6 | 4,4 | 19,7 | S | 5,0 | 5,0 | 63,6 | S | |
| CV (%) | 21,9 | 27,2 | |||||||
*Médias seguidas pela mesma letra não diferem entre si pelo teste Tukey a 5% de probabilidade.
¹Índice de galhas baseada em Taylor and Sasser (1978): 0 = sem galhas, 1 = 1 a 2, 2 = 3 a 10, 3 = 11 a 30, 4 = 31 a 100 e 5 = mais de 100 galhas por sistema radicular.
²Índice de massa de ovos baseada em Taylor and Sasser (1978): 0 = sem massa de ovos, 1 = 1 a 2, 2 = 3 a 10, 3 = 11 a 30, 4 = 31 a 100 e 5 = mais de 100 massa de ovos por sistema radicular.
³FR = população final (PF) / população inicial (Pi =5.000);
4Reação: R = Resistente (FR < 1,0); S = Suscetível (FR > 1,0) (Oostenbrink, 1966).
Quadro 2 Índice de galhas (IG), de massa de ovos (IMO), fator de reprodução (FR) de Meloidogyne javanica em sete genótipos de feijoeiro, com determinação da reação dos genótipos
| Ensaio 1 | Ensaio 2 | ||||||||
| Genótipos | IG¹ | IMO² | FR³ | Reação4 | IG | IMO | FR | Reação | |
| C2-1-6-1-1 | 0 | 0 | 0,1 d* | R | 1,4 | 1,2 | 0,7 c | R | |
| C4-8-1-1 | 2,0 | 1,4 | 3,8 b | S | 2,6 | 1,2 | 4,6 b | S | |
| IAC-Alvorada | 2,2 | 1,6 | 2,3 b | S | 2,6 | 0,8 | 6,7 b | S | |
| IAC-Diplomata | 2,0 | 2,0 | 1,2 c | S | 1,6 | 1,2 | 4,0 b | S | |
| IAC-Una | 1,6 | 1,6 | 1,3 c | S | 2,6 | 1,2 | 18,4 a | S | |
| PR11-6-4-1-2 | 3,8 | 3,8 | 4,9 b | S | 1,6 | 1,0 | 1,4 b | S | |
| Pr11-6-4-1-2 | 3,6 | 3,6 | 9,7 a | S | 4,4 | 1,8 | 15,0 a | S | |
| Tomateiro ‘Rutgers’ | 4,4 | 3,4 | 16,1 | S | 5,0 | 5,0 | 92,3 | S | |
| CV (%) | 25,1 | 24,0 | |||||||
*Médias seguidas pela mesma letra não diferem entre si pelo teste Tukey a 5% de probabilidade.
¹Índice de galhas baseada em Taylor and Sasser (1978): 0 = sem galhas, 1 = 1 a 2, 2 = 3 a 10, 3 = 11 a 30, 4 = 31 a 100 e 5 = mais de 100 galhas por sistema radicular.
²Índice de massa de ovos baseada em Taylor and Sasser (1978): 0 = massa de ovos, 1 = 1 a 2, 2 = 3 a 10, 3 = 11 a 30, 4 = 31 a 100 e 5 = mais de 100 massa de ovos por sistema radicular.
³FR = população final (PF) / população inicial (Pi =5.000);
4Reação: R = Resistente (FR < 1,0); S = Suscetível (FR > 1,0) (Oostenbrink, 1966).
Quadro 3 Índice de galhas (IG), de massa de ovos (IMO), fator de reprodução (FR) de Meloidogyne enterolobii em sete genótipos de feijoeiro, com determinação da reação dos genótipos
| Ensaio 1 | Ensaio 2 | ||||||||
| Genótipos | IG¹ | IMO² | FR³ | Reação4 | IG | IMO | FR | Reação | |
| C2-1-6-1-1 | 1,8 | 1,2 | 3,4 a* | S | 3,2 | 3,2 | 6,7 b | S | |
| C4-8-1-1 | 2,4 | 2,2 | 4,9 a | S | 2,6 | 3,6 | 10,7 a | S | |
| IAC-Alvorada | 2,6 | 2,6 | 4,0 a | S | 4,2 | 3,8 | 15,5 a | S | |
| IAC-Diplomata | 3,0 | 2,6 | 1,4 b | S | 2,4 | 2,2 | 2,4 c | S | |
| IAC-Una | 0,8 | 0,8 | 0,6 c | R | 2,4 | 2,8 | 6,9 b | S | |
| PR11-6-4-1-2 | 3,2 | 2,4 | 3,9 a | S | 2,8 | 3,2 | 7,7 b | S | |
| Pr11-6-4-1-2 | 3,2 | 3,2 | 5,6 a | S | 3,8 | 3,2 | 7,9 b | S | |
| Tomateiro ‘Rutgers’ | 4,2 | 4,2 | 16,0 | S | 5,0 | 5,0 | 54,8 | S | |
| CV (%) | 24,1 | 28,4 | |||||||
*Médias seguidas pela mesma letra não diferem entre si pelo teste Tukey a 5% de probabilidade.
¹Índice de galhas baseada em Taylor e Sasser (1978): 0 = sem galhas, 1 = 1 a 2, 2 = 3 a 10, 3 = 11 a 30, 4 = 31 a 100 e 5 = mais de 100 galhas por sistema radicular.
²Índice de massa de ovos baseada em Taylor e Sasser (1978): 0 = sem massa de ovos, 1 = 1 a 2, 2 = 3 a 10, 3 = 11 a 30, 4 = 31 a 100 e 5 = mais de 100 massa de ovos por sistema radicular.
³FR = população final (PF) / população inicial (Pi =5.000);
4Reação: R = Resistente (FR < 1,0); S = Suscetível (FR > 1,0) (Oostenbrink, 1966).
Ao avaliar a reação dos sete genótipos de feijoeiro a M. incognita, verificou-se que os genótipos C2-1-6-1-1, Pr11-6-4-1-2, IAC-Diplomata, IAC-Alvorada e IAC-Una foram suscetíveis a M. incognita no ensaio 1 (Quadro 1). Resultados confirmados no ensaio 2. Estes genótipos permitiram o aumento da população inicial do nemátode, com FR variando entre 1,3 e 5,8, no primeiro ensaio, e 3,6 a 15,5, no segundo. O genótipo IAC-Una (FR= 5,8) no ensaio 1, apresentou o FR mais elevado, seguido pelo IAC-Alvorada (FR= 5,6), não havendo diferença significativa entre si, mas, diferindo estatisticamente dos demais genótipos avaliados. No entanto, no ensaio 2, apenas o feijoeiro IAC-Alvorada (FR= 15,5) diferiu estatisticamente dos outros genótipos testados. O genótipo C4-8-1-1 mostrou-se resistente a M. incognita nos ensaios 1 e 2, com FR de 0,6 e 0,7, respectivamente. O genótipo PR11-6-4-1-2 apresentou divergência de comportamento, mostrando-se resistente a M. incognita no primeiro ensaio e suscetível no segundo. O IG e o IMO variaram de 1,6 a 3,0 e de 0,4 a 3,0 no ensaio 1, enquanto no ensaio 2, a variação foi de 0,6 a 3,2 e de 0 a 2,2, respectivamente.
Os resultados do estudo da reação dos genótipos de feijoeiro a M. javanica (Quadro 2), mostraram que apenas C2-1-6-1-1 foi resistente, com FR de 0,1 e 0,7, nos ensaios 1 e 2, respectivamente. Os demais feijoeiros proporcionaram o aumento da população inicial do M. javanica, com FR variando de 1,2 (IAC-Diplomata) a 18,4 (IAC-Una). Entre os feijoeiros suscetíveis, os FR mais baixos foram encontrados em IAC-Diplomata (FR= 1,2), IAC-Una (FR= 1,3) e IAC-Alvorada (FR= 2,3) diferindo estatisticamente do feijoeiro C2-1-6-1-1 (FR= 0,19). No ensaio 2, IAC-Diplomata (4,0) e IAC-Alvorada (6,7) também se encontram no grupo de genótipos que apresentaram os FR mais baixos, sendo que C4-8-1-1 (4,6) e PR11-6-4-1-2 (1,4) também estão neste grupo. O FR mais elevado no ensaio 1, foi obtido no feijoeiro Pr11-6-4-1-2 (FR= 9,7), que estatisticamente, diferiu dos demais genótipos estudados. Contudo, no ensaio 2 o FR mais elevado foi observado no feijoeiro IAC-Una (FR= 18,4), o qual não diferiu estatisticamente do genótipo Pr11-6-4-1-2. As variáveis IG e IMO, no primeiro ensaio, variaram ambas de 0 a 3,8 e no segundo ensaio variaram de 1,4 a 4,4 e de 0,8 a 1,8.
Quanto à multiplicação de M. enterolobii nos genótipos de feijoeiro (Quadro 3), IAC-Una apresentou comportamento contraditório, sendo resistente no ensaio 1 e suscetível no ensaio 2. Os demais genótipos foram suscetíveis ao M. enterolobii com FR variando de 1,4 (IAC-Diplomata) a 15,5 (IAC-Alvorada), havendo diferença estatística entre si. Os genótipos Pr11-6-4-1-2 (FR= 5,6) e IAC-Alvorada (FR= 15,5) apresentaram os FR mais elevados nos ensaios 1 e 2, respectivamente. O IG e o IMO variaram ambos de 0,8 a 3,2 no ensaio 1, e no segundo ensaio, de 2,4 a 4,2 e de 2,2 a 3,8, respectivamente.
A variação de comportamento dos genótipos de feijoeiro a M. incognita, M. javanica e M. enterolobii, verificada neste estudo, aponta a importância do conhecimento da reação de diferentes genótipos para que sejam indicados com segurança para o uso em campos infestados com estes nemátodes ou para serem utilizadas em programas de melhoramento genético. Juliatii et al. (2010) ao estudarem a reação de 52 genótipos de feijoeiro a M. incognita, M. javanica e M. paranaensis, verificou-se que apenas os acessos IAPAR 57, IAPAR 72 e Bambuí foram simultaneamente resistentes a estes nemátodes. As cultivares ‘Macarrão Atibaia’, ‘Macarrão Preferido’, ‘Macarrão Trepador’, ‘Talismã’ e ‘Ouro negro’ foram resistentes a M. javanica e M. incognita e suscetibilidade a M. enterolobii, enquanto ‘Aporé’ foi resistente as três espécies de Meloidogyne (Ferreira et al., 2010; Melo et al., 2011). Os genótipos de feijão ‘HAB 402’, ‘HAB 408’, ‘HAB 411’ e ‘HAB 428’ apresentaram resistência simultânea a M. incognita e M. javanica, enquanto ‘HAB 403’ mostrou-se suscetível a ambos os nemátodes (Baida et al., 2011). Estudos de reação de feijoeiro a M. incognita e M. javanica, verificaram resistência nos genótipos ‘FORT-10’, ‘FORT-13’, ‘FORT-16’ e ‘Aporé’ e suscetibilidade em ‘Rico-23’, ‘Pérola’ e ‘FORT-19’ (Santos et al., 2012). Ao se avaliar 87 genótipos de feijão frente a multiplicação de M. incognita, constatou-se que apenas as treze cultivares resistentes ao nemátode-das-galhas (Bozbuga et al., 2015). As divergências relatadas na literatura sobre o patossistema feijoeiro- nemátode, demonstram que o conhecimento da reação de novos genótipos aos nemátodes é necessário.
Os genótipos ‘C2-1-6-1-1’, ‘Pr11-6-4-1-2’, ‘IAC-Diplomata’, IAC-Alvorada e IAC-Una foram suscetíveis a M. incognita. Estes resultados mostram que a utilização destes genótipos em áreas infestadas com esta espécie de Meloidogyne pode aumentar as populações do nemátode, inviabilizando áreas de produção agrícola. No entanto, o genótipo C4-8-1-1 foi resistente a M. incognita, com FR > 1,0 nos ensaios 1 e 2. A resistência a M. incognita dos feijoeiros Diamante Negro, Varressai e Goitacazes e de outros nove genótipos foi demonstrada em estufa (Juliatii et al., 2010). A resistência de seis genótipos Hav 06, Hav 11, Hav 28, Hav 50, Hav 69 e Torino em relação a M. javanica e M. paranaenses foi comprovada em estufa (Baida et al., 2011). Embora o IG, determinado pela escala de infecção (1 a 5), ter sido utilizado apenas como um parâmetro auxiliar para indicar a reação dos sintomas nas plantas, foi possível observar que os genótipos testados apresentaram IG relativamente baixos, variando de 0,6 a 3,2, mesmo aqueles favoráveis à multiplicação do nemátode como, por exemplo, IAC-Alvorada que apresentou IG de 3,2 e FR de 15,5. Isto demonstra que parte da população de M. incognita presente no solo penetrou e estabeleceu-se na planta, embora os genótipos não tenham respondido de forma expressiva a este nemátode. Tal fato demostra que o índice de galhas não deve ser utilizado como parâmetro principal na avaliação de resistência desta cultura, podendo ser utilizado apenas como auxiliar na interpretação dos dados finais. O IMO também deve ser utilizado com cuidado, pois, todos os genótipos suscetíveis apresentaram IMO relativamente baixo como foi o caso, principalmente, dos genótipos IAC-Alvorada, Pr11-6-4-1-2 e IAC-Diplomata que apresentaram IMO de 1,0, 0,8, 0,6 e o FR de 15,5, 4,0 e 4,0, respectivamente.
Os dados relativos à multiplicação de M. javanica, apontam que apenas o genótipo C2-1-6-1-1 foi resistente a M. javanica, sendo os demais, favoráveis ao aumento populacional do nemátode. A resistência e suscetibilidade de genótipos de feijoeiro ao parasitismo de M. javanica também foi verificado em outros estudos. Os genótipos Ônix, Jalo precoce, Ouro branco, Emgopa 201 Ouro, Aporé e outras 20 comportaram-se como resistentes, tendo por base o FR do nemátode (Juliatii et al., 2010). Os genótipos IAPAR 81, IAPAR 14, Pérola e outros oito foram suscetíveis a M. javanica em estufa (Simão et al., 2010).
Quanto à multiplicação de M. enterolobii nos genótipos de feijoeiro, foi constatado que IAC-Una apresentou comportamento contraditório, resistente em um dos ensaios e suscetível no outro.
Os valores das variáveis IG, IMO e FR das três espécies de Meloidogyne foram mais baixos nos ensaios 1, em comparação com os ensaios 2, sugerindo que temperaturas mais amenas durante a execução destes (média de 23,5ºC no ensaio 1 e 28ºC no 2), podem ter contribuído para isto, visto que os nemátodes parasitas de plantas têm o seu ciclo biológico alterado em função da temperatura.
Nenhum genótipo de feijoeiro apresentou resistência às três espécies de Meloidogyne estudadas. Isto demonstra a importância do conhecimento das espécies presentes e do nível de infestação da área, visto que genótipos com resistência a uma espécie de Meloidogyne, não apresentam necessariamente, resistência a outras espécies. A ausência de resistência simultânea em feijoeiro também foi verificada nos estudos de Ferreira et al. (2010) e Melo et al. (2011). Tais resultados também apontam que em áreas infestadas com mistura de M. incognita, M. javanica e M. enterolobii, o cultivo sucessivo desses genótipos com culturas hospedeiras, como tomate, pepino e pimentão, aumenta a população de nemátodes no solo, o que pode levar à queda da produção.
Os resultados obtidos, sugerem que os feijoeiros C4-8-1-1 e C2-1-6-1-1 podem ser indicados para o plantio em áreas de cultivo infestadas com M. incognita e M. javanica, respectivamente. Tais genótipos também podem ser utilizados como fontes de resistência para o uso em programas de melhoramento genético.














