Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciência e Técnica Vitivinícola
versão impressa ISSN 0254-0223
Ciência Téc. Vitiv. v.24 n.2 Dois Portos 2009
Avaliação de dois porta-enxertos de videira in vitro introduzidos em meio de cultivo contendo alumínio
Evaluation of two rootstock grapevine in vitro introduced in a culture medium contend aluminum
Stefan Lucius Burkhardt1; Fabíola Villa2; Aparecido Lima da Silva3; Moacir Pasqual4.
1Departamento de Agricultura (DAG), Universidade Federal de Lavras (UFLA), Lavras, MG, Brasil. Caixa Postal 3037, CEP: 37200-000.
E-mail: fvilla2003@libero.it, mpasqual@ufla.br
(Manuscrito recebido em 14.05.09 . Aceite para publicação em 05.11.09)
RESUMO
A toxidez de alumínio é o fator limitante de maior importância para a produtividade das culturas no mundo. Neste sentido, este trabalho busca determinar um método de avaliação do comportamento de 2 porta-enxertos de videira (Paulsen 1103 e Gravesac), em condições estressantes de alumínio in vitro. Após a desinfestação, os explantes foram inoculados em tubos de ensaio contendo 15 mL de meio de cultura DSD1. As culturas in vitro foram transferidas para salas de crescimento e mantidas sob condições de temperatura de 25°C, fotoperíodo de 16 horas e intensidade luminosa de 40-45 μmol.m-2.s-1. Após a autoclavagem do meio de cultivo, as doses de alumínio foram adicionadas ao meio de cultura em câmara de fluxo laminar e os valores de pH corrigidos para 4,0. Foram implantados dois experimentos. No primeiro, os explantes dos dois porta-enxertos foram colocados diretamente no meio de cultura DSD1 líquido com diferentes concentrações de Al, onde ficaram por um período de 60 dias até a avaliação. No segundo experimento, os explantes foram introduzidos em mesmo meio, na ausência de alumínio. O delineamento experimental utilizado foi inteiramente casualizado composto por seis frascos, contendo três plantas cada um, num total de sete tratamentos. Verificaram-se comportamentos distintos entre as variedades, com relação às concentrações de Al. Ocorreu correlação negativa entre atividades de Al+3 e produção de biomassa. A partição de carbono entre as variedades foi alterada pelas diferentes concentrações de alumínio.
Palavras-chave: toxicicidade,Vitis spp., meio DSD1, cultura de tecidos.
SUMMARY
The aluminum toxicity is the limiting factor of larger importance for the productivity of cultures in the world. In this sense, this work search to determine a method of evaluation of the behavior of 2 rootstock grapevine (Paulsen 1103 and Gravesac), in aluminum stressful conditions in vitro. After the disinfestations, the explants were inoculated in tubes containing 15 mL of culture medium DSD1. The cultures in vitro were transferred for growth rooms and maintained under temperature conditions of 25°C, photoperiod of 16 hours and luminous intensity of 40-45 μmol.m-2.s-1. After the sterilization of culture medium, the doses of aluminum were added to the culture medium in camera and the pH values corrected for 4.0. Two experiments were implanted. In the first, the explants of two rootstock were placed directly in the DSD1 liquid with different Al concentrations, where were maintained for 60 days until the evaluation. In the second experiment, the explants were introduced in same culture medium, in the absence of aluminum. The experimental delineate was blocks, with six flasks containing three plants each one, in a total of seven treatments. Different behaviors were verified among the varieties, with relationship to aluminum concentrations. It was a negative correlation between activities of Al+3 and biomass production. The partition of carbon among the varieties was altered by the different aluminum concentrations.
Keywords: toxicity, Vitis spp., culture medium DSD1, tissue culture.
INTRODUÇÃO
O alumínio é o metal mais abundante e o terceiro elemento mais comum na crosta terrestre, compreendendo aproximadamente 7% da sua massa total, e em solos ácidos, sua toxicidez é o fator limitante de maior importância para a produtividade das culturas no mundo (Hartwig et al., 2007). Os sintomas da toxicidez por alumínio em vegetais muitas vezes não são facilmente identificados. O sintoma mais expressivo e típico da toxicidez por alumínio, indicador do estresse, ocorre na raiz que é o principal órgão afetado e tem o seu crescimento inibido (Delhaize e Ryan, 1995).
Na viticultura catarinense verificou-se, a partir de 1985, uma acentuada queda de produtividade dos vinhedos e uma redução da área plantada, o que representava cerca de 30% da área total. Entre várias causas, estavam fatores nutricionais relacionados às características dos solos (Cordeiro, 2006).
A partir de 1998/99, verifica-se uma reversão do quadro pessimista que dominava o setor vitivinícola catarinense, com a expansão da área plantada. Para o plantio e a renovação dos vinhedos catarinenses existe uma grande demanda de mudas, principalmente de qualidade genética e sanitária comprovada (Desplobins e Silva, 2005). Portanto, o emprego de genótipos adaptados às condições de solo ácido conjuntamente com a adição de calcário e adubações racionais, são estratégias de maior potencial para a utilização racional dos solos com elevados teores de alumínio trocável (Kochian et al., 2005).
No entanto, poucos são os trabalhos sobre os efeitos prejudiciais de solos ácidos, com alumínio. Verificase na literatura, a busca de estabelecer metodologias viáveis para analisar o comportamento de portaenxertos de videira em condições de estresse por alumínio a campo (Fráguas, 1999) e em soluções nutritivas (Cançado et al., 2009; Tecchio et al., 2006). Visando elucidar as principais dificuldades da introdução de novos genótipos, principalmente de porta-enxertos, torna-se importante estudar a micropropagação e o desenvolvimento de novas metodologias de avaliação de genótipos em condições de estresse por alumínio. Diversos autores (Silva e Doazan, 1995; Predieri, 2001), indicam técnicas biotecnológicas como métodos alternativos, confiáveis e rápidos para viabilizar a seleção e a multiplicação da videira em larga escala.
Assim, este trabalho buscou determinar um método de avaliação do comportamento de porta-enxertos de videira, Paulsen 1103 e Gravesac, em condições estressantes de alumínio in vitro.
MATERIAL E MÉTODOS
Os porta-enxertos Paulsen 1103 (Vitis rupestris x Vitis berlandieri) e Gravesac [161-49 (Vitis riparia x Vitis berlandieri) x 3309C (Vitis riparia x Vitis rupestris)] foram provenientes da Estação Experimental de Videira (EPAGRI), Videira (SC) e Fazenda Experimental de Caldas (EPAMIG), Caldas (MG), respectivamente, sendo variedades introduzidas no Brasil (Alvarenga et al., 2002).
As plantas matrizes foram mantidas em casa de vegetação, em condições controladas contra patógenos, e submetidas à fertirrigação com solução nutritiva para videira (Pouget, 1984). Para seleção dos explantes, desinfestação, introdução e manutenção in vitro foram utilizadas metodologias de cultura de tecidos para a videira (Galzy, 1985). Após a desinfestação, os explantes foram inoculados em tubos de ensaio contendo 15mL de meio de cultura DSD1 (Silva e Doazan, 1995).
As culturas in vitro foram transferidas para salas de crescimento e mantidas sob temperatura de 25°C, fotoperíodo de 16 horas e intensidade luminosa de 0,040-0,045 mM.m-2.s-1. A sustentação dos explantes no meio líquido foi obtida por intermédio da utilização de segmentos de cortiça previamente preparados e esterilizados.
Os tratamentos com alumínio (Al) foram definidos com base nos seguintes critérios: considerando-se que a concentração final de Al na solução é fortemente dependente do pH, adotou-se o valor 4,0 como padrão. Outro aspecto observado foi a concentração total de alumínio encontrada naturalmente nos solos ácidos (0-0,35mM), podendo em casos especiais, atingir 1mM (Adams e Moore, 1983). Para corrigir as "concentrações" termodinâmicas denominadas de atividades, foi utilizado o programa GEOCHEM-PC v.2.0 (Parker et al., 1987), ficando, então os tratamentos (concentrações de alumínio), conforme mostra o Quadro I .
Os explantes foram introduzidos em meio DSD1 líquido sem a presença de Al. Após 30 dias em crescimento in vitro, as plantas foram selecionadas pelo tamanho (plantas médias) e submetidas aos diferentes tratamentos, onde aguardaram por mais 30 dias até a fase de avaliação.
Os valores de área foliar foram determinados a partir de imagens obtidas por digitalização e analisadas com auxílio do programa IDRISI. Desta forma foram avaliadas variáveis relacionadas ao sistema radicular (número de raízes, peso seco), parte aérea (área foliar, peso seco foliar e peso seco total), e combinações entre elas. Para a avaliação do pH nos diferentes tratamentos, retiraram-se alíquotas de 0,5 mL (em ambiente de câmara de fluxo laminar) de cada frasco referente aos tratamentos, perfazendo uma amostra composta com volume final de 3,0 mL. O pH foi medido em intervalo médio de 5 dias, ao longo de trinta dias.
Para todos os experimentos o delineamento experimental utilizado foi o inteiramente casualisado. Para as avaliações morfológicas dos porta-enxertos foram utilizadas seis repetições de plantas in vitro. Os experimentos com estresse de íon Al+3 foram compostos por seis vidros, contendo três plantas cada um, num total de sete tratamentos (Quadro I).
RESULTADOS E DISCUSSÕES
Quando da introdução das plantas nos tratamentos, elas já apresentavam, tanto a parte aérea quanto o sistema radicular formados, aspecto pelo qual os diferentes tratamentos não poderiam ter influenciado no número de raízes primárias. Quanto ao número de raízes secundárias, a variedade Gravesac se mostrou altamente influenciada pelas diferentes concentrações de alumínio (Figuras 1A e 1B).
Verificou-se que as menores concentrações de alumínio promoveram uma pequena redução do número de raízes secundárias, observado até a concentração de 0,425mM. Em concentrações superiores a 0,425mM de alumínio ocorreu um crescimento no número de raízes secundárias até atingir o máximo próximo da concentração de 1,2mM. Também foi observado o aparecimento de pontuações, com tonalidades marrons e/ou negras, indicando a tentativa de emissão de primórdios radiculares, mas devido o efeito da alta toxicidade no meio não apresentou a capacidade de regenerar novas raízes.
QUADRO I
Concentração total de alumínio (Al), concentração de Al+3 livre e atividade do Al+3 na solução DSD1 a pH = 4,0 (Software GEOCHEM PC versão 2.0).
Aluminum total concentration (Al), Al+3 free-concentration and Al+3 activity in DSD1 solution with pH = 4,0 (Software GEOCHEM-PC
version 2.0).

Verifica-se na literatura que a toxicidez por alumínio provoca o aumento do número de raízes secundárias (Dantas et al., 2001). Provavelmente o efeito fitotóxico do alumínio promova a destruição das células meristemáticas da raiz alterando a produção de hormônios que controlam o crescimento da parte apical (Hartwig et al., 2007), quebrando a dominância da raiz principal e induzindo a ramificação de raízes secundárias.
Na variedade Paulsen 1103 não foram observadas diferenças significativas com relação ao número de raízes secundárias e totais. Este comportamento, diferentemente do verificado para a variedade Gravesac, pode demonstrar que o efeito de toxicidez de alumínio é dependente do genótipo, conforme sugerido por Fráguas (1999). No entanto, Comin et al. (1999) encontraram reduções no número total de raízes para a variedade Paulsen 1103 de 31,9; 66,9; 73,1 e 65,5% em concentrações de Al de 0,2; 0,4; 0,6 e 0,8 mM, respectivamente, trabalhando em solução nutritiva.
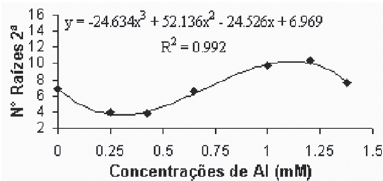
Fig. 1A - Relação de n° de raízes secundárias em função das concentrações de Al (mM) na var. Gravesac in vitro. Relation of secondary roots number in function of Al concentratios (mM) in var. Gravesac in vitro.
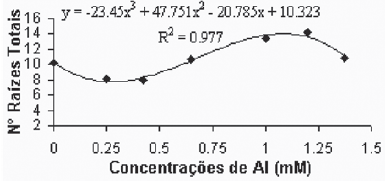
Fig. 1B - Relação de n° de raízes totais em função das concentrações de Al (mM) na var. Gravesac in vitro. Relation of total roots number in function of Al concentrations (mM) in var. Gravesac in vitro.
Porém, existem outros sintomas também relacionados com o sistema radicular, atribuídos ao alumínio, que puderam ser observados no cultivo in vitro. Ocorreu a inibição do alongamento do eixo principal, também verificado por Furlani et al. (2002) e Fráguas (1999), presença de raízes com coloração marrom, principalmente nas extremidades (Figura 4), conforme relatado por Basso et al. (2000) que trabalhou especificamente com porta-enxertos de videira.
Observaram-se também raízes laterais curtas e grossas (Figura 2), além de frágeis e quebradiças, com o início de emissão de raízes próximas ao ponto de crescimento da raiz principal (Figuras 3 e 4), também descrito por Basso et al. (2000). Ocorreu também o aparecimento de um sintoma característico não descrito na literatura: raízes secundárias com tamanho superior a raiz principal, que apresentava crescimento paralisado devido a reações provocadas pelo alumínio (Figura 3).
Quanto ao peso seco radicular, não se verificou relação com as diferentes concentrações de alumínio em ambas as variedades. Resultados estes que estão de acordo com Souza et al. (2000).
A redução de biomassa (peso seco) em plantas submetidas ao estresse de alumínio foi relatada por diversos autores (Burkhardt et al, 2008; Dantas et al., 2001), que verificaram que a ação do alumínio pode inibir o desenvolvimento radicular. Como existe uma correlação estreita entre o desenvolvimento do sistema radicular e a parte aérea das plantas, soluções com teores altos de alumínio promovem a inibição do desenvolvimento da folha/caule (Furlani et al., 2002).

Fig. 2 -Sintomas de toxicidez de alumínio no sistema radicular de porta-enxerto de videira Paulsen 1103 in vitro. Grande número de raízes laterais curtas e grossas (atrofiadas) com coloração escura. Concentração de Al = 0,425mM. UFSC - Fpolis/SC, Brasil.
Aluminum toxicity symptoms in the radicular system of grapevine rootstock Paulsen 1103 in vitro. Great number of short and thick lateral roots (atrophied) with dark coloration. Al concentration = 0,425mM. UFSC - Fpolis/SC, Brasil.
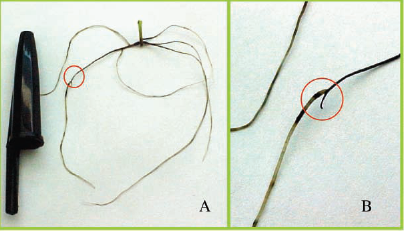
Fig. 3 -Sintomas de morte do meristema apical com emissão de uma nova raiz próxima ao ápice radicular em porta-enxerto de videira Paulsen 1103 in vitro. Evidenciado em (A) a nova raiz que apresenta tamanho semelhante a original. Em (B) mudança típica de coloração da nova raiz. Concentração de Al=0,425mM. UFSC - Fpolis/SC, Brasil.
Symptoms of meristema apical death with emission of a new root next to radicular system in grapevine rootstock Paulsen 1103 in vitro.Evidenced in (A) the new root that presents similar size the original. In (B) typical change of coloration of the new root. Concentration ofAl=0,425mM. UFSC - Fpolis/SC, Brasil.

Fig. 4 -Sintomas causados pela toxicidez por alumínio em porta-enxertos de videira Paulsen 1103 in vitro. (A) paralisação do crescimento apical radicular; as concentrações de alumínio são respectivamente de 0,425 mM, 0,650 mM, e 1,375 mM. (B) raízes anormais e com coloração escura (Al = 1,2 mM). UFSC - Fpolis/SC, Brasil.
Symptoms caused for aluminum toxicity in grapevine rootstock Paulsen 1103 in vitro. (A) Paralisation of the radicular growth apical; the aluminum concentrations are respectively of 0,425 mM, 0,650 mM, and 1,375 mM. (B) abnormal roots and with dark coloration (Al = 1,2 mM). UFSC - Fpolis/SC, Brasil.
Como sintomas visuais da toxicidez por alumínio no caule, a variedade Paulsen 1103 apresentou morte das pontas de crescimento (verificado a partir da segunda semana de tratamento). Este sintoma é normalmente relacionado à deficiência de cálcio provocado pelo alumínio (Foy, 1988). Tais observações estão de acordo com Fráguas (1999), que relatou grandes reduções nos teores de cálcio da variedade Paulsen 1103, submetida ao estresse de alumínio.
Observa-se que a variedade Gravesac (Figura 5A) apresentou uma regressão quadrática, onde aumentos nas concentrações de alumínio até 0,650mM promovem um incremento da área foliar, e concentrações superiores a 0,650mM restringem progressivamente o crescimento das folhas. A variedade Paulsen 1103 (Figura 5B), apresentou redução da área foliar nas concentrações de alumínio a partir de 0,250mM. Em concentrações superiores a esta, o alumínio passa a exercer um efeito fitotóxico reduzindo o crescimento da área foliar até a concentração de 1,0mM, estabilizando em concentrações mais elevadas.
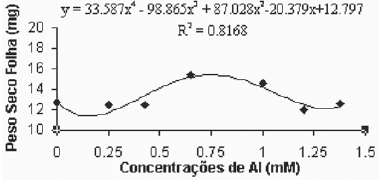
Fig. 5A - Relação da área foliar (cm2), em função das concentrações de Al (mM) para a var. Gravesac in vitro.
Relation of foliar area (cm2), in function of Al concentratios (mM) in var. Gravesac in vitro.
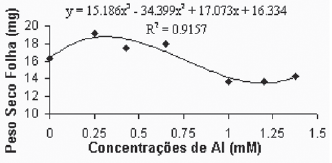
Fig. 5B - Relação da área foliar (cm2), em função das concentrações de Al (mM) para a var. Paulsen 1103 in vitro.
Relation of foliar area (cm2), in function of Al concentratios (mM) in var. Paulsen 1103 in vitro.
De modo geral, foi constatado que as folhas jovens apresentaram redução significativa de crescimento, sintoma relacionado com a deficiência de fósforo (Furlani et al., 2002). Também se verificou o enrolamento das folhas, um sintoma típico de toxicidez por alumínio que normalmente está envolvido com a deficiência de cálcio (Freitas et al., 2006). Para porta-enxertos de videira, a absorção de nutrientes em presença de alumínio apresenta respostas variadas; no entanto, as maiores reduções observadas se referem ao teor de cálcio nas folhas (Tecchio et al., 2005).
Diversos pesquisadores sugerem que as células das raízes e protoplastos respondem, na presença do alumínio, com mudanças fisiológicas necessárias para restabelecer a homeostase interna, mecanismos possíveis apenas em altas concentrações de Ca+2 e K+ (Lindberg e Strid, 1997). E, que o alumínio bloqueia os transportadores de Ca+2 presentes na membrana plasmática, podendo ser uma das principais atividades fitotóxicas exercidas pelo alumínio (Jones et al., 1998).
De maneira geral, as médias do peso seco das folhas para a variedade Gravesac (Figura 6A) não apresentaram correlações negativas com as concentrações de alumínio, demonstrando um certo efeito positivo na produção de biomassa seca nas concentrações de alumínio entre 0.650mM e 1.0mM, com decréscimo em concentrações superiores. Na variedade Paulsen 1103 (Figura 6B), observou-se que em 0,250mM de Al ocorreu um pequeno acréscimo de biomassa nas folhas, porém nas concentrações superiores a esta, verificou-se redução dos pesos secos das folhas até atingir valores mínimos de crescimento foliar nas concentrações superiores a 1,0mM de Al. O alumínio induz reduções na fotossíntese, mecanismo que está em parte associado com o fechamento dos estômatos, fenômeno que provavelmente é resultante de prejuízos causados pelo alumínio, que afetam o metabolismo de carbono e a regulação dos estômatos (Codognotto et al., 2002; Peixoto et al., 2002).
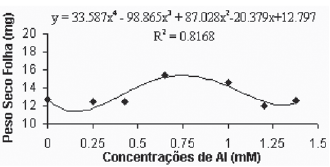
Fig. 6A -Relação do peso seco das folhas (mg) em função das concentrações de Al (mM) na var. Gravesac in vitro.
Relation of dry weight of leves (mg), in function of Al concentratios (mM) in var. Gravesac in vitro.
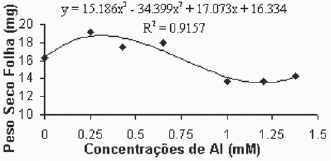
Fig. 6B - Relação do peso seco das folhas (mg) em função das concentrações de Al (mM) na var. Paulsen 1103 in vitro.
Relation of dry weight of leves (mg), in function of Al concentratios (mM) in var. Paulsen 1103 in vitro.
Através dos resultados apresentados nas Figuras 7A e 7B, pode-se observar o comportamento do peso seco da parte aérea em função das diferentes concentrações de alumínio. Para a variedade Gravesac (Figura 7A), observa-se que as baixas concentrações de alumínio não exercem nenhum efeito sobre o peso seco para a parte aérea. A partir da concentração de 0,425mM de alumínio, ocorre um incremento de biomassa aérea até as concentrações próximas de 0,650mM. A partir desta concentração verifica-se uma inibição do crescimento das plantas, de forma que nas concentrações superiores (1,2mM e 1,375mM) de alumínio o crescimento torna-se limitado.
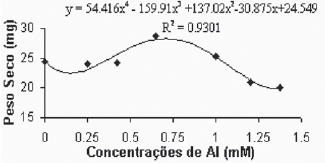
Fig. 7A - Relação do peso seco da parte aérea (caule + folhas), em função das concentrações de Al (mM) na var. Gravesac in vitro.
Relation of aerial part dry weight, in function of Al concentratios (mM) in var. Gravesac in vitro.
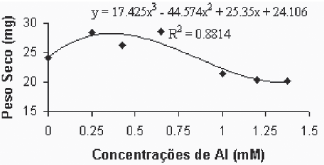
Fig. 7B - Relação do peso seco da parte aérea (caule + folhas), em função das concentrações de Al (mM) na var. Paulsen 1103 in vitro.
Relation of aerial part dry weight, in function of Al concentratios (mM) in var. Paulsen 1103 in vitro.
Para a variedade Paulsen 1103 (Figura 7B), observouse uma maior sensibilidade ao alumínio. Verificouse na concentração 0,250mM de alumínio um estímulo ao acúmulo de biomassa na parte aérea. Entretanto, a partir desta concentração verifica-se uma queda acentuada no peso seco da parte aérea.
Comin et al. (1999), trabalhando com as variedades de videiras Paulsen 1103 e Gravesac, em solução nutritiva, verificaram redução do peso seco da parte aérea, correlacionado com acréscimo nas concentrações de alumínio. Entretanto, Fráguas (1999), em trabalhos de campo, avaliando diferentes variedades de porta-enxertos de videira, verificou que existe variabilidade entre genótipos com relação a estresse de Al. Essas diferenças são devidas aos vários fatores que estão envolvidos, como questões de tolerância de genótipos, metodologias, concentrações e/ou atividades de Al.
Os resultados para peso seco da parte aérea permitiram verificar que as respostas, em função da atividade de Al+3, apresentam diferenças significativas entre as duas variedades. As concentrações de Al superiores se mostraram bem limitantes para o crescimento das plantas da variedade Gravesac, mostrando que nestas concentrações as respostas das plantas em termos de crescimento passam a ser mínimas. A variedade Paulsen 1103, por sua vez, apresentou proximidade nas observações de peso seco aéreo naqueles tratamentos com concentração de Al entre 0,250mM e 0,650mM. A resposta do tratamento com 1,0mM de alumínio está mais próxima das verificadas nas concentrações de 1,20mM e 1,375mM que não apresentaram desenvolvimento das plantas. Supõem-se que o Al no meio cultura induz mecanismos bioquímicos e fisiológicos na planta, que melhoram as condições de crescimento neutralizando a toxicidez por H+ e Al+3.
Como análises finais, buscaram-se comparar a distribuição do carbono (partição de biomassa) entre o sistema radicular e a planta como um todo. Os resultados para a variedade Gravesac estão apresentados nas Figura 8A.
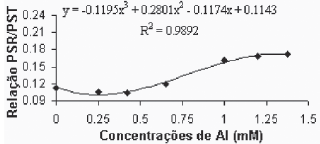
Fig. 8A - Relação peso seco raízes/peso seco total, em função das concentrações de Al (mM) para a var. Gravesac in vitro.
Relation of dry weight roots/total dry weight, in function of Al concentratios (mM) in var. Gravesac in vitro.
Verificou-se que existe uma grande estabilidade entre a relação do peso seco radicular e o peso seco total (PSR/PST), até a concentração de alumínio de 0,650. Para concentrações superiores esta relação se altera, apresentando valores maiores. A variedade Paulsen 1103 (Figura 8B), por sua vez, apesar de não ter apresentado regressão significativa para esta variável, apresentou um padrão de elevação da relação bem definido, com acréscimos praticamente constantes a medida que aumenta a concentração de alumínio. Elevação esta que se faz notar desde a primeira concentração de Al utilizada.
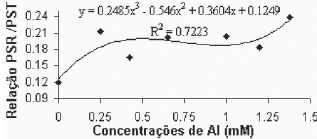
Fig. 8B - Relação peso seco raízes/peso seco total, em função das concentrações de Al (mM) para a var. Paulsen 1103 in vitro.
Relation of aerial part dry weight, in function of Al concentratios (mM) in var. Paulsen 1103 in vitro.
Os valores apresentados pelas testemunhas, da relação (PSR/PST), dentro dos tratamentos testados, provavelmente representam o valor mais próximo daqueles verificados em condições de crescimento adequadas. Tomando isto como premissa, os valores da relação (PSR/PST), que se afastam daqueles verificados na testemunha, provavelmente estão relacionados com os efeitos fitotóxicos do Al sobre as plantas. Assim, o Gravesac, que apresentou relação (PSR/PST) constante até a concentração de 0,650mM de Al, parece ter um crescimento adaptado às condições de acidez e toxicidez de Al+3.
O alumínio é um dos principais responsáveis pela baixa performance de plantas economicamente importantes em solos ácidos. Das espécies de alumínio, a forma Al3+ é comprovadamente tóxica e o sintoma inicial, e mais nocivo de sua toxicidade, é a inibição do crescimento da raiz. Espécies de plantas variam extensivamente no grau de tolerância ao Al e as plantas tolerantes apresentam diferentes mecanismos para sobreviverem à presença desse metal. Os mecanismos de tolerância são extremamente complexos e vários estudos vêm sendo realizados na tentativa de elucidá-los (Echart e Cavalli-Molina, 2001).
Devido à complexidade da fitotoxicidade do Al e dos mecanismos de tolerância apresentados pelas plantas, bem como da interação com diferentes fatores do solo, esse problema, além de ser um desafio para a biotecnologia vegetal, tem que ser alvo de cooperação entre cientistas multi-disciplinares. A elucidação dos vários aspectos envolvidos na fitotoxicidade do Al e obtenção de cultivares tolerantes ao mesmo permitirão futuramente um melhor aproveitamento dos solos ácidos ricos em Al que representam em algumas regiões brasileiras um sério problema brasileiro.
CONCLUSÕES
As avaliações morfo-fisiológicas demonstraram comportamentos distintos entre as variedades, com relação às concentrações de Al.
Ocorreu correlação negativa entre atividades de Al+3 e produção de biomassa.
A partição de carbono entre as variedades foi alterada pelas diversas concentrações de Al.
REFERÊNCIAS BIBLIOGRÁFICAS
Alvarenga A.A., Regina M.A., Fráguas J.C., Chalfun N.N.J., Silva, A.L. 2002. Influência do porta-enxerto sobre o crescimento e produção da cultivar de videira Niágara Rosada (Vitis labrusca L. x Vitis vinifera L.), em condições de solo ácido. Ciência e Agrotecnologia. Edição Especial, 1459-1464.
Adams, F., Moore B.L. 1983. Chemical factors affecting root growth in subsoil horizons of coastal plain soils. Soil Science Society of American Journal, 47, 1, 99-102.
Basso, S.M.S., Agnol M.D., Caetano, J.H.S., Jacques, A.V.A. 2000. Crescimento de plântulas de Adesmia ssp. submetidas a doses de alumínio em solução nutritiva. Ciência Rural, 30, 2, 217-222.
Burkhardt, S.L., Villa, F., Silva, A.L., Comin, J.J., Pasqual, M.. 2008. Avaliação de porta-enxertos de videira in vitro em condições de estresse por alumínio. Ciência e Técnica Vitivinícola, 23, 1, 21-27.
[ Links ]Cançado, G.M.A., Ribeiro, A.P., Piñeros, M.A., Myiata, L.Y., Alvarenga, A.A., Villa, F., Pasqual, M., Purgato, E. 2009. Evaluation of aluminum tolerance in grapevine rootstocks. Vitis, 48, 4, 167-173.
Codognotto, L.M., Santos, D.M.M., Leite, I.C., Marin, A., Madaleno, L.L., Kobori, N.N., Banzatto, D.A. 2002. Efeito do alumínio nos teores de clorofilas de plântulas de feijão-mungo e labe-labe. Revista Ecossistema, 27, 1-2, 27-30.
Comin, J.J., Franzon, R.C., Burkhardt, S.L.; Silva, A.L. 1999. Toxidez do Al em dois porta-enxertos de videira em solução nutritiva. In: XXIV Reunião de fertilidade do solo e nutrição de plantas. Resumo, p.141.
Cordeiro, W.C. 2006. A vitivinicultura em São Joaquim - SC: uma nova atividade no município. Dissertação de Mestrado em Agrossistemas. Universidade Federal de Santa Catarina (UFSC). 132 p.
Dantas, A.C.M., Fortes, G.R.L., Silva, J.B., Nezi, N.A.; Rodrigues, A.C. 2001. Tolerância ao alumínio em porta-enxertos somaclonais de macieira cultivados em solução nutritiva. Pesquisa Agropecuária Brasileira, 36, 4, 615-623.
Delhaize, E.; Ryan, P. 1995. Update on environmental stress: aluminum toxicity and tolerance in plants. Plant Physiology, 107, 2, 315-321.
Desplobins, G.; Silva, A.L. 2005. Construção de qualidade e de reconhecimento na viticultura tradicional do Vale do Rio do Peixe em Santa Catarina. Cadernos de Ciência & Tecnologia, 22, 2, 399-411.
Echart, C.L.; Cavalli-Molina, S. 2001. Fitotoxicidade do alumínio: efeitos, mecanismo de tolerância e seu controle genético. Ciência Rural, 31, 3, 531-541.
Foy, C.D. 1988. Plant Adaptation to acid, aluminum-toxic soils. Commun. In: Soil Science. Plant Anal., 19, 959-987.
Fráguas, J.C. Tolerância de porta-enxertos de videira ao alumínio do solo. 1999. Pesquisa Agropecuária Brasileira, 34, 7, 11931200.
Freitas, F.A., Kopp, M.M., Sousa, R.O., Zimmer, P.D., Carvalho, F.I.F., Oliveira, A.C.. 2006. Absorção de P, Mg, Ca e K e tolerância de genótipos de arroz submetidos a estresse por alumínio em sistemas hidropônicos. Ciência Rural, 36, 1, 72-79.
Furlani, A.M.C., Furlani, P.R., Tanaka, R.T., Mascarelhas, H.A.A., Delgado, M.D.P. 2002. Variability in soybean germoplasm for phosphorus uptake and use efficiency. Scientia Agricola, Piracicaba, 59, 3, 529-536.
Galzy, R. 1985. Les possibilités de conservation in vitro d'une colletion de clones de vignes. Bull. O.I.V., 650, 375-390.
Hartwig, I., Oliveira, A.C., Carvalho, F.I.F., Bertan, I., Silva, J.A.G., Schmidt, D.A.M., Valério, I.P., Maia, L.C., Fonseca, D.A.R.; Reis,
C.E.S. 2007. Mecanismos associados à tolerância ao alumínio em plantas. Semina: Ciências Agrárias, 28, 2, 219-228.
Jones, D.L., Kochina, J.V., Gilroy, S.. 1998. Aluminum induces a decrease in cytosolic calcium concentration in BY-2 tobacco cell cultures. Plant Physiology, 116, 81-89.
Kochian, L.V., Piñeros, M.A., Hoekenga, O.A. 2005. The Physiology, genetics and molecular biology of plant aluminum resistance and toxicity. Plant and Soil, 274, 175, 1-2.
Lindberg, S.; Strid, H. 1997. Aluminum induces RAPD changes in cytosolic pH and free calcium and potassium concentrations in root protoplasts on wheat (Triticum aestivum). Physiology Plantarum, 99, 405-414.
Parker, D.R., Zelazny, L.W., Kinraide, T.B. 1987. Improvements to the program Geochem. Soil Science of Society American Journal, 51, 488-491.
Peixoto, P.H.P., Matta, F.M., Cambraia, J.. 2002. Responses of the photosynthetic apparatus to aluminum stress in two sorghum cultivars. Journal of Plant Nutrition, 25, 821-832.
Pouget, R. 1984. Action de la concentration de la solution nutritive sur quelques caractéristiques physiologiques et technologiques chez Vitis vinifera L. cv. Cabernet Sauvignon. I - Vigueur, rendement, qualité du moût et du vin. Agronomie, 4, 5, 437-442.
Predieri, S. 2001. Mutation induction and tissue culture in improving fruits. Plant Cell Tiss. Organ and Culture, 64, 2-3, 185-210.
Silva, A.L., Doazan, J.P.. 1995. Une méthode d'irradiation aux rayons gamma appliquée à des porte-greffes de Vigne in vitro. Journal of International Science du Vigne et Vin, 29, 1-9.
Souza, J.R.P., Guimarães, M.F., Müller, M.M.L.; Santos, C.H. Morphological alterations of corn (Zea mays L.) plants in response to aluminum toxicity in the soil. Brasilian Archives of Biology and Technology, 43, 4, 415-420, 2000.
Tecchio, M.A., Pires, E.J.P., Filho, H.G., Brizola, R.M.O., Terra, M.M., Corrêa, J.C.. 2005. Acúmulo de macronutrientes em portaenxertos de videira cultivados em solução nutritiva com a adição de alumínio. Acta Scientiarum. Agronomy, 27, 1, 47-54.
Tecchio, M.A., Pires, E.J.P., Terra, M.M., Filho, H.G., Corrêa, J.C., Vieira, C.R.Y.I. 2006. Tolerância de porta-enxertos de videira cultivados, em solução nutritiva, ao alumínio. Revista Ceres, 53, 306, 243-250.
1Mestre em Biotecnologia, UFSC, Florianópolis, SC.
2Pós-doutoranda em Fitotecnia, EPAMIG/FAPEMIG, Bairro Vargedo, Maria da Fé, MG, CEP: 37517-000, e-mail: fvilla2003@libero.it
3D.Sc., Professor Adjunto, Centro de Ciências Agrárias, UFSC, Florianópolis, SC.
4D.Sc., Professor Adjunto, Departamento de Agricultura, UFLA, Lavras, MG, CEP.: 37200-000; e-mail: mpasqual@ufla.br













