Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.42 no.1 Lisboa mar. 2019
https://doi.org/10.19084/RCA18215
ARTIGO
Morfofisiologia de aceroleira irrigada com águas salinas sob combinações de doses de nitrogênio e potássio
Morphophysiology of West Indian cherry irrigated with salt water under combination of doses of nitrogen and potassium
Cícero F. de Sousa Alvarenga1, Evandro M. da Silva2,*, Reginaldo G. Nobre2, Hans R. Gheyi3, Geovani S. de Lima2 e Luderlândio de A. Silva2
1Empresa de Assistência Técnica e Extensão Rural da Paraíba, Aparecida, Paraíba, Brasil
2Universidade Federal de Campina Grande, Paraíba, Brasil
3Universidade Federal do Recôncavo Baiano, Cruz das Almas, Bahia, Brasil
(*E-mail: evandroagroman@hotmail.com)
RESUMO
Propôs-se com a presente pesquisa avaliar o efeito de diferentes combinações de doses de nitrogênio e potássio sobre o crescimento e a fisiologia da cultura da aceroleira irrigada com águas salinas. O experimento foi realizado em campo, no CCTA/UFCG, em delineamento de blocos ao acaso, e tratamentos dispostos em esquema fatorial 5 x 4, referentes a cinco salinidades da água de irrigação (CEa) de 0,3; 1,3; 2,3; 3,3 e 4,3 dS m-1 e quatro combinações (C) de doses recomendadas de nitrogênio e potássio, sendo C1 = 70%N + 50%K2O; C2 = 100%N + 75%K2O; C3= 130%N + 100%K2O e C4= 160%N + 125%K2O, com três repetições, uma planta por parcela, totalizando 60 parcelas sem bordadura. A combinação das doses de 70%N (35 g de N) + 50% K2O (20 g de K2O por planta) foi mais efetiva no aumento das trocas gasosas, promovendo maior crescimento de plantas. A maioria das variáveis de crescimento e as fisiológicas não foram comprometidas pela irrigação com salinidade da água de até 4,3 dS m-1 e, não houve mitigação do estresse salino pela combinações das doses de adubação nitrogenada e potássica.
Palavras-chave: Malpighia emarginata D.C, estresse salino, adubação.
ABSTRACT
This research aimed to evaluate the effect of different combinations of nitrogen and potassium doses on the growth and physiology of the crop of the West Indian cherry irrigated with saline waters. The experiment was carried out in the field at the CCTA/UFCG, in a randomized block design, with treatments arranged in a 5 x 4 factorial scheme, referring to five irrigation water salinities (ECw) of 0.3, 1.3, 2.3, 3.3 and 4.3 dS m-1 and four combinations (C) of doses of nitrogen (N) and potassium (K2O), with C1 = 70% N + 50% K2O; C2 = 100% N + 75% K2O; C3 = 130% N + 100% K2O and C4 = 160% N + 125% K2O, with three replications, one plant per plot, totaling 60 plots without border. Most of the growth and physiological variables were not compromised by irrigation with water salinity up to 4.3 dS m-1 and, there was no salt stress mitigation by combinations of doses of nitrogen and potassium fertilization. The combination of the doses of 70% N (35 g of N) + 50% K2O (20 g of K2O per plant) was more effective in increasing the gas exchange, promoting greater plant growth.
Keywords: Malpighia emarginata D.C, saline stress, fertilizing.
INTRODUÇÃO
A aceroleira (Malpighia emarginata D. C.) é uma fruteira de clima tropical, nativa das Ilhas do Caribe, América Central e Norte da América do Sul. O cultivo no Brasil foi intensificado entre 1988 e 1992, continuando em ascensão ao longo dos anos, principalmente na região Nordeste em virtude da adaptação da cultura, importância alimentar e do elevado teor de vitamina C, que em algumas variedades pode chegar a 5.000 mg 100g-1 de polpa (Calgaro & Braga, 2012).
Devido às estiagens persistentes e à escassez de água de qualidade para irrigação no semiárido do Nordeste brasileiro, tem-se aumentado a pressão para irrigação das culturas com água salina, sendo boa parte proveniente de açudes de pequeno e médio porte e poços profundos, de CEa variando de 1,97 a 2,98 dS m-1 (Medeiros et al., 2003).
Entretanto, o excesso de sais na água pode comprometer as propriedades físico-químicas do solo, o crescimento, a fisiologia e a produção das culturas, devido diminuir a disponibilidade de água às plantas pelo efeito osmótico da solução do solo, efeito tóxico, provocado, principalmente, pelos íons Na+ e Cl- (Munns, 2005) e ao desequilíbrio nutricional, causado por deficiências de Ca2+, Mg2+, K+ e NO3- induzidas por excesso de Na+ e Cl-, através de competição iônica (Marschner, 2011).
As respostas das plantas ao estresse salino variam amplamente, dependendo do genótipo e do tempo de exposição à salinidade; isto, em consequência da atuação de mecanismos de aclimatação em algumas espécies, como ajustamento osmótico e controle na absorção e translocação de sais (Willadino & Camara, 2010). A toxicidade iônica, evidenciada por alterações nas razões K+/Na+, Ca2+/Na+ e NO3-/Cl- dos tecidos (Apse & Blumwald, 2007) pode ser reduzida pelo aumento de valores destas razões nas folhas, diminuindo o desequilíbrio nutricional nas plantas (Blanco et al., 2008).
Sá (2018) analisando a combinação de doses de nitrogênio e fósforo no cultivo da aceroleira BRS Jaburu, observou que aumentos de 40% de N e P em relação à dose recomendada, mitigam os efeitos negativos da salinidade da água de irrigação até a CEa de 3,0 dS m-1 sobre o crescimento, fisiologia e produção, durante o primeiro ciclo da cultura.
Neste aspecto, infere-se que combinações de doses crescentes de adubação nitrogenada e potássica, sob determinado nível salino podem reduzir a relação Cl-/NO3- e Na+/K+ nas folhas da aceroleira, devido elevar a concentração de N e K, com restabelecimento do equilíbrio nutricional e mitigação dos efeitos tóxicos dos íons Na+ e Cl- nas plantas.
Vale salientar que o nitrogênio e o potássio são os macronutrientes mais requeridos e exportados pelos frutos da aceroleira, devido estarem intimamente relacionados com o crescimento, fisiologia e produção (Lima, 2008; Ferreira, 2014), e que podem viabilizar o manejo da adubação e da irrigação na cultura da aceroleira em áreas cultivadas do Semiárido Brasileiro, que possuem teores elevados de sais na água de irrigação.
Neste sentido, propôs-se com o trabalho avaliar o efeito de diferentes combinações de doses de nitrogênio e potássio sobre o crescimento e a fisiologia da cultura da aceroleira irrigada com águas salinas.
MATERIAIS E MÉTODOS
A pesquisa foi desenvolvido sob condições de campo, entre 19 de abril e 9 de novembro de 2017, em área experimental pertencente ao Centro de Ciências e Tecnologia Agroalimentar (CCTA) da Universidade Federal de Campina Grande (UFCG), Pombal, PB, cujas coordenadas geográficas locais de referência são 6º4816 Sul, 37º4915 Oeste e altitude média de 144 m, sendo o clima da região de estudo classificado como BSh, semiárido quente segundo a classificação de Köppen, adaptada ao Brasil (Coelho e Soncin, 1982).
Os dados de precipitação foram obtidos em pluviômetro convencional instalado no local do experimento e, temperatura e umidade relativa adquiridos na estação meteorológica automatizada de São Gonçalo, Sousa – PB (Figura 1) (INMET, 2018), localizada próxima da área do estudo.
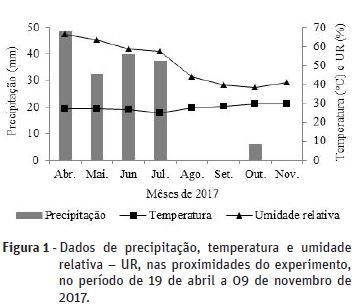
Usou-se delineamento de blocos ao acaso, com os tratamentos dispostos em esquema fatorial 5 x 4, referentes a cinco salinidades da água de irrigação (CEa) de 0,3; 1,3; 2,3; 3,3 e 4,3 dS m-1 em interação com quatro combinações (C) de doses de nitrogênio (N) e potássio (K2O) recomendadas: C1 = 70% N + 50% K2O; C2 = 100% N + 75% K2O; C3= 130% N + 100% K2O e C4= 160% N + 125% K2O, com três repetições e parcela experimental composta de um lisímetro de 60 L, contendo uma planta, totalizando 60 lisímetros no experimento.
Os níveis salinos foram selecionados conforme Sá (2018) onde relata que a cultura da aceroleira BRS 336 Jaburu não é comprometida pela salinidade água de irrigação de até 2,2 dS m-1.
As águas salinas dos tratamentos de 1,3 a 4,3 dS m-1, foram preparadas a partir da adição de NaCl, CaCl2.2H2O e MgCl2.6H2O na proporção equivalente 7:2:1, respectivamente, à água do tratamento de menor salinidade (0,3 dS m-1), proveniente do sistema de reservatório Coremas-Mãe dÁgua que disponibiliza água para irrigação de culturas na região do local do estudo. Esta proporção de sais está predominante nas principais fontes de água utilizadas em irrigação no Nordeste brasileiro, obedecendo-se a relação entre CEa e a concentração dos sais (mmolc L-1 = CE x 10) (Medeiros, 1992).
Utilizou-se a recomendação de adubação de 100 g de N e 80 g de K2O por planta, equivalentes às doses de 100% de nitrogênio e potássio usadas nos tratamentos, determinadas com base na recomendação para cultivo de aceroleira irrigada, na fase vegetativa, sendo a dose de K2O também determinada de acordo com a disponibilidade K no solo após a análise química (Cavalcanti, 2008).
As mudas foram provenientes de viveiro comercial credenciado no Registro Nacional de Sementes e Mudas, localizado no Distrito de São Gonçalo, Sousa – PB, enxertadas pelo tipo fenda cheia, usando porta-enxerto e enxerto das cultivares Junco e Flor Branca, respectivamente, cultivadas em sacolas de polietileno com dimensões 10 x 20 cm e capacidade volumétrica de 0,5 L.
Estas cultivares são adaptadas às condições edafoclimáticas do Semiárido do Nordeste do Brasil, estando entre as principais plantadas em perímetros irrigados do São Francisco, caracterizadas por iniciar a produção aos 5 meses após o transplantio sob irrigação e, apresentar alta produtividade (até 100 kg-planta-1 ano-1); apresentam frutos com película de coloração vermelha, peso entre 3 e 5 g e teor de vitamina C acima de 1.000 mg 100g-1 de polpa (Calgaro & Braga, 2012).
As mudas foram transplantadas quando atingiram 30 a 40 cm de altura, aos 120 dias após a enxertia (DAE), em lisímetros (vasos de polietileno) com capacidade volumétrica de 60 L, espaçados a 1,8 x 2,0 m, entre plantas e linhas de plantio, respectivamente, ocupando uma área de 216 m2. Os lisímetros receberam na base um sistema de drenagem, composto por um dreno com diâmetro de 1/2 (12,7 mm) inserido na extremidade da base, seguido de uma camada de 3,0 cm de brita n° 1 e 2,0 cm de areia lavada. Acima da areia, usou-se 56 L de solo coletado na camada de 0-20 cm no Lote 14, Setor I, do perímetro irrigado das Várzeas de Sousa-PB, cujos atributos físicos e químicos (Quadro 1) foram determinados no Laboratório de Irrigação e Salinidade do CTRN/UFCG.
Utilizou-se 111,11 g de superfosfato simples (18% P2O5) na adubação fosfatada, numa única aplicação, misturando-se o fertilizante ao solo de cada lisímetro. A dose de fósforo aplicada por planta foi de 20 g de P2O5 determinada de acordo com disponibilidade de fósforo no solo, após a análise química, obedecendo a recomendação de adubação para plantio e crescimento da aceroleira irrigada cv. Flor Branca (Cavalcanti, 2008).
Após o transplantio das mudas, foi colocada uma camada de 4,0 cm de cobertura morta, composta de restos de gramíneas, de modo a minimizar as perdas de água por evaporação. Foram utilizadas hastes de madeira que serviram como tutores com 80 cm de altura para sustentação das plantas, de modo a permitir o crescimento ereto e evitar o tombamento.
As plantas foram conduzidas em haste única e sua gema apical foi podada com 50 cm de altura aos 70 dias após o transplantio, sendo, com isto estimulada as brotações das gemas laterais. Dos ramos laterais que surgiram, foram deixados três ramos em diferentes alturas, distribuídos radialmente nos 20 cm terminais da haste principal, denominados de ramos primários. Durante o processo foram eliminados brotações, ramos ladrões e mal localizados, especialmente os que se direcionarem para o solo.
Inicialmente, as plantas foram irrigadas com água de condutividade elétrica de 0,3 dS m-1 até 40 dias após o transplantio (DAT). A aplicação das águas salinas teve início aos 41 DAT, quando as mudas já estavam aclimatadas às condições de campo. A partir deste período, a irrigação foi feita diariamente de forma manual, com a água do respectivo tratamento e baseado no princípio da lisimetria de drenagem, onde o volume a ser aplicado em cada irrigação foi determinado pela diferença entre volume aplicado e drenado no dia seguinte, onde o valor desta diferença foi equivalente ao volume de água retido no solo disponível para planta (Bernardo et al., 2006).
Foi aplicada fração de lixiviação de 15% a cada 15 dias, cujo volume foi determinado com base no volume retido no solo neste período e teve como propósito diminuir o acúmulo de sais na zona radicular das plantas.
A aplicação das doses de N e K teve início aos 20 DAT, feitas simultaneamente em cobertura pelo método convencional, em círculo, a um raio de 20 cm em relação à base da planta. As doses foram parceladas em 24 aplicações em intervalo de 15 dias para fase vegetativa da cultura durante o primeiro ano de cultivo (360 dias). Até o período de avaliação do experimento (200 DAT), foram feitas 12 aplicações em partes iguais das doses de nitrogênio e potássio, totalizando a aplicação de 50 g de N e 40 g de K2O, ambas equivalentes às doses de 100% de nitrogênio e potássio, respectivamente, aplicados nesta época. Utilizou-se ureia (45% de N) e cloreto de potássio (60% K2O) como fonte de N e K, respectivamente (Cavalcanti, 2008).
O crescimento das plantas de aceroleira foi avaliado aos 200 DAT, através do diâmetro do caule abaixo da enxertia (DCab), no ponto da enxertia (DCpo), acima da enxertia (DCac), diâmetro (DRpr) e comprimento de ramo primário (CRpr), número de ramos por planta (NRpl) e número de folhas por planta (NF). O DCab foi medido a 2,0 cm a partir da superfície do solo. O DCpo foi determinado no ponto de ligação entre porta-enxerto/enxerto e o DCac a 4,0 cm acima do ponto da enxertia. O DRpr foi medido a 2,0 cm do ponto de ligação do ramo com o caule da planta. O CRpr foi medido da base do ramo até o ponto de emissão da gema apical. Os valores de DRpr e CRpr foram obtidos pela média de três ramos primários que cada planta possuía. O NRpl foi feito por contagem de ramos na planta, que apresentavam tamanho a partir de 4,0 cm de comprimento, e o NF determinado por contagem, considerando as que estavam com limbo foliar totalmente aberto.
A fisiologia foi avaliada no mesmo período de avaliação do crescimento das plantas, ou seja, aos 200 DAT, mediante as seguintes variáveis de trocas gasosas: concentração intracelular de CO2 (Ci), transpiração (E), condutância estomática (gs) e taxa de assimilação de CO2 (A); e a eficiência fotoquímica através dos parâmetros de fluorescência da clorofila a, incluindo: fluorescência inicial (Fo), fluorescência máxima (Fm), fluorescência variável (Fv), eficiência quântica do fotossistema II (Fv/Fm) e produção quântica do fotossistema II (Fo/Fm). As trocas gasosas e a fluorescência da clorofila a foram analisadas em folha madura na região mediana da copa.
Mediu-se as trocas gasosas, utilizando analisador de gás carbônico a infravermelho portátil (IRGA), modelo LCPro + Portable Photosynthesis System® (ADC BioScientific Limted, UK), operando com temperatura ajustada a 25 °C, irradiação de 1800 μmol fótons m-2 s-1 e fluxo de ar de 200 mL min-1, e concentração de CO2 atmosférico. Determinou-se a eficiência fotoquímica utilizando o equipamento PEA – Hansatech, com a colocação de pinças foliares em folha totalmente expandida, localizada na mesma região onde se realizou a análise das trocas gasosas. As pinças permaneceram por 30 minutos de adaptação ao escuro, e em seguida, foi feita a leitura. A produção quântica basal do fotossistema II (Fo/Fm) foi estabelecido pela razão entre Fo e Fm (Rohácek, 2002).
As médias das variáveis foram submetidas à análise de variância pelo Teste F em nível de 0,05 e 0,01 de probabilidade, sendo os dados dos níveis de salinidade analisados por estudos de regressão, e as médias das combinações das doses de nitrogênio e potássio comparadas pelo teste de Tukey a nível 0,05 de probabilidade, utilizando do software estatístico SISVAR/UFLA para processamento dos dados (Ferreira, 2011).
RESULTADOS E DISCUSSÃO
Constata-se (Quadro 2), que não houve interação significativa (p > 0,05) entre os fatores salinidades da água x combinações das doses NK para as variáveis de crescimento analisadas; e nem efeito significativo isolado da salinidade da água de irrigação para maioria das variáveis, exceto o diâmetro do caule abaixo da enxertia e diâmetros de ramos primários. Para o fator combinação de adubação NK, observa-se que houve efeito significativo isolado (p < 0,05) para diâmetro do caule abaixo, no ponto e acima da enxertia, diâmetro e comprimento médio de ramos primários.
Provavelmente, as precipitações (158,5 mm) que ocorreram até os 90 DAT (Figura 1) contribuíram para lixiviação do excesso de sais, diminuindo o acúmulo no solo e os efeitos negativos sobre o crescimento das plantas no período de 200 DAT. Entretanto, após os 90 DAT, as irrigações com águas salinas podem ter contribuído para incremento da salinidade na solução do solo; apesar de que as plantas de aceroleira não responderam aos efeitos do estresse salinos para maioria das variáveis de crescimento na época de avaliação.
Nesse caso, algum mecanismo de aclimatação à salinidade que ocorre em glicófitas pode ter se manifestado, minimizando os efeitos negativos do estrese salino, tais como: seletividade no processo de absorção pelas células das raízes, carregamento do xilema com K+ em detrimento do Na+ e, minimização da translocação dos íons Na+ e Cl- para a parte aérea em crescimento (Willadino & Camara, 2010).
Na cultura do cajueiro, foi observado que a maior capacidade para aclimatação ao estresse salino do genótipo BRS 226 esteve relacionada à habilidade de exclusão de Na+ e Cl- das folhas e das partes basais, mecanismo associado tanto à seletividade da absorção radicular quanto a restrição da transferência destes íons para a parte aérea (Ferreira-Silva et al., 2009). Todavia, isto precisa ser melhor investigado na cultura da aceroleira; haja vista que estes mecanismos podem variar com o tempo de exposição à salinidade e em diferentes graus, em função da espécie e/ou cultivar (Willadino & Camara, 2010).
O diâmetro de caule abaixo da enxertia e o diâmetro de ramos primários das plantas de aceroleira (Figuras 2A e 2B) foram afetados negativamente pelo aumento da salinidade na água de irrigação, havendo ajustes dos dados à modelos lineares decrescentes, com reduções de 0,5743 (4,46%) e 0,1802 mm (2,66%), respectivamente, por aumento unitário na CEa.
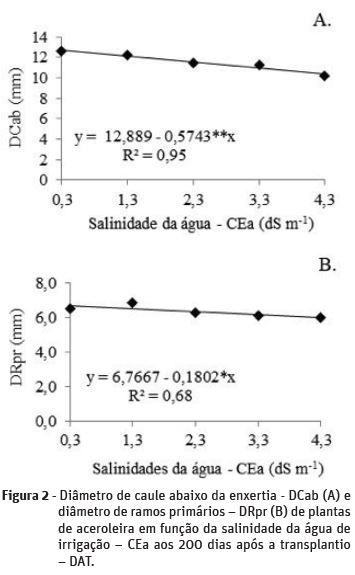
O DCab da enxertia pertence ao mesmo material vegetal das raízes, que estão expostas diretamente à salinidade na solução do solo. Nestas condições, podem prevalecer os efeitos osmóticos dos sais e o acúmulo dos íons tóxicos Na+ e Cl- sobre o caule situado abaixo da enxertia, provocando diminuições de seu crescimento (Munns, 2005; Willadino & Camara, 2010). Supõe que o DRpr (Figura 2B) tenham sido afetado pela salinidade, principalmente, devido o tecido destes ramos serem jovens, formados após a poda da haste principal realizada aos 70 DAT, onde as células do seu meristema secundário, tecido responsável pelo crescimento das plantas em diâmetro tenham se tornado mais suscetível aos efeitos negativo da salinidade (Taiz & Zeiger, 2013).
De maneira geral, o aumento na salinidade da água de irrigação promove o acúmulo de sais no solo, elevando as forças de retenção e diminuição da absorção de água pela planta, assim, inibem a pressão de turgência nas células, afetando os processos de divisão e elongação celular, principalmente nos tecidos meristemáticos, resultando em diminuição do crescimento das plantas (Sousa et al., 2011).
Verifica-se (Figuras 3A; 3B; 3C; 3D e 3E) que o diâmetro de caule abaixo, no ponto e acima da enxertia e, diâmetro e comprimento de ramos primários foram favorecidos, principalmente, pela combinação das doses de 70%N + 50%K2O (C1), onde foram obtidos maiores valores das variáveis correspondentes aos diâmetros de 12,98; 12,22; 10,66 e 7,08 mm, respectivamente, e comprimento de ramos de 90,34 cm.
A combinação das menores doses de nitrogênio e potássio podem ter proporcionado maior equilíbrio nutricional, resultando em melhores condições para atividades fisiológicas e bioquímicas e, consequentemente, o crescimento das plantas (Epstein & Bloom, 2006); haja vista que o N em concentrações adequadas desempenha melhor as suas funções como componente estrutural de aminoácidos, amidas, proteínas, coenzimas precursores de hormônios vegetais, clorofilas, ácidos nucléicos, nucleotídeos, entre outros (Faquin, 2005; Taiz & Zeiger, 2013), enquanto o K atua na regulação osmótica, ativação de enzimas envolvidas na respiração e na fotossíntese, e na neutralização de ânions macromoleculares insolúveis e solúveis no citoplasma e nos cloroplastos (Faquin, 2005; Marschner, 2011; Taiz & Zeiger, 2013).
De maneira geral, vê-se (Figuras 3A; 3B; 3C; 3D e 3E) que o aumento das doses de N e K2O foi prejudicial ao crescimento das plantas, sendo o DCab e DCp muito afetados quando adubados a partir da combinação C2; o DRpr e CRpr a partir da C3 e, o DCac mais comprometido quando receberam as maiores doses de N e K2O (C4). Taiz & Zeiger (2013) reportam que o excesso de nutrientes pode induzir a deficiência ou acúmulo excessivo de outros nutrientes, levando a um distúrbio nutricional que pode afetar o crescimento das plantas.
Alves & Bellingieri (2004) reportam que doses elevadas de nitrogênio, utilizando ureia como fonte de N, diminuem os teores de enxofre e de fósforo nas plantas que são primordiais no crescimento vegetal; outrossim, o aumento das doses de K aplicados na forma de cloreto de potássio, pode promover decréscimo nos teores dos teores de Ca e Mg nas plantas, além de diminuir a concentração de NH4+ nos tecidos vegetais, provavelmente em decorrência do efeito competitivo entre estes elementos (Chen & Mackenzie, 1992).
Além da complexidade da interação entre nutrientes no solo e nas plantas que podem ter ocorrido pelas combinações de doses de N e K, há possibilidade de incremento da salinidade no solo em consequência do aumento da quantidade de fertilizantes nitrogenados e potássicos aplicados, exercendo o efeito osmótico sobre o crescimento das plantas de aceroleira, uma vez que a ureia e cloreto de potássios utilizado como fonte de N e K2O possuem índices salinos elevados, correspondentes a 75 e 115%, respectivamente (Borges & Silva, 2011).
Silva et al. (2015) verificaram que doses elevadas de N diminuíram o diâmetro do caule de mudas de goiabeira Paluma irrigadas com águas salinas, estando o efeito atrelado ao desbalanço nutricional e ao incremento da salinidade na zona das raízes das plantas pelo maior quantidade de ureia utilizada como fonte de N aplicada no solo. Efeito semelhante foi notificado por Bonifácio et al. (2018) com a aplicação de doses elevadas de potássio em porta-enxertos de goiabeira Paluma, utilizando o nitrato de potássio como fonte K.
No Quadro 3, verifica-se que não ocorreu interação significativa entre as salinidades da água de irrigação e combinações das doses de NK, nem efeito significativo das salinidades da água sobre as trocas gasosas nas plantas de aceroleira. Todavia, nota-se que houve efeito significativo das combinações de doses NK sobre todas as variáveis analisadas.
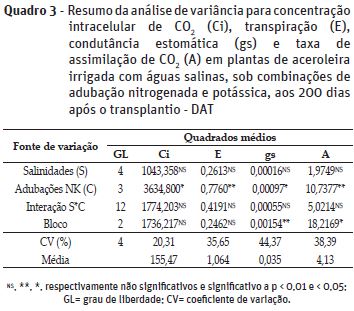
É possível que a capacidade de ajustamento osmótico pelo acúmulo de solutos orgânicos no citoplasma (Sousa et al., 2011) e/ou controle de absorção pelas raízes e translocação dos íons tóxicos Na+ e Cl- para as folhas das plantas de aceroleira (Willadino & Camara, 2010), tenham evitado o efeito negativo da salinidade da água irrigação sobre as trocas gasosas; uma vez que nas espécies incapazes de realizar tais mecanismos, os efeitos da salinidade induzem o fechamento estomático, a transpiração e diminuição da fotossíntese, mediados pelas altas concentrações de íons Na+ e Cl-, principais causadores de limitações estomáticas e bioquímicas (Silva et al., 2011).
Analisando o efeito das combinações de doses de adubação nitrogenada e potássica sobre as trocas gasosas das plantas de aceroleira, verifica-se que estas se apresentaram em consonância com as variáveis de crescimento (Figuras 3A; 3B; 3C, 3D e 3E), cujos maiores valores de condutância estomática (0,047 mol H2O m-2 s-1), transpiração (1,37 mol H2O m-2 s-1) e taxa de assimilação de CO2 (5,23 µmol m-2 s-1) foram obtidos na combinação das menores doses estudadas (C1 = 70%N + 50%K2O) (Figuras 4A, 4B e 4C).
A principal causa dos maiores valores de condutância estomática resultante da combinação C1 pode estar relacionada à disponibilidade adequada de potássio, haja vista que este macronutriente está envolvido na regulação da abertura e fechamento dos estômatos, onde concentrações adequadas de K nas células guardas auxiliam na absorção de água das células adjacentes, com consequente aumento na pressão de turgor, promovendo assim, a abertura dos estômatos (Faquin, 2005).
Possivelmente, a maior taxa de transpiração observada nas plantas adubadas com a combinação C1 (Figura 4B), esteja relacionada à maior abertura dos estômatos mediada pela concentração de potássio nas células guardas; assim como a taxa de assimilação de CO2 (Figura 4C), pois a maior abertura estomática promove maior entrada de CO2 nas células, resultando em maior taxa fotossintética (Taiz & Zeiger, 2013). Para Faquin (2005), o K+ esta também envolvido em uma melhor difusividade do CO2 no mesófilo foliar e no estímulo da atividade da rubisco (RuBP), possivelmente, devido à manutenção de um pH ótimo para a atividade desta enzima que é responsável pela fixação de carbono na fase bioquímica da fotossíntese.
A concentração intracelular de CO2 foi maior (174,73 µmol m-2 s-1) nas plantas adubadas com a combinação das maiores doses de nitrogênio e potássio (C4) (Figura 4D). Aumento do valor de Ci está associado ao acúmulo de CO2 nos espaços intercelulares do mesófilo foliar, devido à baixa utilização deste gás para a síntese de açúcares pelo processo fotossintético, geralmente, desencadeado por algum fator não estomático (Taiz & Zeiger, 2013); como a menor difusividade do CO2 no mesófilo foliar e diminuição da atividade da enzima fixadora de CO2 (RuBP), causada pelo desequilíbrio nutricional, especificamente de K, que está envolvido nestes processos (Faquin, 2005).
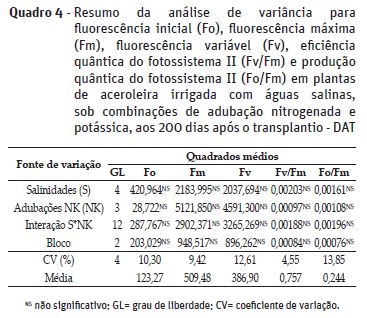
No tocante a eficiência fotoquímica nas plantas de aceroleira, verifica-se (Quadro 4) que não houve interação significativa entre as salinidades da água de irrigação e as combinações de adubação nitrogenada e potássica e, nem efeito significativo isolado destes fatores sobre as variáveis estudadas. Semelhantemente, Sá et al. (2017) verificaram em plantas de aceroleira cultivar BRS 336 Jaburu e porta-enxerto Crioula aos 75 dias após o transplantio, que a irrigação com salinidade da água até 3,8 dS m-1 e diferentes combinações de doses de nitrogênio e fósforo não exerceram efeito significativo a eficiência fotoquímica, incluindo fluorescência máxima (Fm), fluorescência variável (Fv), eficiência quântica do fotossistema II (Fv/Fm).
De maneira geral, pode-se afirmar que a fluorescência da clorofila a é utilizada para aferição da eficiência das reações fotoquímicas da fotossíntese, como a receptação primária de elétrons do fotossistema II após a oxidação da água mediada pela luz; o fluxo desses elétrons entre os fotossistemas I e II na membrana dos tilacoide; dissipação térmica dentro do FSII e a eficiência quântica da transferência de elétrons para formação do redutor NADPH, ATP e Fdr, utilizados na assimilação do CO2 na fase bioquímica da fotossíntese (Rohácek, 2002; Baker, 2008).
Estas variáveis podem ser afetadas pelos íons tóxicos de Na+ e Cl- quando as plantas são expostas à salinidade, conforme verificado em gravioleira (Silva et al., 2017). Toda via, percebe-se (Quadro 3) que na aceroleira esses efeitos não se manifestaram, deduzindo-se que pode haver algum mecanismo de aclimatação desta cultura ao estresse salino.
Quanto às combinações de doses N e K2O, pode-se afirmar que estas variáveis não são comprometidas, indicando que a eficiência fotoquímica não é afetada pelo provável efeito osmótico provocado pelo índice salino dos fertilizantes e desequilíbrio nutricional resultante da combinação de doses elevadas de N e K2O.
CONCLUSÕES
Adubação com combinação das doses de 70%N (35 g de N) + 50%K2O (20 g de K2O) da dose recomendada por planta, foi mais efetiva no aumento das trocas gasosas, promovendo maior crescimento de plantas.
As combinações de adubação nitrogenada e potássica não interagiram com a salinidade da água de irrigação sobre as variáveis de crescimento e a fisiologia de plantas de aceroleira na fase vegetativa, aos 200 dias após o transplantio.
As trocas gasosas, a eficiência fotoquímica e a maioria das variáveis de crescimento com exceção de diâmetro de caule abaixo da enxertia e diâmetro de ramos primários, não foram comprometidas pela irrigação com salinidade da água de até 4,3 dS m-1.
Referências bibliográficas
Alves, L.L. & Bellingieri, P.A. (2004) - Efeito de doses de nitrogênio e potássio no crescimento, na composição química e nos teores de amônio e nitrato da parte aérea de aveia-amarela cultivada em casa de vegetação. Científica, vol. 32, n. 2, p. 107-114. [ Links ]
Apse, M.P. & Blumwald, E. (2007) - Na+ transport in plants. FEBS Letters, vol. 581, n. 12, p. 2247-2254. https://doi.org/10.1016/j.febslet.2007.04.014 [ Links ]
Baker, N.R. (2008) - Chlorophyll fluorescence: A probe of photosynthesis in vivo. Annual Review of Plant Biology, vol. 59, p. 89-113. https://doi.org/10.1146/annurev.arplant.59.032607.092759 [ Links ]
Bernardo, S.; Soares, A.A. & Mantovani, E. C. (2006) - Manual de irrigação. 8 ed., Viçosa: UFV, 625 p. [ Links ]
Blanco, F.F.; Folegatti, M.V. & Henriques Neto, D. (2008) - Doses de N e K no tomateiro sob estresse salino: I. Concentração de nutrientes no solo e na planta. Revista Brasileira de Engenharia Agrícola e Ambiental, vol. 12, n. 1, p. 26–33. http://dx.doi.org/10.1590/S1415-43662008000100004 [ Links ]
Bonifácio, B.F.; Nobre, R.G.; Gheyi, H.R.; Lima, G.S.; Sousa, L.P.; Pinheiro, F.W.A.; Barbosa, J.L. & Silva, E.M. (2018) - Effect of salinity and potassium on phytomass and quality of guava rootstocks. Journal of Agricultural Science, vol. 10, n. 2, p. 308-317. https://doi.org/10.5539/jas.v10n2p308 [ Links ]
Borges, A.L. & Silva, D.J. (2011) - Fertilizantes para fertirrigação. In: Sousa, V.F.; Marouelli, W.A.; Coelho, E.F.; Maurício, J.M.P. & Coelho Filho, A. (Eds.) - Irrigação e fertirrigação em fruteiras e hortaliças. Brasília: Embrapa Informação Tecnológica. p. 253-264. [ Links ]
Calgaro, M. & Braga, M.B. (2012) - A cultura da acerola. 3a ed. Brasília, DF : Embrapa. 144 p. (Coleção Plantar; 69). [ Links ]
Cavalcanti, F.J. (2008) - Recomendações de adubação para o Estado de Pernambuco: 2a aproximação. 3a. ed. Recife: IPA. 212 p. [ Links ]
Chen, J.S. & Mackenzie, A.F. (1992) - Fixed ammonium and potassium as affected by added nitrogen and potassium in three Quebec soils. Communication in Soil Science and Plant Analysis, vol. 23, n. 11-12, p. 1145-1159. https://doi.org/10.1080/00103629209368657 [ Links ]
Coelho, M.A. & Soncin, N.B. (1982) - Geografia do Brasil. São Paulo: Moderna, 368 p. [ Links ]
Epstein, E. & Bloom, A.J. (2006) - Nutrição mineral de plantas: princípios e perspectivas. Londrina: Editora Planta. 403p. [ Links ]
Faquin, V. (2005) - Nutrição mineral de plantas. Lavras: UFLA /FAEPE. 186 p. [ Links ]
Ferreira, D.F. (2011) - Sisvar: um sistema computacional de análise estatística. Ciência e Agrotecnologia, vol. 35, n. 6, p. 1039-1042. http://dx.doi.org/10.1590/S1413-70542011000600001. [ Links ]
Ferreira, K.S. (2014) - Crescimento e acúmulo de nutrientes em mudas de aceroleira adubadas com nitrogênio e potássio. 2014. Dissertação de Mestrado. São João Del-Rei, Universidade Federal de São João Del-Rei. 49 p. [ Links ]
Ferreira-Silva, S.L.; Voigt, E.L.; Viégas, R.A.; Paiva, J.R. & Silveira, J.A.G. (2009). Influência de porta-enxertos na resistência de mudas de cajueiro ao estresse salino. Pesquisa Agropecuária Brasileira, vol. 44, n. 4, p. 361-367. http://dx.doi.org/10.1590/S0100-204X2009000400005 [ Links ]
INMET (2018) - Estações e dados. Instituto Nacional de Meteorologia. [cit. 2018/03/03]. <http://www.inmet.gov.br/portal/index.php?r=estacoes/estacoesAutomaticas> [ Links ].
Lima, R.L.S. (2008) - Estudos sobre a nutrição de progênies de aceroleira: épocas de amostragens de folhas e exportação de nutrientes. Tese de Doutorado. Jaboticabal, Faculdade de Ciências Agrárias e Veterinárias da Universidade Estadual Paulista, 44 p. [ Links ]
Marschner, H. (2011) - Mineral nutrition of higher plants. 3a ed. New York, Academic Press, 672 p. [ Links ]
Medeiros, J.F. (1992) - Qualidade da água de irrigação e evolução da salinidade nas propriedades assistidas pelo "GAT" nos Estado do RN, PB e CE. Dissertação de Mestrado. Campina Grande, Universidade Federal da Paraíba. 173 p. [ Links ]
Medeiros, J.F.; Lisboa, R.A.; Oliveira, M.; Silva Júnior, M.J.; Alves, L.P. (2003) - Caracterização das águas subterrâneas usadas para irrigação na área produtora de melão da Chapada do Apodi. Revista Brasileira Engenharia Agrícola e Ambiental, vol. 7, n. 3, p. 469-472. http://dx.doi.org/10.1590/S1415-43662003000300010 [ Links ]
Munns, R. (2005) - Genes and salt tolerance: bringing them together. New Phytologist, vol. 167, p. 645–663. https://doi.org/10.1111/j.1469-8137.2005.01487.x [ Links ]
Rohácek, K. (2002) - Chlorophyll fluorescence parameters: the definitions, photosynthetic meaning, and mutual relationships. Photosynthetica, vol. 40, n. 1, p. 13-29. https://doi.org/10.1023/A:1020125719386 [ Links ]
Sá, F.V.S. (2018) - Ecofisiologia da aceroleira irrigada com água salina sob adubação com fósforo e nitrogênio. Tese de Doutorado. Campina Grande, Universidade Federal de Campina Grande, 148 p. [ Links ]
Sá, F.V.S.; Gheyi, H.R.; Lima, G.S.; Paiva, E.P.; Fernandes, P.D.; Moreira, R.C.L.; Silva, L.A. & Ferreira Neto, M. (2017) - Water relations and gas exchanges of West Indian cherry under salt stress and nitrogen and phosphorus doses. Journal of Agricultural Science, vol. 9, n. 10, p. 168-177. https://doi.org/10.5539/jas.v9n10p16. [ Links ]
Silva, E.M.; Lima, G.S.; Gheyi, H.R.; Nobre, R.G.; Sá, F.V.S.; Souza, L.P.; Soares, L.A.A. & Fernandes, P.D. (2017) - Photosynthetic pigments and photochemical efficiency in soursop under saline water irrigation and nitrogen sources. Journal of Agricultural Science, vol. 9, n. 12, p. 325-334. https://doi.org/10.5539/jas.v9n12p325 [ Links ]
Silva, E.M.; Nobre, R.G.; Souza, L.P.; Abrantes, D.S. & Andrade, A.B.A. (2015) - Efeito da adubação nitrogenada na formação de mudas de goiabeira irrigadas com águas salinizadas. Revista Verde de Agroecologia e Desenvolvimento Sustentável, vol. 10, n. 4, p. 42-48. http://dx.doi.org/10.18378/rvads.v10i4.3735 [ Links ]
Silva, E.N.; Ribeiro, R.V.; Ferreira-Silva, S.L.; Viégas, R.A. & Silveira, J.A.G. (2011) - Salt stress induced damages on the photosynthesis of physic nut young plants. Scientia Agrícola, vol. 68, n. 1, p. 62-68. http://dx.doi.org/10.1590/S0103-90162011000100010 [ Links ]
Sousa, A.B.O.; Bezerra, M.A. & Farias, F.C. (2011) - Germinação e desenvolvimento inicial de clones de cajueiro comum sob irrigação com água salina. Revista Brasileira de Engenharia Agrícola e Ambiental, vol. 15, n. 4, p. 390–394. [ Links ]
Taiz, L. & Zeiger, E. (2013) - Fisiologia vegetal. 5a ed. Porto Alegre: Artmed,. 954p. [ Links ]
Willadino, L. & Camara, T.R. (2010) - Tolerância das plantas à salinidade: aspectos fisiológicos e bioquímicos. Enciclopédia Biosfera, vol. 6, n. 11, p. 1-23. [ Links ]
Recebido/received: 2018.07.18
Recebido em versão revista/received in revised form: 2018.10.07
Aceite/accepted: 2018.10.08














