INTRODUCCIÓN
La acumulación de metales pesados en los suelos es un problema global que afecta negativamente a las funciones que el suelo desempeña. Por ejemplo, en suelos con influencias antrópicas se han reportado valores de hasta 6025 mg·kg-1 de níquel (Ni) (Kashulina, 2017). En general, cuando el nivel de metales supera un cierto umbral, es necesario aplicar algún tipo de tratamiendo de remediación para mitigar los efectos nocivos sobre el ecosistema. Para ello se recomienda el uso de enmiendas orgánicas para inmobilizar metales pesados en suelos (Bolan et al., 2014). Las enmiendas que más interesan son aquellas de bajo coste y que sean subproductos de otros tipos de industria, como la concha de mejillón triturada (CMT) o la corteza de pino (CP). Tanto la CMT como la CP son efectivas en la inmobilización de metales pesados in situ (Núñez-Delgado et al., 2021). No obstante, en ocasiones es necesario un tratamiendo más exhaustivo mediante técnicas ex situ, como el lavado del suelo. En este tipo de tratamientos ex situ, para la eliminación de los metales del suelo se suelen utilizar agentes quelantes como el EDTA (ácido etilendiaminotetraacético) (Hu et al., 2014). Una vez realizado el tratamiendo de remediación, la evaluación del suelo no se debe limitar a las fracciones del metal en el suelo, si no que también debe de tenerse en consideración el resto de funciones del suelo. La utlización de microorganismos como indicadores puede ser muy útil dadas las funciones esenciales que desempeñan en los suelos (Nannipieri et al., 2003). Una de las ténicas más sensibles con microorganismos como indicadores es la determinación de tolerancia de las comunidades microbianas a los metales (PICT: Pollution-induced Community Tolerance). El desarollo de tolerancia informa directamente sobre la toxicidad de un metal.
En este estudio se evalua la respuesta de comunidades bacterianas, en términos de tolerancia al Pb, después de aplicar trés técnicas de remediación (CMT, CP y EDTA) a un suelo contaminado. La hipótesis se basa en que si las técnicas de remediación han sido efectivas, la toxicidad del Pb disminuirá, y por tanto la tolerancia al Pb de las comundiades bacterianas también disminuirá.
MATERIAL Y MÉTODOS
Diseño experimental
Se seleccionó un suelo forestal natural desarrollado sobre anfibolita: pH 4,7, 19,6 % MO, 79 mg Ni·kg-1. Se contaminó el suelo seco, tamizado (2 mm) y homogeneizado mediante la aplicación de diferentes disoluciones de Ni(NO3)2·6H2O al suelo. Finalmente, se obtuviron las siguientes concentraciones finales: 2000, 1000, 500, 250 and 0 mg Ni·kg-1. Estos microcosmos se incubaron durante 30 días en oscuridad a 22ºC. Una vez pasado el tiempo de incubación, se aplicaron los tratamientos de remediación a los microcosmos. Por un lado, se añadieron 48 g·kg-1 de CMT y CP, individualmente, a los microcosmos. Por otro lado, se realizó el tratamiento de lavado del suelo con EDTA 0.1M mediante lixiviación en columnas (5 h EDTA 0,1M, 5 h agua destilada; 2,.5 mL·h-1). Una vez realizados los tratamiendos de remediación, se incubaron los microcosmos durante 60 días.
Determinación de tolerancia al Pb de la comunidad bacteriana
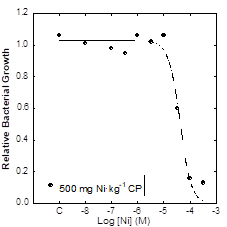
Terminada la incubación, se extrajo la suspensión bacteriana de cada microcosmos por el método de centrifugación-extracción (Bååth, 1992) utilizando MES 20 mM pH 6 (Lekfeldt et al., 2014). Cada suspension bacteriana se subdividió en microtubos a los que se añadieron 9 concentraciones de Ni(NO3)2·6H2O y un control de agua destilada. Las concentraciones de Ni en las supensiones bacterianas oscilaron entre 10-8 y 3.3 × 10-3 M. Posteriormente, en cada muestra se determinó el crecimiento bacteriano por el método de incorporación de leucina (Bååth et al., 2001).
Se obtuvo una curva dosis-respuesta para cada microcosmos (Figura 1). A partir de las curvas de inhibición se determinó log IC50 como índice de tolerancia: la concentración de Ni necesaria para inhibir al 50% el crecimiento bacteriano. Mayor log IC50 significa mayor tolerancia y mayor toxicidad del Ni; menor log IC50 significa menor tolerancia y menor toxicidad del Ni. Para cada tratamiento, se determinaron individualmente el incremento de tolerancia (∆log IC50) como la diferencia entre log IC50 entre 2000, 1000 y 500 mg·kg-1 y el suelo no contaminado. Se considera incremento de tolerancia, y por tanto toxicidad, si ∆log IC50>0.3.
RESULTADOS Y DISCUSIÓN
Para cada microcosmos se obtuvo una curva dosis-respuesta (o curva de inhibición) con forma sigmoidal: en general, el crecimiento bacteriano fue máximo ((1) en las concentraciones más bajas de Ni en las supensión bacteriana y, a medida que la concentración de Ni aumentó, el crecimiento bacteriano tendió a 0 (Figura 1). A partir de cada curva se determinaron los valores de tolerancia, es decir, log IC50.
En cuanto a la respuesta de las comunidades bacterianas a la adición de Ni, el desarrollo de tolerancia al Ni aumentó a medida que aumentó el nivel de Ni en el suelo (Figura 2). La tolerancia al Ni fue superior al nivel de referencia (∆log IC50>0.3 unidades logarítmicas) para 1000 y 2000 mg Ni·kg-1, pero no para 500 mg·kg-1.
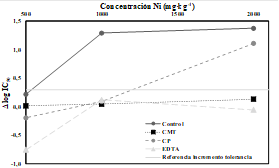
Figura 2 Incremento de tolerancia al Ni de la comunidad bacteriana (∆log IC50) en respuesta a trés niveles de contaminación por Ni (500, 1000 y 2000 mg·kg-1) y 3 tratamientos de remediación (CMT, CP y EDTA). La línea de referencia marca un valor de a ∆log IC50 = 0.3.
En cuanto a los tratamientos de remediación, cuando se aplicó al suelo contaminado corteza de pino triturada (CP), el desarrollo de tolerancia al Ni de las comunidades bacterianas aumentó en respuesta a la adición de Ni, superando el valor de referencia (0.3) en el suelo contaminado con 2000 mg Ni·kg-1 (∆log IC50 = 1.1) (Fig. 2). Es decir, la adición de CP redujo la toxicidad del Ni, pero sólo hasta cierto nivel de concentración. El efecto de la CP sobre la toxicidad del Ni puede deberse al aporte de materia orgánica y a la afinidad entre ésta y el Ni (Cutillas-Barreiro et al., 2014). Al añadir CP al suelo, aumenta el aporte de materia orgánica y el Ni se adsorbe a ésta formando complejos organometálicos que reducen la toxicidad del Ni para las comunidades bacterias.
Por otro lado, cuando el suelo contaminado se trató con concha de mejillón triturada (CMT), las comunidades bacterianas no mostraron tolerancia al Ni, para ninguna de las concentraciones estudiadas (Figura 2). Es decir, la adición de CMT al suelo redujo la toxicidad del Ni casi por completo, en términos de desarrollo de tolerancia de las comunidades bacterianas. La razón de este comportamiento puede deberse a que el pH del suelo aumenta como consecuencia de la adición de la CMT. Al aumentar el pH, la biodisponibilidad del Ni diminuye (Ramírez-Pérez et al., 2013) y resulta menos tóxico para las comunidades bacterianas.
De manera similar, cuando el Ni del suelo contaminado se retiró con un tratamiendo de lixiviación (EDTA), las comunidades bacterianas de ese suelo no mostraron desarrollo de tolerancia al Ni, para ninguna de las concentraciones de estudio (Figura 2). No obstante, analizando los resultados para la concentración más baja de Ni añadido (500 mg·kg-1), se puede observar que el icnremento de tolerancia de las comunidades bacterianas es mucho menor cuando el suelo se lava con EDTA (∆log IC50 = -0.75) que en el suelo control (∆log IC50 = 0.22). Esto sugiere que el EDTA hace que el Ni sea más tóxico para las bacterias. No obstante, esto no es posible ya que en el lavado del suelo con EDTA se retira el Ni biodisponible para reducir la toxicidad. Otra hipótesis es que el tratamiento del suelo con EDTA también afecta de manera negativa a la comunidad bacteriana. Por tanto, cuando las comunidades bacterianas se exponen al Ni son más sensibles y muestran menor tolerancia.
CONCLUSIONES
Se evaluaron tres técnicas de remediación suelos contaminados por Ni mediante la respuesta de las comunidades bacterianas del suelo en términos de desarrollo de tolerancia al Ni. La técnica de remediación más efectiva y menos nociva fue la concha de mejillón triturada, que redujo la disponibilidad de Ni incluso a 2000 mg Ni·kg-1. La corteza de pino fue efectiva únicamente hasta 1000 mg Ni·kg-1. Por último, el lavado de suelo con EDTA fue efectivo en términos de desarrollo de tolerancia de las comunidades bacterianas, no obstante, provocó efectos nocivos en la comunidad bacteriana en sí.