Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.42 no.1 Lisboa mar. 2019
https://doi.org/10.19084/RCA17068
ARTIGO
Ensaio sobre a bioatividade do solo sob plantio direto em sucessão e rotação de culturas de inverno e verão
Trial on soil bioactivity under no-tillage in succession or rotation of winter and summer crops
Mirian Barbieri1*, Mariana Ferneda Dossin1, Daiane Dalla Nora2, Willian B. dos Santos2, Caroline B. Bevilacqua3, Nariane de Andrade2, Madalena Boeni4, Dinis Deuschle1, Rodrigo J. S. Jacques1 e Zaida Inês Antoniolli1
1 Universidade Federal de Santa Maria, Centro de Ciências Rurais, Departamento de Solos, Santa Maria, Rio Grande do Sul, Brasil
2 Universidade Federal de Santa Maria, Santa Maria, Rio Grande do Sul, Brasil
3 Doutora em Ciências, Universidade Federal de Santa Maria, Centro de Ciências Rurais, Departamento de Defesa Fitossanitária, Santa Maria, Rio Grande do Sul, Brasil
4 Doutora em Ciência do Solo, Universidade Federal do Rio Grande do Sul. Pesquisadora na Fundação Estadual de Pesquisa Agropecuária, Júlio de Castilhos, Rio Grande do Sul, Brasil
(*E-mail: mirian.barbieri1993@hotmail.com)
RESUMO
A adoção de práticas conservacionistas alteram as propriedades físicas, químicas e biológicas do solo, influenciando a composição da comunidade microbiana. O trabalho objetivou obter informação sobre a qualidade, diversidade e atividade biológica do solo, quando submetido a dois tipos de manejo do solo (plantio direto escarificado (PDE) e não escarificado (PDNE) e três tipos de manejo de cobertura (Sucessão: soja-trigo, Rotação I: soja-nabo+trigo/soja-aveia+ervilhaca/ e Rotação II: soja-aveia+ervilhaca+nabo/milho-crotalária juncea-trigo/soja). Foram analisadas a biomassa microbiana, atividade enzimática, taxa de respiração basal e diversidade genética do solo, nos períodos do verão (fevereiro/2016) e inverno (setembro/2016). O carbono e nitrogênio da biomassa microbiana foram superiores nos tratamentos sob PDNE. Todas as enzimas apresentaram incremento na atividade no período do verão. Para a respiração basal dos microrganismos, a menor taxa de CO2 acumulada foi no período do verão em solo sob PDNE. Detectou-se variabilidade genética através da técnica de Random amplified polymorphic DNA (RAPD), reunindo os tratamentos em quatro grupos. Pode-se concluir que o sistema PDNE associado à rotação de culturas contribui para aumentar a biomassa microbiana e atividade enzimática no solo. Além disso, a técnica de RAPD associada a outros bioindicadores tornam-se importantes ferramentas para o monitoramento da qualidade do solo.
Palavras-chave: atividade enzimática, diversidade genética, escarificação, microrganismos, RAPD.
ABSTRACT
The adoption of conservation practices affect the physical, chemical and biological properties of the soil, altering the composition of the microbial community. The objective of this research was to obtain information about the soil quality, diversity and biological activity, of the soil when submitted to two types of soil management (scarified (PDE) and no-scarified tillage (PDNE)) and three types of cover management (Succession: soybean-wheat, Rotation I: Soybean-turnip+wheat/soybean-oats+vetch and Rotation II: soybean-oats+vetch+turnip/corn-crotalaria juncea-wheat/soybeans). The microbial biomass, enzymatic activity, basal respiration rate and soil genetic diversity were analyzed during the summer (february/2016) and winter (september/2016) periods. The carbon and nitrogen of the microbial biomass were higher in treatments under PDNE. All enzymes showed an increase in the activity during the summer period. For the basal respiration of the microorganisms, the smallest accumulated CO2 rate was in the summer period under PDNE. The RAPD technique proved to be efficient in the detection of genetic variability, combining treatments in four groups. We concluded that PDNE associated with crop rotation contributes to increase the levels of microbial biomass and soil enzymatic activity. In addition, the RAPD technique associated with other bioindicators become important tools for the monitoring and evaluation of soil quality.
Keywords: Enzymatic activity, genetical diversity, scarification, microorganisms, RAPD.
INTRODUÇÃO
Até meados do século XX, o grande problema das lavouras produtoras do Sul do Brasil era a erosão hídrica, decorrente do preparo convencional do solo. O revolvimento intenso e a incorporação ou queima de resíduos vegetais da cultura anterior deixavam o solo exposto à ação erosiva das chuvas, acarretando grandes perdas de solo, água, insumos agrícola e sementes (Oliveira et al., 2012).
A adoção, em larga escala, do sistema plantio direto, a partir dessa época, minimizou o problema. A rotação de culturas que é um dos princípios básicos para o sucesso do sistema plantio direto consiste, na alternância ordenada de diferentes culturas num espaço de tempo e na mesma área, sendo que uma espécie vegetal não é repetida no mesmo lugar, em um intervalo de tempo inferior a um ano. Já a sucessão de culturas, é a sequência de culturas dentro de um mesmo ano agrícola, como por exemplo, a sucessão soja/trigo. Ambas as práticas, visam à diminuição de patógenos e doenças, aumento do teor de matéria orgânica do solo, melhoria e manutenção de fertilidade, estruturação e descompactação, além da estabilidade da produtividade das espécies vegetais cultivadas (EMBRAPA, 2007).
Contudo, nos últimos anos, denota-se que falhas na implementação desse sistema, têm promovido retrocessos na conservação do solo em grande parte das lavouras. Alguns princípios básicos do sistema plantio direto, como rotação de culturas e manutenção do solo constantemente coberto, não têm sido utilizados. Como consequência de um conjunto de práticas inadequadas ao manejo, é notório o retorno gradativo da erosão hídrica em lavouras anuais produtoras de grãos no Rio Grande do Sul, associada a alterações nas propriedades físicas, químicas e biológicas do solo, o que compromete a estabilidade do sistema produtivo.
Tais alterações provocadas pelas práticas de manejo puderam ser observadas em trabalho realizado por Dadalto et al. (2015), que ao comparar o sistema plantio direto e preparo convencional (onde há revolvimento das camadas do solo), as parcelas sob plantio direto apresentaram incremento nos valores de carbono da biomassa microbiana, enquanto o preparo convencional apresentou maiores valores de quociente metabólico (qCO2). Os dados obtidos evidenciam que o plantio direto foi o sistema que apresentou menor interferência na atividade microbiológica do solo, concluindo que esse sistema proporciona maior biomassa microbiana e menor perda relativa de carbono via respiração, sendo possível determinar, assim, maior acúmulo de carbono no solo em longo prazo.
O mesmo observa-se em trabalho realizado por Mendes et al. (2003) cujo objetivo era avaliar a distribuição da biomassa microbiana e da atividade enzimática do solo sob vegetação nativa, sistema de plantio direto e preparo convencional. Concluiu-se que os sistemas de manejo (plantio direto e convencional) influenciaram o perfil de distribuição das propriedades biológicas do solo e a atividade enzimática mostrou um incremento no sistema plantio direto. Nesse sentido, fica evidente a importância da adoção de práticas sustentáveis que tem por objetivo a melhoria e a manutenção das propriedades físicas, químicas e biológicas do solo.
Diante disso, a hipótese deste trabalho é que há influência dos sistemas de manejo de plantio direto com sucessão e rotação de culturas na qualidade, diversidade e atividade biológica do solo. Os objetivos foram obter informações sobre a qualidade, diversidade e atividade biológica do solo, nos diferentes sistemas de manejo do solo, através da atividade das enzimas urease, fosfatase ácida e hidrólise do diacetato de fluoresceína, carbono e nitrogênio da biomassa microbiana, taxa de respiração basal dos microrganismos e análise da diversidade genética por meio da técnica de Random Amplified Polymorphic DNA (RAPD).
MATERIAL E MÉTODOS
Caracterização da área experimental
O experimento vem sendo conduzido desde 2013 na área experimental pertencente à Fundação Estadual de Pesquisa Agropecuária (FEPAGRO), no município de Júlio de Castilhos, na região central do Estado do Rio Grande do Sul, situado o 29°1339 de latitude sul e a 53°4038 de longitude oeste (Londero, 2015). O solo é classificado como um Nitossolo Vermelho (EMBRAPA, 2013). Anteriormente à instalação do experimento, a área vinha sendo há 20 anos cultivada sob semeadura direta com soja no verão e trigo, aveia e azevém no inverno. A escarificação do solo foi realizada em outubro de 2013, anteriormente à instalação do experimento, utilizando-se escarificador de sete hastes, atuando até 30 cm de profundidade. O cultivo das culturas comerciais e de cobertura de solo que constituem o manejo de cobertura foi conduzido de forma mecanizada, sob semeadura direta, de acordo com as recomendações técnicas para cada cultura. No decorrer do estudo, a umidade do solo da área experimental apresentou valores médios de 19,5 no período de verão e 22,6 no período de inverno.
Os tratamentos consistem de uma sucessão e duas rotações de culturas associadas ao sistema PDE e PDNE, totalizando seis tratamentos, com três repetições de cada tratamento, os quais foram distribuídos no delineamento experimental de blocos ao acaso com três repetições, totalizando 54 unidades experimentais: T1) Sucessão soja-trigo + compactação natural; T2) Sucessão soja-trigo + escarificação; T3) Rotação soja-nabo+trigo/soja-aveia+ervilhaca/soja + compactação natural; T4) Rotação soja-nabo+trigo/soja-aveia+ervilhaca/soja + escarificação; T5) Rotação soja-aveia+ervilhaca+nabo/milho-crotalária juncea-trigo/soja + compactação natural; T6) Rotação soja-aveia+ervilhaca+nabo/milho-crotalária juncea-trigo/soja + escarificação.
Solo para análise microbiológica
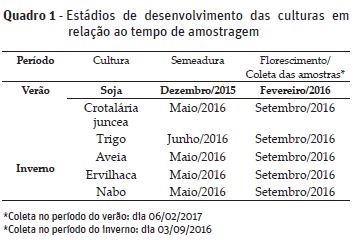
O solo foi coletado na camada de 0-10 cm de profundidade, com auxílio de trado calador. Foram coletadas 8 sub-amostras em zigue-zague na parcela para a formação das amostras compostas de cada unidade experimental. As amostras foram acondicionadas em sacos plásticos e colocadas em caixas de isopor com gelo para a preservação do material biológico (Suleiman et al., 2013). As amostragens foram realizadas em duas épocas do ano, verão (fevereiro/2016) e no inverno (setembro/2016), (Quadro 1). Na sequência, o material foi peneirado (2 mm), homogeneizado e refrigerado a 4ºC, com umidade de campo, até o momento da realização das análises.
Biomassa microbiana
Carbono e nitrogênio da biomassa microbiana
Para a determinação do carbono e do nitrogênio da biomassa microbiana do solo foi utilizada a metodologia de fumigação-extração proposta por Vance et al. (1987).
O processo de fumigação consiste em incubar as amostras em estufa a vácuo (TE-395, Tecnal) sob atmosfera de clorofórmio, retirando-se o ar do interior do dessecador com auxílio de uma bomba de vácuo (TE-0581, Tecnal), repetindo esta operação até a percepção do borbulhamento do clorofórmio. Após 24 horas de fumigação, as amostras fumigadas e não fumigadas seguiram para o processo de extração, onde foram transferidas para frascos de vidro do tipo snap-cap, com capacidade para 100 mL, contendo solução de K2SO4 0,5 mol L-1 com pH ajustado para 6,5–6,8. Posteriormente, os frascos foram agitados por 30 minutos em agitador horizontal, após passaram por um período de decantação e foram filtrados em papel filtro qualitativo. Os extratos filtrados foram utilizados para determinação do carbono em analisador elementar (TOC-L/TN, Shimadzu).
Atividade enzimática do solo
Urease
A atividade da enzima urease foi determinada conforme (Dick et al., 1996). Foram pesados 5g de solo em tubos tipo Falcon e adicionados 9 mL da solução de Tris hidroximetil aminometano (THAM) 0,05M e 1 mL da solução de ureia 0,2M e após mantidas em incubadora BOD (MA415, Marconi) a 37ºC por duas horas, com exceção dos controles. Após o período de incubação a 37ºC, retiraram-se as amostras e foi adicionado 30 mL de solução refrigerada de KCl-Ag2SO4, posteriormente, o volume foi ajustado para 50 mL com adição de KCl-Ag2SO4. A determinação do N-NH4+ na suspensão de solo foi realizada de acordo com metodologia descrita por Tedesco et al. (1995).
Fosfatase ácida
A atividade da enzima fosfatase ácida foi determinada conforme (Dick et al., 1996), com adaptações propostas por Verchot e Borelli (2005). Amostras de 1 g de solo foram pesadas em tubos tipo Falcon, em seguida, foram adicionados 4 mL de solução MUB pH 6,5 (Tris hidroximetil aminometano + ácido malêico + ácido cítrico + ácido bórico – dissolvido em 488 mL de solução de NaOH 1 mol L-1) em todos os tubos e 1 mL de solução de PNP 0,5 M L-1 (p-nitrofenil fosfato dissódico), com exceção dos controles. Após, as amostras foram mantidas em incubadora a 37ºC por uma hora.
Passado o período de incubação, foi adicionado 4 mL de solução de NaOH 0,5 mol L-1, 1 mL de CaCl2 0,5 mol L-1, parando a atividade da enzima fosfatase e 1 mL de PNP 0,5M (somente nos controles). Após isso as amostras foram filtradas em papel filtro (Whatman nº 4). A intensidade da coloração amarela do extrato foi determinada em espectrofotômetro (UV-M51 UV-VISÍVEL, BEL Engineering) a 410 nm.
Hidrólise do diacetato de fluoresceína (FDA)
A determinação da hidrólise do diacetato de fluoresceína (FDA) foi realizada de acordo com Green et al. (2006). O método tem como princípio a permanência da fluoresceína na célula causando fluorescência intracelular que pode ser quantificada por espectrofotometria. Para isso, 1g de solo foi incubado com 20 mL de solução tampão de fosfato de sódio 60 mM e 0,1 mL de solução de FDA 4,8 mM a 25ºC em shaker sob agitação de 100rpm durante 2 horas, neste momento também foram preparadas as amostras controle (solo sem adição da solução de FDA 4,8 mM). Após, foi adicionado em cada amostra 20 mL de acetona com o objetivo de cessar a reação enzimática e 0,1 mL da solução de FDA nas amostras controle. As amostras foram filtradas em papel filtro (Whatman nº 4) e a intensidade da coloração do extrato foi medida em espectrofotômetro a 490 nm.
Atividade microbiana do solo
Taxa de respiração basal
A taxa respiração basal foi estimada através da quantidade de CO2 liberado do solo durante um período de 21 dias de incubação, utilizando metodologia proposta por Stotzky (1965). As unidades experimentais foram constituídas de recipientes de vidro de aproximadamente 1 L, ficando hermeticamente fechados. Foram utilizadas amostras de 100 g de solo, mantidas em incubadora com temperatura de 26ºC.
O CO2 liberado foi capturado por 20 mL de uma solução de NaOH 0,5 M. Após 7 dias de incubação, o NaOH 0,5 M foi quantificado por titulação com solução de HCl 0,5 mol L-1, sendo adicionado imediatamente antes 1 mL de BaCl2 1M, para impedir que o Na2CO3 formado através do processo de respiração fosse desdobrado em NaOH + CO2. Posteriormente, acrescentaram-se três gotas de indicador ácido/base fenolftaleína 1%.
Novos copos plásticos com 20 mL de solução de NaOH 0,5 M foram colocados nos frascos de vidro para subsequentes períodos de incubação. Foram realizadas três titulações, sendo aos 7, 14 e 21 dias após a incubação.
Análise estatística
Os dados obtidos foram submetidos à análise de variância (ANOVA) e quando ocorreram diferenças significativas pelo teste F, se aplicou às médias, o teste de Tukey ao nível de 5% de significância, com o auxílio do programa estatístico SISVAR (Ferreira, 2000).
Análise molecular
O solo utilizado para análise molecular foi coletado na camada de 0-10 cm de profundidade. As amostragens foram realizadas em zigue-zague na parcela com trado calador, sendo sempre esterilizado com álcool 70% entre um tratamento e outro. O solo foi acondicionado em tubos tipo Falcon de 15 mL, colocado em caixas de isopor com gelo para a preservação do material biológico e mantido à -20ºC até o momento da realização da análise molecular.
Para a extração do DNA genômico total, 250 mg de solo foram processados usando o Kit Power Soil® (MOBIO, Carlsbad, CA, USA), seguindo o protocolo do fabricante.
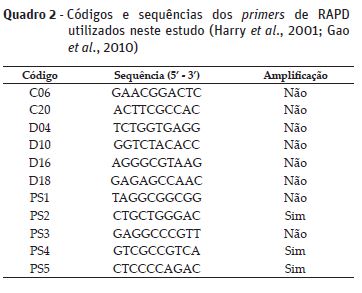
Foram testados 11 primers (Quadro 2) e as reações de amplificação foram preparadas em volume final de 10 μL contendo 10x Taq buffer, 25 mM DNTPs, 25 pmol primers, 2 mM MgCl2, 1U/μl Taq DNA polimerase, 10 ng DNA e água ultrapura (Harry et al., 2001; Gao et al., 2010). A análise dos resultados foi realizada através da presença (1) e ausência (0) de bandas utilizando o software PyElph (Pavel e Vasile, 2012) e a análise dos componentes principais (PCA) foi realizada através do software STATISTICA 7.0 (Statsoft Inc., Tulsa, OK, EUA).
RESULTADOS E DISCUSSÃO
Biomassa microbiana
Carbono e nitrogênio da biomassa microbiana
Durante o período do inverno (setembro/2016), não foram observadas diferenças significativas entre os tratamentos para o carbono da biomassa microbiana (CBM). Já para a coleta realizada no verão (fevereiro/2016), o tratamento 5 (T5), que corresponde ao sistema de rotação II associada ao plantio direto não escarificado (PDNE), apresentou um incremento no CBM quando comparado com os demais tratamentos, apresentando valor de 102,8 mg kg-1 solo seco. Os menores valores foram observados para os tratamentos 1 e 2 (T1 e T2), sendo 87,9 e 83,9 mg kg-1 solo seco, respectivamente (Quadro 3).
Ao estudar a comunidade microbiana em solos com elevado aporte de cobertura vegetal e ausência de revolvimento para a cultura da soja Alves et al. (2011) encontraram valores relativamente maiores de CBM, para a região centro-oeste do Brasil, tendo em vista o acúmulo de material orgânico, que fornece maior fonte de nutrientes para o desenvolvimento da comunidade microbiana. Esses resultados são semelhantes aos obtidos por Eekeren et al. (2008), que observaram valores de biomassa microbiana mais elevados em solos sob plantio direto, em relação ao sistema que empregava a escarificação do solo.
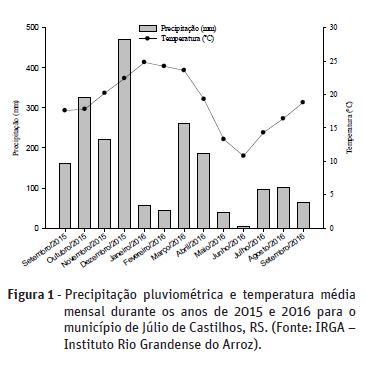
Semelhantemente ao CBM, o nitrogênio da biomassa microbiana (NBM), não apresentou diferença estatística para as análises realizadas no período do inverno. Entretanto, para as coletas realizadas no verão, o maior valor observado para a variável NBM também, foi no tratamento 5 (T5), apresentando valor de 14,5 mg kg-1 solo seco, diferindo estatisticamente dos demais tratamentos onde também foi empregado o PDNE (Quadro 3). O plantio direto escarificado (PDE) não apresentou diferença estatística significativa entre os tratamentos em ambos os períodos de coleta. Os menores valores foram observados para os tratamentos 1 e 2 (T1 e T2), sendo 12,4 e 11,1 mg kg-1 solo seco, respectivamente (Quadro 3). Os dados do presente estudo corroboram com Silveira et al. (2006) e Lourente et al. (2010) que observaram um incremento da biomassa microbiana do solo em períodos chuvosos (Figura 1). Sendo assim, os altos níveis de biomassa microbiana encontrados podem ser atribuídos à disponibilidade de nutrientes, carbono orgânico e resíduos de plantas no solo, além de maiores teores de umidade do solo e temperatura (Lourente et al., 2010).
Atividade enzimática do solo
Urease
No Quadro 4 estão apresentados os valores da atividade das enzimas urease, fosfatase ácida e FDA no solo, sendo possível observar diferença estatística somente para as enzimas fosfatase ácida e FDA.
A atividade da enzima urease não apresentou diferença estatística significativa entre os tratamentos avaliados. Entretanto, é importante ressaltar que nos tratamentos sob PDNE foram observados os maiores valores de atividade enzimática, em ambos os períodos de coleta independente da cultura empregada (Quadro 4).
Ao avaliar os tratos culturais utilizados, pode-se observar que os sistemas não promoveram alterações evidentes na atividade da enzima urease nas diferentes épocas amostradas. Estes resultados assemelham-se aos que foram obtidos por Conti et al. (1998), no qual a atividade da urease não diferiu entre as rotações utilizadas, na região do Pampa da Argentina. Os resultados obtidos neste trabalho com relação à atividade enzimática estão de acordo com outros estudos realizados, os quais demonstram que ao comparar os sistemas de PDNE e PDE, a atividade da enzima urease também esteve superior no sistema PDNE (Lanna et al., 2010; Lisboa et al., 2012a).
No Rio Grande do Sul, Silveira (2007), observou que aqueles sistemas sob PDNE apresentaram maiores valores de atividade da enzima urease quando comparados ao PDE. Seguindo a mesma tendência, uma maior atividade de urease em sistemas de plantio direto também pode ser observada por Roldán et al. (2005). Estes autores obtiveram valores de atividade enzimática duas vezes maior nas áreas de PDNE em relação às áreas de PDE.
Fosfatase ácida
Houve uma grande variação entre as épocas de coleta com relação à atividade da fosfatase ácida (cerca de 118,2% para o verão e 142,5% para o período do inverno), sendo as amostras coletadas no período do verão as que apresentaram maior atividade. Não foi possível observar variação na atividade da enzima para o tipo de manejo de solo utilizado, entretanto com relação às comparações entre os sistemas de culturas foi observada diferença somente na sucessão (soja-trigo) quando comparada com as rotações I e II, o que indica que houve influência das culturas utilizadas (Quadro 4).
Na coleta realizada no período do verão, os valores para a atividade da fosfatase ácida variaram de 431,4 μg de p-nitrofenol h-1 g- 1solo seco, em área de PDNE, a 941,0 μg de p-nitrofenol h-1 g- 1solo seco, para o PDE.
Nas amostras coletadas no inverno, observou-se uma variação menor na atividade enzimática, os valores variaram de 217,2 a 526,4 μg de p-nitrofenol h-1 g- 1solo seco. A maior atividade desta enzima foi observada no tratamento 5 (T5), sob sistema de PDNE, e a menor atividade no tratamento 2 (T2), em solo escarificado. Estes valores estão dentro de uma faixa normalmente encontrada em diversos estudos em sistemas de cultivo, variando de 23 a 2100 μg de p-nitrofenol h-1 g- 1solo seco, tendo média de aproximadamente 617 mg de p-nitrofenol kg-1 solo h-1, para análises realizadas em solo com umidade de campo (Conte et al., 2002; Mendes et al., 2003; Mankolo et al., 2012).
A maior atividade da fosfatase ácida em sistemas de PDNE também foi observada por Lisboa et al. (2012a), onde a atividade da fosfatase ácida foi significativamente superior em áreas sob PDNE que em PDE, com valores variando de 302,6 à 61,5 μg de p-nitrofenol h-1 g-1 solo seco, respectivamente. Esse resultado é similar ao obtido por Roldán et al. (2005), em que a maior atividade da enzima está relacionada as atividades dos fungos micorrízicos arbusculares. No presente trabalho, também podem ser observados valores superiores para a atividade da fosfatase ácida nos tratamentos 2 e 6 (T2 e T6), ambos sob solo escarificado, coletados no período do verão. Estes resultados podem ser explicados devido ao fato de que a atividade microbiana tende a diminuir em períodos com temperaturas mais amenas, e aumentar quando as temperaturas são mais elevadas (Silveira, 2007).
Hidrólise do diacetato de fluoresceína (FDA)
Semelhante ao observado na atividade das outras enzimas analisadas, a hidrólise de FDA apresentou atividade enzimática superior na coleta realizada no verão em comparação à realizada no inverno. Além disso, os resultados obtidos foram superiores para todos os tratamentos sob PDNE, quando comparado ao PDE, porém essa diferença não foi significativa (Quadro 4). Estes resultados corroboram com os encontrados por Correa et al. (2009), onde também obtiveram valores para a hidrólise de FDA superiores em solo com compactação natural após cultivo com milho. Ainda segundo Silva et al. (2004), a atividade microbiológica está diretamente relacionada com o acúmulo de matéria orgânica na superfície do solo, o que pode ser obtido através de práticas conservacionistas como o plantio direto.
Os valores da hidrólise de FDA variaram de 57,8 a 69,5 μg de fluoresceína h-1 g-1 solo seco, na amostragem realizada no verão, e de 27,1 a 48,5 μg de fluoresceína h-1 g-1 solo seco, na amostragem realizada no inverno. A menor atividade no período do verão foi observada no tratamento 4 (T4), que corresponde ao sistema de rotação I associado ao PDE e a maior atividade no tratamento 5 (T5), sistema de rotação II em solo sob PDNE.
De acordo com José et al. (2013), a atividade microbiana é influenciada pelos sistemas de manejo, o que demonstra uma redução dos valores quando em condições de manejo convencional, o que pode ser causado pelo fato de não haver adição de material orgânico como fonte de nutrientes para os microrganismos. Além disso, o tipo de manejo e o tipo de cultura podem resultar em alterações na composição física, química e na microbiota do solo (Matsuoka et al., 2002). Essas alterações nas propriedades físico-químicas interferem nas funções do solo, pois podem, por exemplo, afetar a disponibilidade de nutrientes e/ou interferir na atividade enzimática (Maia et al., 2010).
Para as coletas realizadas no período do inverno, pode-se observar diferença estatística significativa para o manejo de solo utilizado. A rotação I quando associada ao PDE, apresentou resultado cerca de 24,6% maior em comparação com o PDNE na mesma rotação. Além disso, houve diferença significativa para as culturas utilizadas em solo sob PDNE. Nota-se que a rotação II proporcionou um incremento de 19,2% na hidrólise de FDA, quando comparada com a rotação I, demonstrando que os sistemas de cultivo têm grande influência na atividade enzimática dos solos agrícolas (Zatorre et al., 2011).
Atividade microbiana do solo
Taxa de respiração basal
Os valores obtidos para a taxa de respiração basal (C-CO2) não apresentaram diferença estatística significativa entre os tratamentos nos dois períodos de amostragem. Contudo, os maiores valores de C-CO2 foram observados no período do verão, nos tratamentos submetidos ao PDE (T2, T4 e T6) sendo, 196,8, 247,7 e 260,1 mg C-CO2 kg-1solo seco, respectivamente. Já para as amostragens realizadas no período do inverno, os maiores valores obtidos foram nos tratamentos com solo sob PDNE (T1, T3 e T5), com valores de 350,8, 348,3 e 319,8 mg C-CO2 kg-1solo seco, respectivamente (Quadro 5).
Dentre os atributos biológicos sensíveis às alterações nos sistemas de manejo do solo e culturas, a biomassa microbiana, recebe um papel de destaque, representando a parte viva da matéria orgânica, respondendo intensamente às flutuações de umidade, temperatura, manejo e qualidade dos resíduos, podendo ser uma potencial fonte de C-CO2 à atmosfera (Singh e Sidhu, 2014). Um dos principais fatores que determina se o solo pode atuar como fonte ou dreno de C-CO2 é a escolha do sistema de manejo. Sistemas de manejo que aumentem a adição de resíduos vegetais e a retenção de carbono no solo se constituem em alternativas importantes, para aumentar a capacidade de dreno do C-CO2 atmosférico e mitigação dos problemas relacionados ao aquecimento global (Amado et al., 2001; Bayer et al., 2006).
Os resíduos vegetais que são mantidos em superfície (PDNE) resultam em menores taxas de decomposição quando comparados aos resíduos que são incorporados ao solo (PDE), onde a decomposição é promovida devido às alterações nas condições microclimáticas do solo, principalmente relacionadas ao contato (Parton et al., 1996). Além disso, os sistemas em que os resíduos são mantidos em superfície apresentam, ainda, vantagens relacionadas à melhoria na qualidade do solo, como a lenta e gradual adição de carbono no sistema, menor amplitude térmica, manutenção da umidade, favorecendo no acúmulo de matéria orgânica do solo (Bayer e Mielniczuk, 2008).
Com base nos resultados obtidos, pode-se observar que houve maiores emissões de C-CO2 em solo sob PDE no período do verão. Isto pode ser explicado, devido ao fato de que na escarificação, o contato solo/resíduo é aumentado devido ao revolvimento do solo (Lupwayi et al., 2004; Giacomini et al., 2007). O revolvimento do solo, prática utilizada no PDE, promove o rompimento dos agregados, liberando o CO2 preso nos espaços porosos (Reicosky, 1997). Além disso, a combinação de temperaturas elevadas no período do verão somadas a não cobertura do solo, podem também influenciar a atividade microbiana, ocasionando uma maior difusividade de C-CO2 para a atmosfera, e aumento da amplitude térmica (Lisboa et al., 2012b).
Já os menores valores de C-CO2 observados no PDNE, estão estreitamente relacionados à lenta e gradual ciclagem dos resíduos culturais, promovidas pelo não revolvimento do solo, liberando compostos orgânicos que estimulam a formação e a estabilidade de agregados (Elliot, 1986; Reicosky et al., 1995; Assis e Lanças, 2010). Como consequência, a MOS fica menos exposta aos processos microbianos, reduzindo a taxa de mineralização e resultando em um menor fluxo de CO2 para a atmosfera refletindo em uma biomassa microbiana mais eficiente (Costa et al., 2013).
Diversidade genética
Através da técnica de RAPD foi possível verificar a variabilidade genética entre os tratamentos adotados no presente estudo. Dos 11 primers de RAPD testados, três foram selecionados (PS2, PS4 e PS5) por serem mais informativos e produzirem bandas mais nítidas.
Os resultados obtidos através da análise dos componentes principais (PCA) indicam variabilidade genética presente entre os tratamentos (Figura 2), o que separou-os em 4 grupos. Os tratamentos 2, 5 e 6 (T2, T5 e T6) não apresentaram variabilidade genética entre eles, sendo, portanto, agrupados como semelhantes.
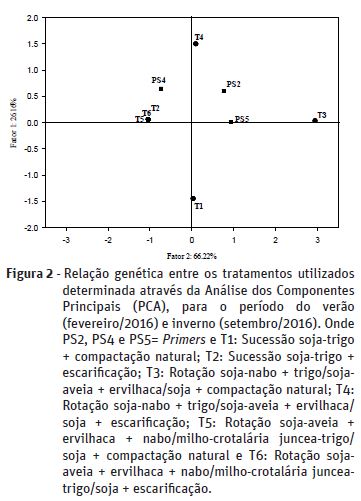
Estes resultados estão de acordo com os encontrados por Gao et al. (2010), que afirmam que as técnicas em conjunto tornam-se importantes métodos para a análise da diversidade microbiana. Isto pode ser observado nas outras análises realizadas, como a BMS e atividade enzimática. Nota-se que sempre os menores valores foram observados nos tratamentos submetidos a tratos culturais mais simples (sucessão soja-trigo), que é o caso do tratamento 1 (T1). Com o resultado da análise de RAPD, pode-se verificar que este tratamento não possui amplificação com nenhum dos primers e também foi o tratamento que apresentou menor valor para a atividade da enzima fosfatase ácida (431,4 μg de p-nitrofenol h-1 g-1 solo seco) o que leva a concluir que este tratamento possui menor diversidade microbiana, ou até mesmo, menor número de microrganismos, quando comparado com os demais tratamentos.
Gao et al. (2010), ao empregar os mesmos primers (PS1, PS2, PS3, PS4 e PS5) utilizados neste estudo para avaliar a estrutura da comunidade microbiana em amostras de solo, concluíram que a técnica de RAPD e outros bioindicadores utilizados para avaliar a comunidade microbiana como a taxa de respiração basal e atividade enzimática, em conjunto, tornam-se importantes métodos para a avaliação da qualidade do solo.
Além disso, outros primers podem ser utilizados para análise tanto da diversidade quanto da similaridade microbiana do solo, o que pode ser observado em outros trabalhos realizados empregando a técnica de RAPD (Dhief et al., 2011; Martins et al., 2014; Parvin et al., 2016). Do mesmo modo, além da técnica de RAPD, outros métodos podem ser utilizados para a análise da diversidade genética em amostras de solo, como a técnica de DGGE, ARDRA, T-RFLP, RISA, e SSCP, as quais permitem obter um perfil da comunidade microbiana (Bresolin et al., 2010).
Diante dos resultados obtidos, de forma geral, o uso da diversidade microbiana, atividade enzimática e biomassa microbiana do solo como indicador de qualidade do solo vêm globalmente, avançando muito. Isso porque tem se tornado consenso no mundo todo, de que a diversidade microbiana possui importantes vantagens como indicador de qualidade do solo, além da importância como nicho ambiental para outros organismos do solo (Aburjaile et al., 2011).
CONCLUSÕES
O sistema plantio direto não escarificado (PDNE) proporcionou um incremento no conteúdo de carbono e nitrogênio da biomassa microbiana, na ordem sucessão < rotação I < Rotação II.
Todas as enzimas avaliadas (urease, fosfatase ácida e FDA) apresentaram incremento na atividade enzimática no período do verão, o que demonstra que essas enzimas possuem suas atividades influenciadas pela temperatura.
A taxa de respiração basal do solo foi um bom indicador para demonstrar as alterações na atividade da microbiota nos diferentes sistemas de manejo avaliados, pois demonstrou ser um atributo sensível às variações de temperatura, manejo, umidade e qualidade de resíduos avaliados.
A técnica de RAPD mostrou-se eficiente na detecção da variabilidade genética entre os tratamentos e gerou um perfil de marcadores genéticos que podem ser utilizados em posteriores trabalhos para avaliar a diversidade genética em solos agrícolas.
O plantio direto não escarificado (PDNE) associado à rotação de culturas contribui para um aumento nos valores de biomassa microbiana, atividade enzimática e estoque de C no solo. Estes bioindicadores associados com a técnica de RAPD tornam-se importantes ferramentas para o monitoramento e avaliação da qualidade, atividade e diversidade biológica do solo no Sul do Brasil.
Referências bibliográficas
Aburjaile, S.B.; Silva, M.P.; Batista, E.A.F.S.; Barbosa, L.P.J.L. e Barbosa, F.H.F. (2011) - Pesquisa e caracterização da diversidade microbiológica do solo, na região de São José Do Buriti – MG, em decorrência da substituição de cobertura florestal nativa (cerrado) por plantações de eucalipto. Ciência Equatorial, vol. 1, n. 2, p. 69-81. [ Links ]
Alves, T.S.; Campos, L.L.; Neto, N.E.; Matsuoka, M. e Loureiro, M.F (2011) - Biomassa e atividade microbiana de solo sob vegetação nativa e diferentes sistemas de manejos. Acta Scientiarum. Agronomy, vol. 33, n. 2, p. 341-347. [ Links ]
Amado, T.J.C.; Bayer, C.; Eltz, F.L.F. e Brum, A.C.R. (2001) - Potencial de culturas de cobertura em acumular carbono e nitrogênio no solo no plantio direto e a melhoria da qualidade ambiental. Revista Brasileira de Ciência do Solo, vol. 25, n. 1, p. 189-197. http://dx.doi.org/10.1590/S0100-06832001000100020 [ Links ]
Assis, R.L. e Lanças, K.P. (2010) - Agregação de um nitossolo vermelho distroférrico sob sistemas de plantio direto, preparo convencional e mata nativa. Revista Engenharia Agrícola, vol. 30, n. 1, p.58-66. http://dx.doi.org/10.1590/S0100-69162010000100006 [ Links ]
Bayer, C.; Martin-Neto, L. Mielciczuk, J.; Pavinato, A. e Dieckow, J (2006) - Carbon sequestration in two Brazilian Cerrado soils unde no-till. Soil Tillage Research, vol. 86, n. 2, p. 237-245. https://doi.org/10.1016/j.still.2005.02.023 [ Links ]
Bayer, C. e Mielniczuk, J. (2008) - Dinâmica e função da matéria orgânica. In: Santos, G.A.; Silva, L.S.; Canellas, L.P. e Camargo, F.A.O. (Eds.) - Fundamentos da matéria orgânica do solo: Ecossistemas tropicais e subtropicais. 2ª Ed. Porto Alegre: Metrópole, 654p. [ Links ]
Bresolin, J.D.; Bustamante, M.M.C.; Krüger, R.H.; Silva, M.R.S.S. e Perez, K.S. (2010) - Structure and composition of bacterial and fungal community in soil under soybean monoculture in the Brazilian Cerrado. Brazilian Journal of Microbiology, vol. 40, n. 2, p. 391-403. http://dx.doi.org/10.1590/S1517-83822010000200021 [ Links ]
Conte, E.; Anghinoni, I. e Rheinheimer, D.S. (2002) - Fósforo da biomassa microbiana e atividade de fosfatase ácida após aplicação de fosfato em solo no sistema plantio direto. Revista Brasileira de Ciência do Solo, vol. 26, n. 4, p. 925-930. http://dx.doi.org/10.1590/S0100-06832002000400009 [ Links ]
Conti, M.E.; Palma, R.M.; Arrigo, N.M.; Zourarakis, D.P. e Cappelletti, C.A. (1998) - Long-term rotation effect of soybean with no-till maize on soil N availability indices and microbial activity in the Argentine Pampa. Soil and Tillage Research, vol. 49, n. 3, p. 267-270. https://doi.org/10.1016/S0167-1987(98)00178-0 [ Links ]
Correa, M.L.P.; Galvão, J.C.C.; Fontanetti, A.; Miranda, G.V.M. e Santos, M.M. (2009) - Atividade Microbiana Enzimática (FDA) como Indicador Microbiológico da Qualidade de Solos em Sistemas de Plantio Direto de Milho Orgânico e Convencional. Revista Brasileira de Agroecologia, vol. 4, n. 1, p. 1450-1454. [ Links ]
Costa, E.M.; Silva, H.F. e Ribeiro, P.R.A. (2013) - Matéria orgânica do solo e seu papel na manutenção e produtividade dos sistemas agrícolas. Enciclopédia Biosfera, vol. 9, p. 1842-1860. [ Links ]
Dadalto, J.P.; Fernandes, H.C.; Teixeira, M.M.; Cecon, P.R. e Matos, A.T. (2015) - Sistema de preparo do solo e sua influência na atividade microbiana. Journal of the Brazilian Association of Agriculture Engineering, vol. 35, n. 3, p. 506-513. [ Links ]
Dhief, A.; Guasmi, F.; Triki, T.; Mohamed, N. e Aschi-smiti, S. (2011) - Natural genetic variation in Calligonum Tunisian genus analyzed by RAPD markers. African Journal of Biotechnology, vol. 10, n. 48, p. 9766-9778. [ Links ]
Dick, R.P.; Breackwell, D.P. e Turco, R.F. (1996) - Soil enzyme activities and biodiversity measurements as integrative microbiological indicators. In: Doran, J.W.; Jones, A.J. (Eds.) - Methods for assessing soil quality. Madison: SSSA, p.247-241. [ Links ]
Eekeren, N.V.; Bommelé, L.; Bloem, J.; Schouten, T.; Rutgers, M.; Goede, R.; Reheul, D. e Brussaard, L. (2008) - Soil biological quality after 36 years of ley-arable cropping, permanent grassland and permanent arable cropping. Applied Soil Ecology, vol. 40, n. 3, p. 432-446. https://doi.org/10.1016/j.apsoil.2008.06.010 [ Links ]
Elliot, E.T. (1986) - Aggregate structure and carbon, nitrogen and phosphorus in natives and cultivated soils. Soil Science Society of America Journal, vol. 50, n. 3, p. 627-633. http://dx.doi.org/10.2136/sssaj1986.03615995005000030017x [ Links ]
EMBRAPA (2007) –Rotação de culturas. Londrina: Empresa Brasileira de Pesquisa Agropecuária - Soja. Circular Técnica 45. [ Links ]
Embrapa (2013) - Sistema Brasileiro de Classificação de Solos. 2. ed. Brasília: Empresa Brasileira de Pesquisa Agropecuária. 306 p. [ Links ]
Ferreira, D.F. (2000) - Sistemas de análise estatística para dados balanceados. Lavras: UFLA/DEX/SISVAR, 145p. [ Links ]
Gao, Y.; Mao, L.; Miao, C.Y.; Zhou, P.; Cao, J.J.; Zhi, Y.E. e Shj, W.J. (2010) - Spatial characteristics of soil enzyme activities and microbial community structure under different land uses in Chongming Island, China: Geostatistical modelling and PCR-RAPD method. Science of the Total Environment, vol. 408, n. 16, p. 3251-3260. https://doi.org/10.1016/j.scitotenv.2010.04.007 [ Links ]
Giacomini, S.J.; Recous, S.; Mary, B. e Aita, C. (2007) - Simulating the effects of N availability, straw particle size and location in soil on C and N mineralization. Plant and Soil, vol. 301, n. 1-2, p. 289-301. https://doi.org/10.1007/s11104-007-9448-5 [ Links ]
Green, V.S.; Stott, D.E. e Miack, M. (2006) - Assay for fluorescein diacetate hydrolytic activity: Optimization for soil samples. Soil Biology & Biochemistry, vol.38, n. 4, p.693-701. https://doi.org/10.1016/j.soilbio.2005.06.020 [ Links ]
Harry, M.; Jusseaume N.; Gambier, B. e Garnier-Sillam, E. (2001) – Use of RAPD markers for the study of microbial community similarity from termite mounds and tropical soils. Soil Biology & Biochemistry, vol. 33, n. 4-5, p. 471-427. https://doi.org/10.1016/S0038-0717(00)00181-4 [ Links ]
José, J.B.S.; Rieff, G.G. e Sá, E.L.S. (2013) - Edaphic mesofauna and microbial activity in different soil management systems in the culture of tobacco. Current Agricultural Science and Technology, vol. 19, n. 1, p. 56-66. http://dx.doi.org/10.18539/CAST.V19I1.3136 [ Links ]
Lanna, A.C.; Silveira, P.M.; Silva, M.B.; Ferraresi, T.M. e Kliemann, H.J. (2010) - Atividade de urease no solo com feijoeiro influenciada pela cobertura vegetal e sistemas de plantio. Revista Brasileira de Ciência do Solo, vol. 34, n. 6, p. 1933-1939. [ Links ]
Lisboa, B.B.; Vargas, L.K.; Abichequer, A.D.; Camargo, F.A.O. e Selbach, P.A. (2012a) - Biomassa microbiana, atividade e diversidade metabólica em um Argissolo sob diferentes manejos. Pesquisa Agropecuária Gaúcha, vol. 18, p. 175-192. [ Links ]
Lisboa, B.B.; Vargas, L.K.; Silveira, A.O.; Martins, A.F. e Selbach, P.A. (2012b) - Indicadores Microbianos de Qualidade do Solo em Diferentes Sistemas de Manejo. Revista Brasileira de Ciência do Solo, vol. 36, n. 1, p. 45-55. http://dx.doi.org/10.1590/S0100-06832012000100004 [ Links ]
Londero, A.L. (2015) - Perdas de água e sedimento de bacias pareadas de ordem zero sob plantio direto com e sem terraço. 156 p. Dissertação (Mestrado em Ciência do Solo) – Universidade Federal de Santa Maria, Santa Maria, RS. [ Links ]
Lourente, E.R.P.; Mercante, F.M.; Marchetti, M.E.; Souza, L.C.F.; Souza, C.M.A.; Gonçalves, M.C. e Silva, M.A.G. (2010) - Rotação de culturas e relações com atributos químicos e microbiológicos do solo e produtividade do milho. Semina: Ciências Agrárias, vol. 31, p. 829-842. [ Links ]
Lupwayi, N.Z.; Clayton, G.W.; O´donovan, J.T., Harker, K.N., Turkington, T.K. e Rice, W.A. (2004) - Decomposition of crops residues under conventional and zero tillage. Canadian Journal of Soil Science, vol. 84, n. 4, p. 403-410. https://doi.org/10.4141/S03-082 [ Links ]
Maia, S.M.F.; Ogle, S.M.; Cerri, C.C. e Cerri, C.E.P. (2010) - Changes in soil organic carbon storage under different agricultural management systems in the Southwest Amazon Region of Brazil. Soil & Tillage Research, vol. 106, n. 2, p. 177-188. https://doi.org/10.1016/j.still.2009.12.005 [ Links ]
Mankolo, R.; Reddy, C.; Senwo, Z.; Nyakatana, E. e Sajjala, S. (2012) - Soil Biochemical Changes Induced by Poultry Litter Application and Conservation Tillage under Cotton Production Systems. Agronomy, vol. 2, n. 3, p. 187-198. http://dx.doi.org/10.3390/agronomy2030187 [ Links ]
Martins, E.C.A.; Peluzio, J.M.; Coimbra, R.R.; Silveira, M.A.; Oliveira, J.D.D. e Junior, W.P.O. (2014) - Genetic diversity in sweet potato in Tocantins. Bioscience Journal, vol. 30, p. 429-435. [ Links ]
Matsuoka, M.; Mendes, I.C. e Loureiro, M.F. (2002) - Biomassa microbiana e atividade enzimática em solos de Cerrado e sistemas agrícolas aunais e perenes na região de Primavera do Leste. Planaltina, DF: Embrapa Cerrados, 24p. [ Links ]
Mendes, I.C.; Souza, L.V.; Resck, D.V.S. e Gomes, A.C. (2003) - Propriedades biológicas em agregados de um latossolo vermelho-escuro sob plantio convencional e direto no cerrado. Revista Brasileira de Ciência do Solo, vol. 27, n. 3, p. 435-443. http://dx.doi.org/10.1590/S0100-06832003000300005 [ Links ]
Oliveira, J.G.R.; Ralisch, R.; Guimarães, M.F.; Barbosa, G.M.C. e Filho, J.T. (2012) - Erosão no plantio direto: Perda de solo, água e nutrientes. Boletim Geografia, vol. 30, n. 3, p. 91-98. http://dx.doi.org/10.4025/bolgeogr.v30i3.17644 [ Links ]
Parton, W.J.; Ojima, D.S. e Schimel, D.S. (1996) - Models to evaluate soil organic matter storage and dynamics. In: Carter, M.R. e Stewart, B.A. (Eds.) - Structure and Organic Matter Storage in Soils. Lewis Publ., CRC Press, Boca Raton, FL, p. 421–448. [ Links ]
Parvin, N.; Bilkiss, M.; Nahar, J.; Siddiqua, M.K. e Meah, M.B. (2016) - RAPD analysis of Sclerotium rolfsii isolates causing collar rot of eggplant and tomato. International Journal of Agricultural Research, Innovation and Technology, vol. 6, n. 1, p. 47-57. http://dx.doi.org/10.3329/ijarit.v6i1.29212 [ Links ]
Pavel, A.B. e Vasile, C.I. (2012) - PyElph-A software tool for gel analysis and phylogenetics. BMC Bioinformatics, vol. 13, art. 9. https://doi.org/10.1186/1471-2105-13-9 [ Links ]
Reicosky, D.C. (1997) - Tillage-induced CO2 emissions from soil. Nutrient Cycling in Agroecosystems, vol. 49, n. 1-3, p. 273-285. https://doi.org/10.1023/A:100976651 [ Links ]
Reicosky, D.C.; Kemper, W.D.; Langdale, G.W.; Douglas, J.R. e Rasmussen, P.E. (1995) - Soil organic matter changes resulting from tillage and biomass production. Journal of Soil and Water Conservation, vol. 50, n. 3, p. 253-261. [ Links ]
Roldán, A.; Salinas-Garcia, J.R.; Alguacil, M.M.; Díaz, E. e Caravaca, F. (2005) - Soil enzyme activities suggest advantages of conservation tillage practices in sorghum cultivation under subtropical conditions. Geoderma, vol. 129, n. 3-4, p. 178-185. https://doi.org/10.1016/j.geoderma.2004.12.042 [ Links ]
Silva, M.; Siqueira, E.R. e Costa, J.L.S. (2004) - Hidrólise de diacetato de fluoresceína como bioindicador da atividade microbiológica de um solo submetido a reflorestamento. Revista Ciência Rural, vol. 34, n. 5, p. 1493-1496. http://dx.doi.org/10.1590/S0103-84782004000500025 [ Links ]
Silveira, A.O. (2007) - Atividades enzimáticas como indicadores biológicos da qualidade de solos agrícolas do Rio Grande do Sul. 94 p. Dissertação (Mestrado em Ciência do Solo) – Universidade Federal do Rio Grande do Sul, Porto Alegre/RS. [ Links ]
Silveira, R.B.; Melloni, R. e Melloni, E.G.P. (2006) - Atributos microbiológicos e bioquímicos como indicadores da recuperação de áreas degradadas, em Itajubá/MG. Cerne, vol. 12, p. 48-55. [ Links ]
Singh, Y. e Sidhu, H.S. (2014) - Management of Cereal Crop Residues of Sustainable Rice-Wheat. Production System in the Indo – Gangetic Plains of India. Proceedings of the Indian National Science Academy, vol. 80, p. 95–114. http://dx.doi.org/10.16943/ptinsa/2014/v80i1/55089 [ Links ]
Stotzky, G. (1965) - Microbial respiration. In: Black, C.A. (Ed.) - Methods of soil analysis. American Society of Agronomy, vol. 2, p. 1550-1570. [ Links ]
Suleiman, A.K.A.; Lupatini, M.; Boldo, J.T.; Pereira, M.G. e Roesch, L.F.W. (2013) - Shifts in soil bacterial community after eight years of land-use change. Systematic and Applied Microbiology, vol. 36, n. 2, p. 137-144. https://doi.org/10.1016/j.syapm.2012.10.007 [ Links ]
Tedesco, M.J.; Gianello, C.; Bissani, C.A; Bohnen, H. e Volkweiss, S.J. (1995) - Análises de solo, planta e outros materiais. 2ed. (Boletim técnico, 5), Porto Alegre: UFRGS. [ Links ]
Vance, E.D.; Brookes, P.C. e Jenkinson, D.S. (1987) - An extraction method for measuring soil microbial biomass. Soil Biology & Biochemistry, vol. 19, n. 6, p.703-707. https://doi.org/10.1016/0038-0717(87)90052-6 [ Links ]
Verchot, L.V. e Borelli, T. (2005) - Application of para-nitrophenol (pNP) enzyme assays in degraded tropical soils. Soil Biology & Biochemistry, vol. 37, n. 4, p. 625-633. https://doi.org/10.1016/j.soilbio.2004.09.005 [ Links ]
Zatorre, N.P.; Almeida, R.F.; Franchini, J.C.; Chaer, G.M.; Boddey, R.M. e Jantalia, C.P. (2011) - Influência dos sistemas agrícolas na atividade enzimática do solo. Embrapa Agrobiologia, 60p. [ Links ]
Recebido/received: 2017.03.20
Recebido em versão revista/received in revised form: 2017.09.12
Aceite/accepted: 2017.10.10














